- 316.00 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
郎溪县 2013~2014 学年度九年级第一次调研检测
化 学 试 题
题号 一 二 三 总分
得分
可能用到的相对原子质量:C-12 H-1 N-14 O-16 Cl-35.5 Ca-40
一、选择题(每小题 2 分,共 20 分。每小题的 4 个备选答案中只有一个符合题意。请
把正确的选项填在后面的表格中。)
1.新修订的《环境空气质量标准》增设了 PM2.5 平均浓度限值,PM2.5 是指 大气中直径小于或等于 2.5
微米的颗粒物,也称为可入肺颗粒物,主要来源于直接排放的工业污染物和汽车尾气等,是形成雾霾天
气的最大元凶。下列情况不会引起雾霾天气的是
A 就地焚烧秸秆 B 鼓励使用太阳能热水器 C 鼓励开私家车出行 D 吸烟
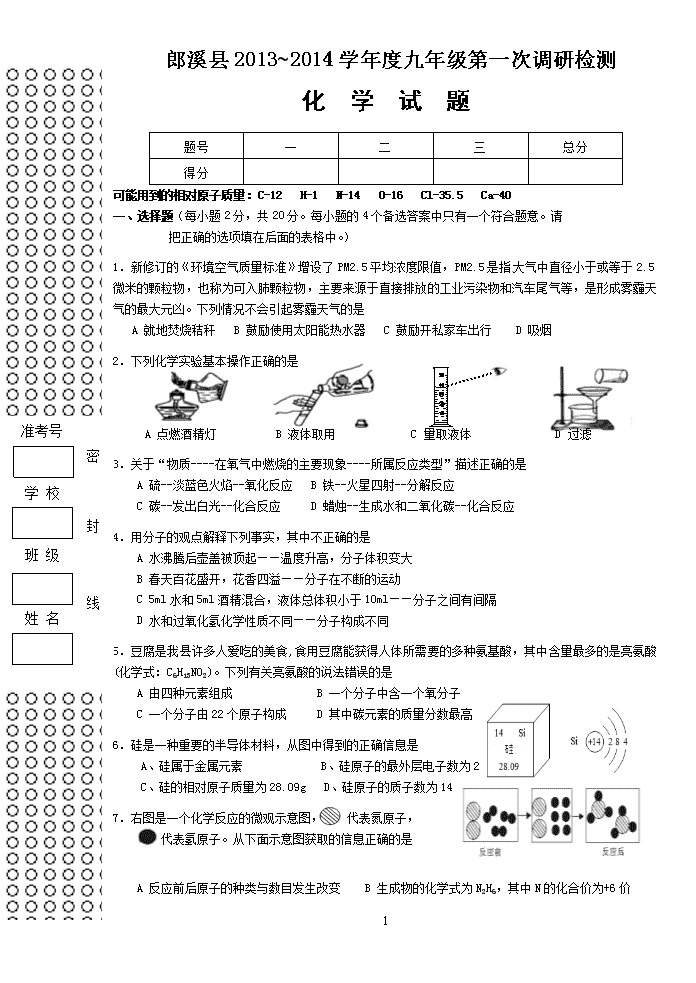
2.下列化学实验基本操作正确的是
A 点燃酒精灯 B 液体取用 C 量取液体 D 过滤
3.关于“物质----在氧气中燃烧的主要现象----所属反应类型”描述正确的是
A 硫--淡蓝色火焰--氧化反应 B 铁--火星四射--分解反应
C 碳--发出白光--化合反应 D 蜡烛--生成水和二氧化碳--化合反应
4.用分子的观点解释下列事实,其中不正确...的是
A 水沸腾后壶盖被顶起——温度升高,分子体积变大
B 春天百花盛开,花香四溢——分子在不断的运动
C 5ml 水和 5ml 酒精混合,液体总体积小于 10ml——分子之间有间隔
D 水和过氧化氢化学性质不同——分子构成不同
5.豆腐是我县许多人爱吃的美食,食用豆腐能获得人体所需要的多种氨基酸,其中含量最多的是亮氨酸
(化学式:C6H13N02)。下列有关亮氨酸的说法错误..的是
A 由四种元素组成 B 一个分子中含一个氧分子
C 一个分子由 22 个原子构成 D 其中碳元素的质量分数最高
6.硅是一种重要的半导体材料,从图中得到的正确信息是
A、硅属于金属元素 B、硅原子的最外层电子数为 2
C、硅的相对原子质量为 28.09g D、硅原子的质子数为 14
7.右图是一个化学反应的微观示意图, 代表氮原子,
代表氢原子。从下面示意图获取的信息正确的是
A 反应前后原子的种类与数目发生改变 B 生成物的化学式为 N2H6,其中 N 的化合价为+6 价
准考号
学 校
班 级
姓 名
密
封
线
2
C 反应前两种分子的个数比是 1:2 D 该反应的基本类型是化合反应
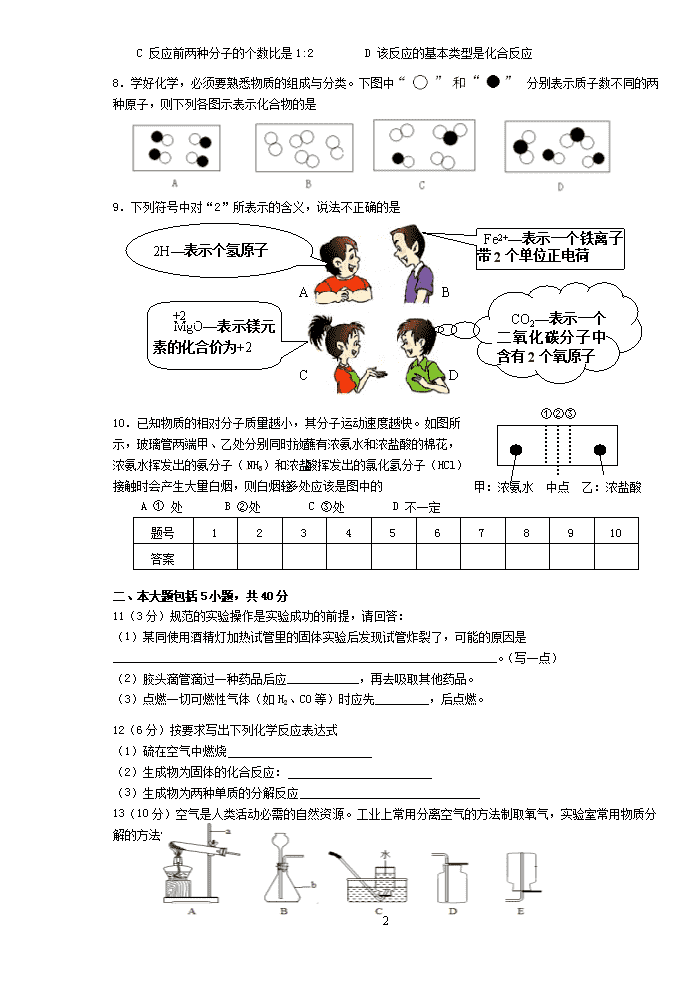
8.学好化学,必须要熟悉物质的组成与分类。下图中 分别表示质子数不同的两
种原子,则下列各图示表示化合物的是
9.下列符号中对“2”所表示的含义,说法不正确...的是
10.已知物质的相对分子质量越小,其分子运动速度越快。如图所
示,玻璃管两端甲、乙处分别同时放蘸有浓氨水和浓盐酸的棉花,
浓氨水挥发出的氨分子( NH3)和浓盐酸挥发出的氯化氢分子(HCl)
接触时会产生大量白烟,则白烟较多处应该是图中的
A ① 处 B ②处 C ③处 D 不一定
题号 1 2 3 4 5 6 7 8 9 10
答案
二、本大题包括 5 小题,共 40 分
11(3 分)规范的实验操作是实验成功的前提,请回答:
(1)某同使用酒精灯加热试管里的固体实验后发现试管炸裂了,可能的原因是
________________________________________________________________。(写一点)
(2)胶头滴管滴过一种药品后应____________,再去吸取其他药品。
(3)点燃一切可燃性气体(如 H2、CO 等)时应先_________,后点燃。
12(6 分)按要求写出下列化学反应表达式
(1)硫在空气中燃烧
(2)生成物为固体的化合反应:
(3)生成物为两种单质的分解反应
13(10 分)空气是人类活动必需的自然资源。工业上常用分离空气的方法制取氧气,实验室常用物质分
解的方法制取氧气。
①②③
甲:浓氨水 中点 乙:浓盐酸
MgO—表示镁元
素的化合价为+2
Fe2+—表示一个铁离子
带 2 个单位正电荷2H—表示个氢原子
CO2—表示一个
二氧化碳分子中
含有 2 个氧原子
+2
A B
C D
3
(1)工业制氧气是变化________(填“物理”或“化学”)变化。
(2)图中仪器 a 的名称是___________,b 的名称是___________。
(3)实验室用用高锰酸钾制取氧气,可选择_________作气体发生装置(填字母代号),此法制取氧气的
化学反应表达式为_________________________________________________,当用 C 收集氧气时,当看到
_____________________________________时表明气体已收集满。
(4)组装仪器时连接玻璃管和胶皮管的操作时先把玻璃管口 ,然后稍稍用力即可把
玻璃管插入胶皮管,检查 B 装置气密性的方法是___________________________;
(5)实验室制取 H2 气体时,既可用 C 或 E 装置收集.由此推测 H2 所具有的物理性质是 (填序
号). a.密度大于空气 b.难溶于水 c.密度小于空气.
14(4 分)水是生命之源,人类的日常生活与工农业生产都离不开水。
(1)如图 1 所示。通电一段时间后,试管 1 中所收集的气体为________,该实验说明水是由_________
组成的。
(2)图 2 是用来净化天然水的简易装置,下面分析正确的是___________(填序号)。
A.能杀菌消毒 B.能得到纯净水 C.能把硬水变为软水 D.能使天然水变得无色澄清
(3)图 3 是自来水厂的净水过程示意图,某同学检验所得自来水是否为硬水,他的实验方法为
_________________________________________。
15(5 分)某研究小组发现,维 C 泡腾片(保健药
品,主要成分见图 1)溶于水,有许多气泡产生(如
图 2)。该小组同学进行如下探究。
探究一:该气体的成分。
【猜想与假设】小华说:该气体可能是 CO2、O2、CO、H2、N2。
小明说:不可能含有 N2,因为__________________________________。
小芳说:不可能含有 CO 和 H2,因为从药品安全角度考虑, CO 有毒且易燃易爆;H2 ___________。
该小组同学认为:该气体可能含有 CO2、O2 中的一种或两种。
【进行实验】
实验编号 实验操作 实验现象
① 将气体通入澄清的石灰水中 澄清石灰水变浑浊
② 将带火星的木条伸入该气体中 带火星的木条没有复燃
【得出结论】(1)由实验①可知,该气体中肯定含有___ ___。
(2)由实验②___ ___(填“能”或“不能” )确定该气体中不含氧气,理由是
___________________________________________________
主要成分
维生素 C(C6H9O6)
碳酸氢钠(NaHCO3)
柠檬酸(C6H8O7)
4
16.(6 分)某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)为探究催化剂的种类对氯酸钾分解速度的影响,甲设计以下对比实验:
Ⅰ.将_______g KClO3 与 1.0 g MnO2 均匀混合加热
Ⅱ.将 3.0 g KClO3 与 1.0 g CuO 均匀混合加热
在相同温度下,比较两组实验产生 O2 的快慢。
(2)乙探究了影响双氧水分解速度的某种因素。实验数据记录如下:
双氧水的体积 双氧水的浓度 MnO2 的质量 相同时间内产生 O2 的体积
Ⅰ 50.0 ml 3% 0.1 g 9 mL
Ⅱ 50.0 ml 7% 0.1 g 16 mL
先请写出乙实验中所发生化学反应的表达式:___ _____
本实验中,测量 O2 的体积可选用下图中的______(填字母序 号)。
实验结论:__________ ____________________。
(3)甲同学再实验中对黑色的 CuO 很感兴趣,他认为 CuO 中的阳离子符号应写为_______
三、17(6 分)“хх”钙片主要成份是碳酸钙[化学式为:CaCO3 ]和维生素 D,下图为“商品标签图,
请根据标签的有关信息,完成下列计算。
(1)碳酸钙中钙、碳、氧元素的质量比为_______
(2)每片钙片中至少含钙元素的质量为多少克?
(3)每片钙片中钙元素的质量分数至少是多少?
(第 2、3 小题写出计算过程,每小题 2 分)
密
封
线
5
郎溪县 2013~2014 学年度九年级第一次调研检测
化学试卷参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 B B C A B D D A B C
二、填空题
反应表达式每空 2 分外,其它每空均 1 分
反应表达式:写文字表达式和化学式表式均可,写化学式表达式的配平不
作要求。 其它各空合理即可。
11 (1)合理即可,(2)洗,(3)验纯
12(1)S+O2 点燃 SO2 (2)、(3)合理即可
13(1)物理,(2)铁架台,锥形瓶(3)A, ,气泡向集
气瓶口外冒(4)合理即可(5)bc
14 (1)氢气,氢氧元素(2)D(3)取少量自来水加肥皂水振荡
15 反应物无 N 元素,可燃,(1)二氧化碳(2)不能,不是纯氧气,
16 3; C;双氧水水浓度越大反应越快;Cu2+
17(1)40:12:48 (2) 1.5 克×(40÷100)=0.6 克;(3)0.6 克÷2
克×100%=30%