- 927.00 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
中学初中化学竞赛选拨试题
可能用到的相对原子质量:H-1 C-12 O-16 Ca-40
一.选择题(本题共16个小题,每题3分,共48分。)
1.在探索地球上生命的起源活动中,美国科学家米勒做了一个著名的实验,他模拟原始大气的成份将甲烷、氨、氢和水蒸气混合,放人真空的玻璃仪器中进行实验。一个星期后,他惊奇地发现仪器中果然有数种氨基酸生成。你从米勒的实验中能得出的结论是 ( )
A. 一定发生了化学变化 B.没有发生化学变化
C. 无法判断是否发生了化学变化 D.一定没有发生物理变化”
2.天文工作者已在宇宙中发现了H3分子。下列关于H3分子的说法正确的是( )
A . H2和H3物理性质完全相同 B .每个H3分子中含有一个H2分子和一个H原子
C. H2和H3化学性质完全相同 D. H2和H3是不同的物质
3.金属活动性的强弱与人类开发和利用这些金属单质的时间顺序有着某种内在联系。由此推断,下列金属中人类开发利用最晚的是 ( )
A. Cu B.Fe C.Ag D.Al
4.下列各物质①甲烷 ②煤 ③碘酒 ④钢 ⑤石油 ⑥碳酸钙 ⑦水煤气。其中属于含有碳元素的混合物是( )
A.①②④⑤⑦ B.②④⑤⑦ C.②③④⑤⑦ D.②④⑤⑥⑦
5.在一个密闭容器中,充入a个CO分子和b个O2分子,在一定条件下充分反应后,容器内碳原子个数和氧原子个数之比是 ( )
A.a/(a+2b) B.a/2(a+b) C.a/b D.a/2b
6.根据下表列出的氯的含氧酸跟它对应的氧化物(叫酸酐)的化合价关系。判断HNO3的酸酐是 ( )
含氧酸
HClO
HClO2
HClO3
HClO4
对应酸酐
Cl2O
Cl2O3
Cl2O5
Cl2O7
A.NO B.NO2 C.N2O3 D.N2O5
7.下列叙述不符合化学史实的是 ( )
A.中国是最早使用“湿法冶金”的国家 B.我国化学家侯德榜发明了联合制碱法
C.法国化学家拉瓦锡经实验得出空气是由氧气和氮气组成的 D.瑞典化学家舍勒首先发现了电子
8.下列做法有利粮食产量持续稳定增长的是 ( )
A.注意经常喷洒农药防止病虫害 B. 逐年增加单位面积上硫铵的施用量
C.将农家肥与化学肥料结合施用 D.将草木灰、硝酸铵、过磷酸钙混合施用
9.据统计,世界上的古建筑在20世纪所遭受的腐蚀比过去几百年甚至几千年所遭受的腐
蚀还要严重,其中最可能的原因是 ( )
A.管理部门维修不及时,引起古建筑的腐蚀
B.化石燃料大量使用,形成酸雨,加速了古建筑的腐蚀
C.参观的人数急剧增多,加速了古建筑的磨损
D.温室效应加剧,加速了古建筑的风化
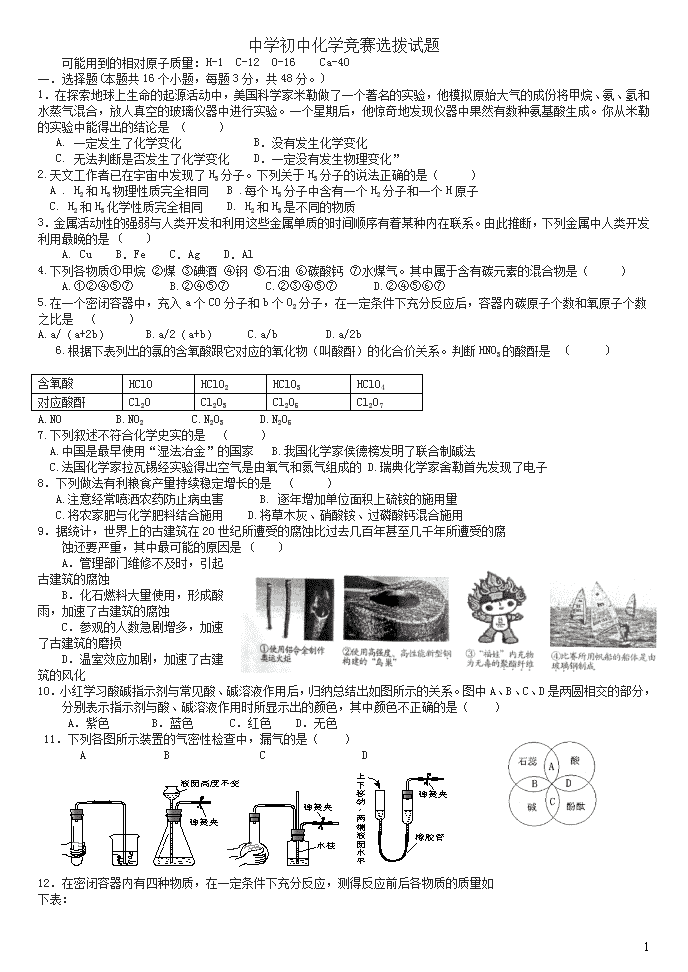
10.小红学习酸碱指示剂与常见酸、碱溶液作用后,归纳总结出如图所示的关系。图中A、B、C、D是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,其中颜色不正确的是( )
A.紫色 B.蓝色 C.红色 D.无色
11.下列各图所示装置的气密性检查中,漏气的是( )
A B C D
12.在密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如
下表:
7
物质
X
Y
Z
Q
反应前质量/g
8
2
20
5
反应后质量/g
待测
10
8
13
下列说法正确的是( )
A.反应后X的质量为6g B.该反应的反应物是X、Y
C.参加反应的X、Z的质量比是1:3 D. Y、Q的相对分子质量比一定为1:1
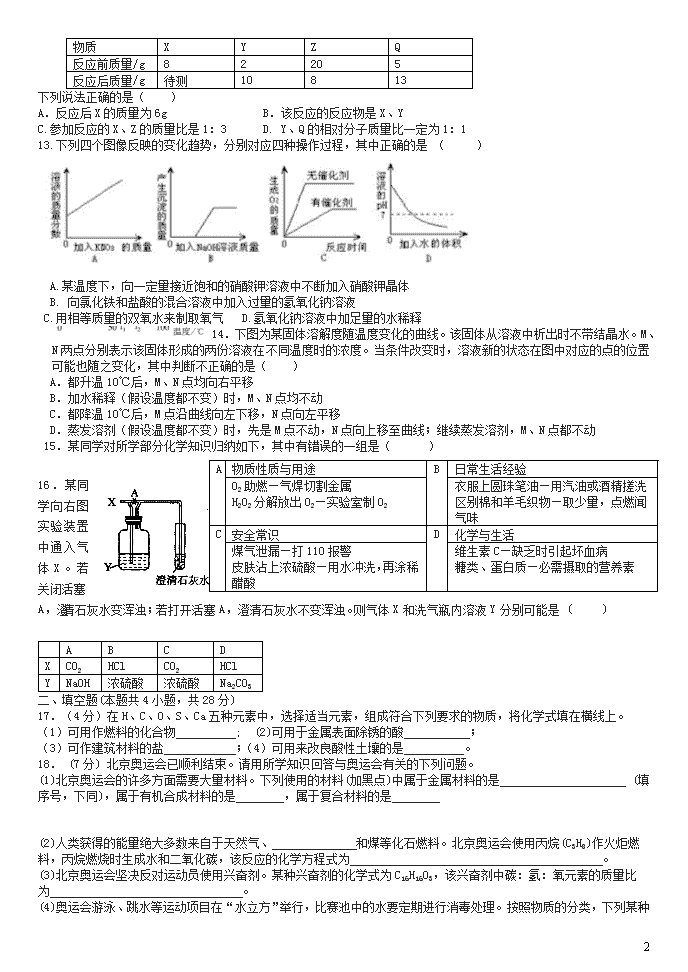
13.下列四个图像反映的变化趋势,分别对应四种操作过程,其中正确的是 ( )
A.某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
B. 向氯化铁和盐酸的混合溶液中加入过量的氢氧化钠溶液
C.用相等质量的双氧水来制取氧气 D.氢氧化钠溶液中加足量的水稀释
14.下图为某固体溶解度随温度变化的曲线。该固体从溶液中析出时不带结晶水。M、N两点分别表示该固体形成的两份溶液在不同温度时的浓度。当条件改变时,溶液新的状态在图中对应的点的位置可能也随之变化,其中判断不正确的是( )
A.都升温10℃后,M、N点均向右平移
B.加水稀释(假设温度都不变)时,M、N点均不动
C.都降温10℃后,M点沿曲线向左下移,N点向左平移
D.蒸发溶剂(假设温度都不变)时,先是M点不动,N点向上移至曲线;继续蒸发溶剂,M、N点都不动
15.某同学对所学部分化学知识归纳如下,其中有错误的一组是( )
A
物质性质与用途
B
日常生活经验
O2助燃—气焊切割金属
H2O2分解放出O2—实验室制O2
衣服上圆珠笔油—用汽油或酒精搓洗
区别棉和羊毛织物—取少量,点燃闻气味
C
安全常识
D
化学与生活
煤气泄漏—打110报警
皮肤沾上浓硫酸—用水冲洗,再涂稀醋酸
维生素C—缺乏时引起坏血病
糖类、蛋白质—必需摄取的营养素
16.某同学向右图实验装置中通入气体X。若关闭活塞A,澄清石灰水变浑浊;若打开活塞A,澄清石灰水不变浑浊。则气体X和洗气瓶内溶液Y分别可能是 ( )
A
B
C
D
X
CO2
HCl
CO2
HCl
Y
NaOH
浓硫酸
浓硫酸
Na2CO3
二、填空题(本题共4小题,共28分)
17.(4分)在H、C、O、S、Ca五种元素中,选择适当元素,组成符合下列要求的物质,将化学式填在横线上。
(1)可用作燃料的化合物 ; (2)可用于金属表面除锈的酸 ;
(3)可作建筑材料的盐 ;(4)可用来改良酸性土壤的是 。
18. (7分) 北京奥运会已顺利结束。请用所学知识回答与奥运会有关的下列问题。
(1)北京奥运会的许多方面需要大量材料。下列使用的材料(加黑点)中属于金属材料的是 (填序号,下同),属于有机合成材料的是 ,属于复合材料的是
(2)人类获得的能量绝大多数来自于天然气、 和煤等化石燃料。北京奥运会使用丙烷(C3H8)作火炬燃料,丙烷燃烧时生成水和二氧化碳,该反应的化学方程式为 。
(3)北京奥运会坚决反对运动员使用兴奋剂。某种兴奋剂的化学式为C16H16O3,该兴奋剂中碳:氢:氧元素的质量比为 。
(4)奥运会游泳、跳水等运动项目在“水立方”
7
举行,比赛池中的水要定期进行消毒处理。按照物质的分类,下列某种消毒剂与其他三种消毒剂不属于同一类的是 (填序号)。
A.Cl2 B.KMnO4 C.Ca(OH)2 D.CuSO4
19.(5分))2008年5月12日14时28分,在四川汶川县发生了8.0级地震。地震是一种突发的自然灾害,震后生态环境和生活条件受到极大破坏,卫生基础设施损坏严重,供水设施遭到破坏,饮用水源会受到污染,是导致传染病发生的潜在因素。能否解决群众供水问题是关系震后能否控制大疫的一个关键问题。灾区人们日常生活用水及饮用水都要经过一系列的净化才能使用。请你解决如下的问题:
(1)为了除去水中的不溶性杂质,可采取的操作是 。
(2)当地震过后,你如何将污水变成清洁用水?
———————————————————————————————————
(3)除去河水中的不溶性杂质后,请设计实验证明水样是硬水:
——————————————————————————————————
(4)有人说“饮用天然矿泉水对人体健康有益,矿泉水微量元素的含量越多越好”,你认为这种说法是否正确?为什么?
20.(5分)铁是自然界分布最广的金属元素之一,在地壳中的质量约占5%左右。铁矿石的种类很多,重要的有磁铁矿石(主要成分Fe3O4)、赤铁矿石(主要成分Fe2O3)等。
⑴高炉中用赤铁矿炼铁的主要化学方程式为 ,其中氧化铁中的氧被夺去,发生 反应。分析该反应中各元素的化合价可知:物质发生氧化反应的元素,其化合价会 (填“升高”、“降低”或“不变”)。
⑵在常温下,铁跟水不起反应。但是,在水和空气里的氧气等共同作用下,铁容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。刷油漆是重要的防腐蚀措施之一,油漆防腐蚀的主要原理是 。
⑶铁元素是人体的重要营养元素,举一例说明铁元素在人体中的重要作用
。
21.(7分)有四家化学制剂厂排放的废水的主要成分分别为
厂 名
A厂
B厂
C厂
D厂
废水的主要成分
CuCl2
HCl
Na2CO3
NaOH
为防止污染保护环境,四厂决定联合处理废水。其处理过程如下:
碱性溶液
酸性溶液
( )厂废水
( )厂废水(过量)
( )厂废水
( )厂废水(过量)
甲池
乙池
沉淀物S
气体G
丙池
中性溶液L
⑴在括号内填上化学制剂厂的代号。
⑵写出废水处理中发生的化学反应的方程式:甲池 ,乙池 ,丙池 。
三.实验探究题(本题共3小题,共18分)
22.(4分)(1)A、B是实验室二种常见的玻璃仪器。 22题(2)图
下表内已绘制其中2种仪器局部特征,请你分别根据其用途补绘剩余部分。
仪器
主要用途
用作少量试剂的反应容器,收集少量气体,装配小型气体发生器。
用作配制溶液和较大量试剂的反应容器,在常温或加热时使用。
(2)下列装置图是实验室制取二氧化碳的常用发生装置,你认为它有什么优点:
。能用该发生装置制取的气体还有 (任填一种)。
23.(5分)小海、小林、小明三同学一起测定双氧水溶液中溶质的质量分数。
7
查阅资料:2H2O2 2H2O+ O2↑;常温下氧气密度为1.42g/L。
设计原理:将一定质量的双氧水样品与二氧化锰混合,测定反应产生的氧气的质量,计算出H2O2的质量,继而得双氧水溶液中溶质的质量分数。
过程方法:
(1)小海首先设计(如左图):向装有样品溶液(20 g)的锥形瓶(75 g)中投入0.5g二氧化锰,待双氧水反应完毕后测得锥形瓶和反应后混合物的总质量为95.1 g,则产生氧气的质量是 g,双氧水溶液中溶质的质量分数为 。
(2)小林对小海的设计提出质疑后,设计如中图的方案(只在上述方案中的锥形瓶上加一干燥管),请你说明小林质疑的理由是 。
(3)小明通过思考后,觉得他们的方案误差都较大,于是小明设计如右图的方案(试剂用量不变)。请你说明小明认为他们误差较大的原因:
。如果要满足小明的要求,该实验需用 mL的量筒。
24.(9分)实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO2反应而变质。某同学对一瓶久置的“碱石灰”作了如下探究:
(1)【猜想】
猜想Ⅰ:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想Ⅱ:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3。
(2)【实验】如下图所示:
(3)【判断】
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:
猜想Ⅱ (填:成立、不成立)
b.操作④发生化学反应的方程式为 ;由操作⑤⑥的现象判断:滤液中含有 (写化学式);由此判断猜想Ⅰ (填:成立、不成立)。
c.综合a和b的结论,判断该样品变质情况为 。任写二个变质的化学方程式 , 。
(4)【拓展】由上述实验说明,实验室中“碱石灰”应 保存;操作③中玻棒的作用是 。
四.计算题(本题共1小题,共6分)
25.某钙片的标签如右图所示,此钙片成分中只有碳酸钙含有钙元素。
(1)请通过计算说明此标签中的含钙量是否错误。
7
(2)为测定这种钙片含钙量,小东每次取10片钙片放入已称量的盛有足量盐酸的烧杯中,充分反应后再称量烧杯和剩余物的总质量。小东做了三次实验,数据如下:
(1)请计算每片此钙片含碳酸钙的质量。 (2)你认为应该建议厂家如何更改标签?
7
26.(6分)取50.00 g某质量分数浓度的NaOH溶液,向其中通入二氧化碳气体后,再向溶液中逐滴滴入18.25%的盐酸,产生CO2气体的质量(假设反应后CO2完全逸出)与所加的盐酸体积之间的关系如右图所示。(保留两位小数)
(1)计算原NaOH溶液的质量分数浓度。
(2)求NaOH溶液中通入CO2后,所得溶液中的溶质及其质量。(保留两位小数)
参考答案和评分标准
一、选择题 (本题共16小题,每小题3分,共48分。)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
A
D
D
B
A
D
D
C
B
A
D
C
B
B
C
D
二、填空题(共28分)
17、略 18、(1)①②、③、④(2)石油 方程式略(3)12:1:3 (4)A 19、(1)过滤(2)先静置,加入明矾,沉淀,再加入活性炭,过滤(2分)(3)取适量样品,加入肥皂水,观察泡沫的多少(4)不正确;人体对元素的需求是均衡的 20、(1)方程式略 还原 升高 (2)隔绝空气和水 (3)是血红蛋白的成分帮助氧气的运输 21、(1)C、B、A、D (2)略
三、实验探究题(18分)
22、(1)试管和烧杯图 (2)随开随用,随关随停 H2或H2S 等
23、(1)0.4; 4.25% (2)氧气会带走水蒸气
(3)托盘天平的精确度为0.1g,误差较大;需用500 mL量筒(因为产生氧气的体积约是282 mL)。
7
24、1)CaO+H2O==Ca(OH)2
(3) a.不成立 b. CaCO3+2HCl==CaCl2+CO2↑+H2O Na2CO3 不成立 c. 部分变质 方程式略
(4)密封 引流(或导流)
四、计算题(共6分)
×40% = 0.32g
40 g
50
35.解:(1)本品若为纯碳酸钙,其含钙量为
每片含钙量为:
因此本品每片不可能含钙0.75g。(2分)
(2)①设10片钙片含碳酸钙的质量为 x
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (1分)
100 44
x (22+8-26.7)g
100
44
=
x
3.3g
(1 分)
解得,x = 7.5g ,因此每片此钙片含碳酸钙 0.75g 答 ……(1分)
②每片此钙片的含钙量 = 0.75g×40% = 0.3g 建议厂家将含钙量:“每片含钙0.75g”改为“每片含钙0.3g” (1分)
7