- 125.80 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
鲁教版九年级化学第七单元测试题含答案
(时间:60分钟 满分:75分)
可能用到的相对原子质量:H—1 O—16 Na—23 S—32 Cl—35.5 Ba—137
第Ⅰ卷 (选择题 24分)
一、选择题(本题共8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1.食醋中含有醋酸,食醋除作调味剂外,生活中还有妙用,下列使用食醋肯定不能达到目的的是( D )
A.除去水壶壁上的水垢 B.减弱皮蛋中的涩味
C.除去菜刀上的铁锈 D.鉴别黄金饰品中是否含有铜
2.下列有关氢氧化钠的叙述错误的是( A )
A.露置在空气中的氢氧化钠部分变质,可用滴加稀盐酸的方法除去杂质
B.氢氧化钠有强烈的腐蚀性,沾到皮肤上,要用大量的水冲洗,再涂上硼酸溶液
C.氢氧化钠易潮解,可用作某些气体的干燥剂
D.氢氧化钠广泛应用于石油、造纸、纺织和印染等工业
3.某同学用pH计测得生活中一些物质的pH如表。下列说法错误的是( C )
物质
肥皂水
牙膏
西瓜汁
食醋
pH
10.2
8.5
5.8
2.4
A.牙膏显碱性 B.西瓜汁显酸性
C.肥皂水中滴入紫色石蕊试液显红色 D.胃酸过多的人不宜食用过多的食醋
4.物质X可发生下列所示的两个反应,则X可能是( A )
①X+碱→盐+水 ②X+金属氧化物→盐+水
A.HCl B.CO C.NaOH D.CaO
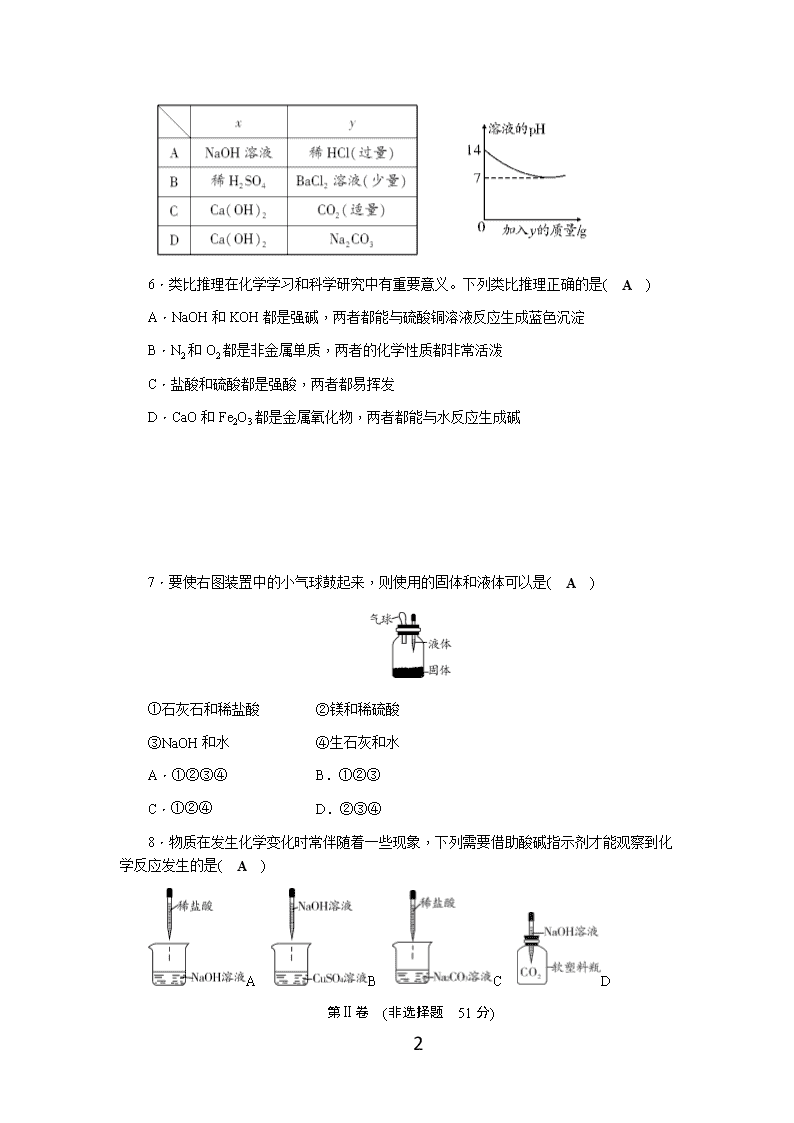
5.烧杯中盛有x溶液,逐滴加入(或通入)y物质,烧杯内液体的pH变化如图所示。则符合该变化的一组物质是( C )
7
6.类比推理在化学学习和科学研究中有重要意义。下列类比推理正确的是( A )
A.NaOH和KOH都是强碱,两者都能与硫酸铜溶液反应生成蓝色沉淀
B.N2和O2都是非金属单质,两者的化学性质都非常活泼
C.盐酸和硫酸都是强酸,两者都易挥发
D.CaO和Fe2O3都是金属氧化物,两者都能与水反应生成碱
7.要使右图装置中的小气球鼓起来,则使用的固体和液体可以是( A )
①石灰石和稀盐酸 ②镁和稀硫酸
③NaOH和水 ④生石灰和水
A.①②③④ B.①②③
C.①②④ D.②③④
8.物质在发生化学变化时常伴随着一些现象,下列需要借助酸碱指示剂才能观察到化学反应发生的是( A )
A B C D
第Ⅱ卷 (非选择题 51分)
7
二、填空题(本题共6小题,化学方程式每个2分,其余每空1分,共27分)
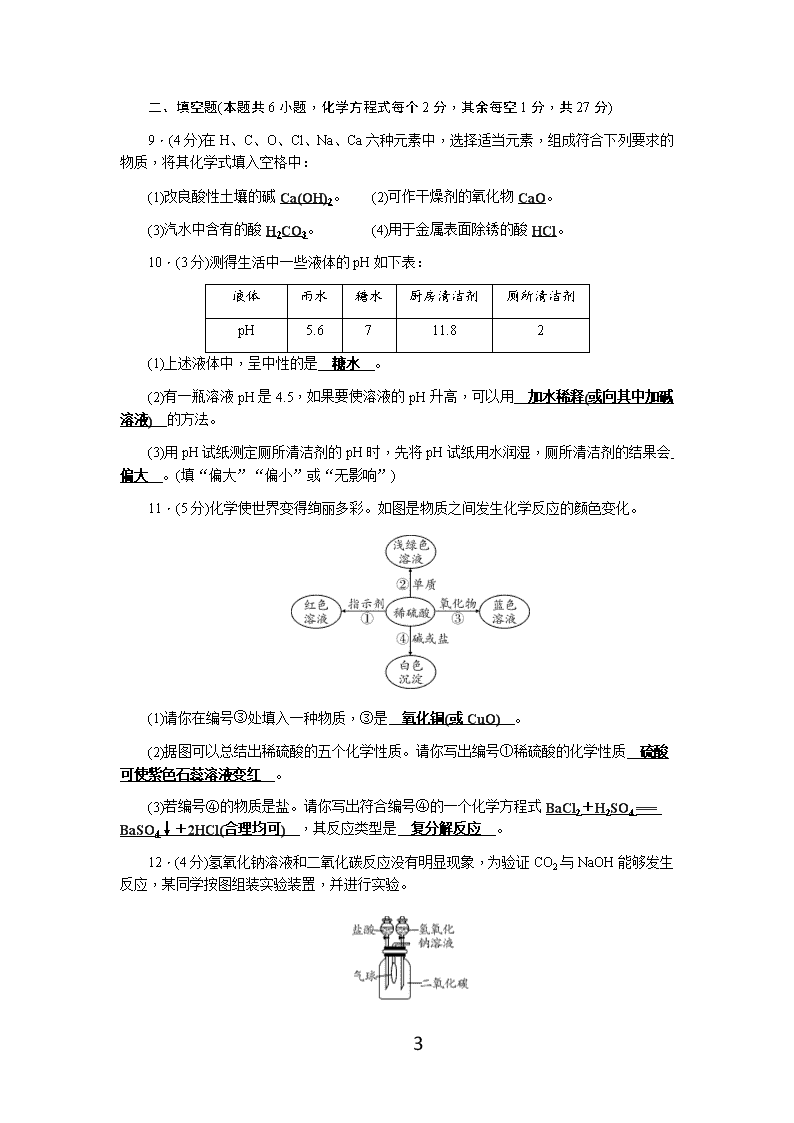
9.(4分)在H、C、O、Cl、Na、Ca六种元素中,选择适当元素,组成符合下列要求的物质,将其化学式填入空格中:
(1)改良酸性土壤的碱Ca(OH)2。 (2)可作干燥剂的氧化物CaO。
(3)汽水中含有的酸H2CO3。 (4)用于金属表面除锈的酸HCl。
10.(3分)测得生活中一些液体的pH如下表:
液体
雨水
糖水
厨房清洁剂
厕所清洁剂
pH
5.6
7
11.8
2
(1)上述液体中,呈中性的是 糖水 。
(2)有一瓶溶液pH是4.5,如果要使溶液的pH升高,可以用 加水稀释(或向其中加碱溶液) 的方法。
(3)用pH试纸测定厕所清洁剂的pH时,先将pH试纸用水润湿,厕所清洁剂的结果会 偏大 。(填“偏大”“偏小”或“无影响”)
11.(5分)化学使世界变得绚丽多彩。如图是物质之间发生化学反应的颜色变化。
(1)请你在编号③处填入一种物质,③是 氧化铜(或CuO) 。
(2)据图可以总结出稀硫酸的五个化学性质。请你写出编号①稀硫酸的化学性质 硫酸可使紫色石蕊溶液变红 。
(3)若编号④的物质是盐。请你写出符合编号④的一个化学方程式BaCl2+H2SO4 === BaSO4↓+2HCl(合理均可) ,其反应类型是 复分解反应 。
12.(4分)氢氧化钠溶液和二氧化碳反应没有明显现象,为验证CO2与NaOH能够发生反应,某同学按图组装实验装置,并进行实验。
7
(1)有时药品滴加顺序会影响实验现象,如果观察到的现象是“气球先膨胀,后变瘪”,则加入试剂的顺序应该是 B (填序号)。
A.先加入盐酸,再加入氢氧化钠溶液
B.先加入氢氧化钠溶液,再加入盐酸
(2)请解释气球“先膨胀”的原因 二氧化碳被氢氧化钠溶液吸收,导致瓶内气压减小。
(3)写出气球“后变瘪”的化学方程式Na2CO3+2HCl===2NaCl+H2O+CO2↑。
13.(7分)学习酸碱中和反应时,很多同学对其产生探究兴趣。
(1)甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱中和反应是放热反应的结论。
乙同学认为甲同学推理不合理,理由是 固体氢氧化钠溶于水也放热 。
(2)乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出氢氧化钠溶液温度随加入稀硫酸质量的变化,如图所示:
①由图知,稀硫酸与氢氧化钠溶液发生的反应是 放热 (填“放热”或“吸热”)反应,B点表示的含义是 酸碱恰好完全中和 ;
②从A到B过程中,烧杯中溶液pH逐渐 减小 ;
③从B到C的过程中,烧杯内溶液中含有的阳离子有 Na+、H+ 。(填离子符号)
(3)丙同学将稀硫酸滴入氢氧化钠溶液中,有气泡产生,他认为氢氧化钠溶液已经变质。请你分析变质的原因2NaOH+CO2===Na2CO3+H2O。(用化学方程式表示)
14.(4分)A~F为初中化学中常见的六种物质,其中B能供给呼吸,C常温下是液体,D是黑色固体,E溶液呈蓝色,它们之间存在如图所示的关系。请回答下列问题:
(1)B生成D属于 化合 (填基本反应类型)反应。
(2)D与另一物质反应生成E,另一物质的类别是 酸 (填“酸”“碱”或
7
“氧化物”)。
(4)E与F反应的化学方程式为 CuSO4+Ca(OH)2===Cu(OH)2↓+CaSO4 (答案合理即可) 。
三、实验与探究题(本题共2小题,化学方程式每个2分,其余每空1分,共17分)
15.(5分)我国大部分地区所降酸雨是由居民和工厂燃烧含硫的煤及某些化工厂生产过程中排放的二氧化硫气体经过一系列化学反应而形成的。某化学兴趣小组想探究某一地区酸雨的酸碱度。探究过程如下:
【猜想与假设】
雨水的pH可能 小于 (填“大于”“小于”或“等于”)5.6。
【设计和实验】
为测定某雨水是否属于酸雨,应选用 C (填序号)。
A.紫色石蕊试液 B.无色酚酞试液 C.pH试纸
组内同学进行了如下实验:
甲同学:取pH试纸放在玻璃片上,用玻璃棒蘸取雨水滴到pH试纸上,把试纸显示的颜色与标准比色卡比较。
乙同学:取pH试纸放在玻璃片上,先用蒸馏水将pH试纸润湿,然后用玻璃棒蘸取雨水滴到pH试纸上,把试纸显示的颜色与标准比色卡比较。
【结论与分析】
两位同学中操作正确的是 甲 同学。
指出另一位同学的操作错误: 乙同学先用蒸馏水将pH试纸润湿 。
这样操作造成的结果是 测定结果偏大(或pH偏大) 。
16.(12分)图1是某兴趣小组在学习碱的性质时进行的探究活动,按要求回答问题。
(1)通过分析实验一可知,氢氧化钠会吸收空气中的 水蒸气 。
(2)实验二中观察到3个塑料瓶变瘪的程度为A>B>C,可证明CO2能与NaOH、Ca(OH)2反应,其中C瓶在实验中起 对比 作用。
7
(3)晓晓查阅资料了解到往Ba(OH)2溶液中滴加或通入图2中物质会产生如下现象:A中溶液显红色,B、C、D中均产生白色沉淀。
①已知Ba(OH)2溶液和SO2反应与Ca(OH)2溶液和CO2反应相似,写出D试管中反应的化学方程式 Ba(OH)2+SO2===BaSO3↓+H2O 。
②不同的碱溶液中都含有OH-,所以,碱有一些相似的化学性质。上述关于Ba(OH)2性质的实验不能体现碱的相似性质的是 C (填字母)。
(4)冬冬发现工业上使用的氢氧化钠固体标签如图3所示,于是对其所含杂质进行了探究。
【提出问题】氢氧化钠含有什么杂质?
【提出猜想】工业用氢氧化钠可能含有Na2CO3,原因是 氢氧化钠与空气中的二氧化碳反应生成碳酸钠 (用简洁的文字表述)。
【查阅资料】①碳酸钠溶液呈碱性。
②碳酸钠溶液与氯化钙溶液能发生如下反应:Na2CO3+CaCl2===CaCO3↓+2NaCl。
【进行实验】
a.将氢氧化钠固体溶于水,取少许该溶液于试管中,滴入足量的 CaCl2(或BaCl2) 溶液
出现白色沉淀
b.静置上述溶液,取上层清液少许于另一支试管中,滴入几滴 酚酞 溶液
酚酞溶液变红
【获得结论】氢氧化钠中含有Na2CO3。
【实验反思】氢氧化钠溶液必须 密封 保存。
四、计算题(本题共1小题,共7分)
17.(聊城中考)将5%的NaOH溶液逐滴加入到10 g稀盐酸中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化如图所示。试回答:
7
(1)a点溶液中大量存在的离子有 Na+、Cl- ;
(2)当恰好完全反应时,消耗NaOH溶液的质量为 16g ;
(3)计算稀盐酸中溶质的质量分数。
解:设10 g稀盐酸中含HCl的质量为x。
NaOH + HCl===NaCl + H2O
40 36.5
16 g×5% x
= x=0.73 g
盐酸中HCl的质量分数为×100%=7.3%
答:稀盐酸中溶质的质量分数为7.3%。
7
相关文档
- 聊城市2020年中考数学试题及答案2021-11-1026页
- 云南省2021年中考化学模拟试题及答2021-11-1015页
- 2019年四川省凉山州中考物理试题2021-11-1020页
- 2017年重庆市B卷中考语文试题2021-11-109页
- 2018中考数学试题分类:压轴题专题(2021-11-1021页
- 2019浙江省绍兴市中考数学试题2021-11-108页
- 重庆市2020年中考语文试题(A卷)2021-11-1011页
- 2018年贵州省毕节市中考物理试题(解2021-11-1014页
- 九年级上学期同步检测化学试题 第52021-11-1010页
- 沪科版九年级物理同步测试题课件(122021-11-1029页