- 13.38 MB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
实验突破(五)
影响过氧化氢分解速率因素的探究
回归教材
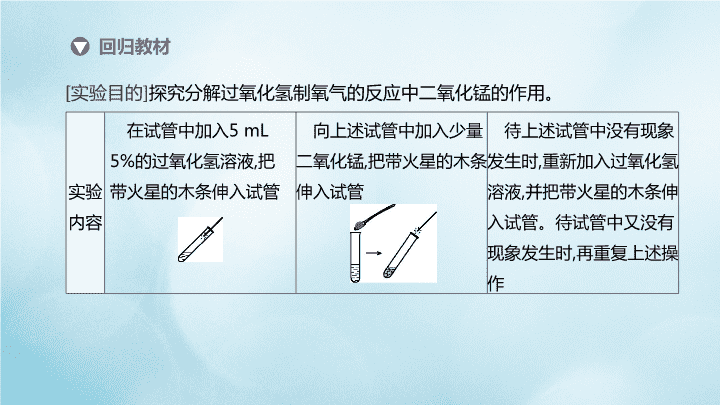
[实验目的]探究分解过氧化氢制氧气的反应中二氧化锰的作用。
实验
内容
在试管中加入5 mL
5%的过氧化氢溶液,把
带火星的木条伸入试管
向上述试管中加入少量
二氧化锰,把带火星的木条
伸入试管
待上述试管中没有现象
发生时,重新加入过氧化氢
溶液,并把带火星的木条伸
入试管。待试管中又没有
现象发生时,再重复上述操
作
实验
现象
①_____________________ ②_____________________
③_____________________
________________________
__________
解释
分析
④_____________________
________________________
________________________
________
⑤_____________________
________________________
________________________
________________________
⑥_____________________
________________________
________________________
______________
(续表)
带火星的木条不复燃
重新加入过氧化氢
溶液后,带火星的木条
又复燃
常温下过氧化氢分解
速率慢,试管内氧气的浓
度不足以使带火星的木
条复燃
常温下,二氧化锰能
加快过氧化氢分解的速
率,试管内氧气的浓度升
高,使带火星的木条复燃
氧气是过氧化氢产
生的,二氧化锰只起加
快过氧化氢分解产生
氧气的作用
带火星的木条复燃
1.小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题。
她设计并完成了下表所示的探究实验:
拓展训练
实验操作 实验现象
实验结论或总结
结论 总结
实验一
取5 mL 5%的过氧
化氢溶液于试管中,
伸入带火星的木条
有少量气泡产
生,木条不复燃
过氧化氢分解产生
氧气,但是___________
二氧化锰是
过氧化氢分
解的催化剂
产生氧气
的速率慢
(续表)
实验操作 实验现象
实验结论或总结
结论 总结
实
验
二
向盛水的试管中加
入二氧化锰,伸入带火
星的木条
没有明显现象
二氧化锰和水混合不能产生
氧气
二氧
化锰是
过氧化
氢分解
的催化
剂
实
验
三
向盛有5 mL 5%过
氧化氢溶液的试管中
加入二氧化锰,伸入带
火星的木条
______________
______________
______________
二氧化锰能加快过氧化氢的
分解。反应的化学方程式是
有大量气泡
产生,带火星
的木条复燃
1.小丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题。
她设计并完成了下表所示的探究实验:
(1)请你帮小丽同学填写上表中未填完的空格。
(2)在小丽的探究实验中,“实验一”和“实验二”起的作用是 。
(3)小英同学认为仅由上述实验还不能完全得出表内的“总结”,过氧化氢在常
温下分解缓慢,加入二氧化锰反应明显加快,若要证明二氧化锰是该反应的催化
剂,还需要增加实验来验证它在化学反应前后的 和 是否
改变。
作对比
质量 化学性质
2.探究相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果。
定性研究(1)如图S5-1甲,可通过观察 来定性比较两者的催
化效果。
图S5-1
产生气泡的快慢
2.探究相同浓度的FeCl3溶液和CuSO4溶液对H2O2分解的催化效果。
图S5-1
定量研究(2)如图乙,实验前检查该装置气密性的方法是_______________________
。要
定量比较两者的催化效果,可测量 。
实验拓展查阅资料得知:除了上述几种物质可以作过氧化氢溶液分解的催化剂
外,CuO、马铃薯等也可以作过氧化氢溶液分解的催化剂。下列有关催化剂的
说法中正确的是 (填序号)。
A.不用催化剂过氧化氢溶液就不能分解
B.同一个化学反应可以有多种催化剂,同一物质也可以作不同反应的催化剂
C.催化剂只能加快化学反应的速率
D.某同学用氯酸钾制氧气时,误将高锰酸钾当作MnO2一起加热,结果发现反应速
率和氧气的产量均增加了,故催化剂还可以增加生成物的质量
关闭分液漏斗活塞,
相同时间内产生氧气的体积
B
向外拉动注射器活塞,若活塞回到原来位置,则装置气密性良好,否则不好
3.[改编]某学校化学兴趣小组同学在学习了制取氧气这一节内容后,发现在实验
室里用5%H2O2溶液加热制O2,用带火星的木条检验,木条很难复燃。兴趣小组
的同学热烈讨论产生此现象的原因,制定了实验方案并进行实验。
①甲同学采取增大H2O2溶液浓度的方法,用10%的H2O2溶液加热,结果一段时
间后,用带火星的木条检验,木条复燃;
②乙同学在5%的H2O2溶液中加入少量三氧化二铁粉末,用带火星的木条检验,
木条复燃;
③丙同学从实验装置上进行了改进,设计了如图S5-2
所示装置,效果很好。三位同学经过交流讨论,得出了
一些结论。
图S5-2
(1)由甲同学的实验可得出:影响H2O2分解产生O2的量及分解快慢的因素之一
是 。
(2)乙同学的实验中用到三氧化二铁粉末的作用是 。
(3)丙同学的实验中浓硫酸的作用是 。
(4)从上述实验中看出,5% H2O2溶液加热制取氧气,木条很难复燃的原因可能是
。
过氧化氢溶液的浓度
催化作用
吸收氧气中的水蒸气
产生氧气的浓度较低,且含有较多水蒸气
4.同学们应用数字化实验探究外界条件对过氧化氢溶液分解速率的影响。实验
装置如下:
图S5-3
进行实验
实验序号 主要实验步骤 装置内压强—时间图像
实验1
①1号抽滤瓶中不加任何试剂,2号
抽滤瓶中加入0.2 g MnO2粉末,3
号抽滤瓶中加入0.2 g FeCl3粉末
②用三个分液漏斗分别加入15
mL 4%的H2O2溶液
实验序号 主要实验步骤 装置内压强—时间图像
实验2
①三个抽滤瓶中分别加入0.2 g FeCl3
粉末
②分别用1号分液漏斗加入15 mL 2%
的H2O2溶液,用2号分液漏斗加入15
mL 4%的H2O2溶液,用3号分液漏斗
加入15 mL 6%的H2O2溶液
(续表)
实验序号 主要实验步骤 装置内压强—时间图像
实验3
①三个抽滤瓶中分别加入0.2 g FeCl3
粉末
②__________________________________
____________________________________
③__________________________________
____________________________________
(续表)
将三个抽滤瓶分别放在装有10 ℃、
20 ℃和40 ℃水的水槽中
用三个分液漏斗分别加入15 mL
4%(或2%或6%)的H2O2溶液
4.同学们应用数字化实验探究外界条件对过氧化氢溶液分解速率的影响。实验
装置如下:
图S5-3
结果与分析
(1)实验1的目的是 ,结论是
,3号抽滤瓶中发生的反应的化
学方程式为 。
(2)实验2可得出过氧化氢的浓度越大,反应速率越快的结论,则图中曲线a代表的
溶液是 。
(3)通过上述实验可知影响H2O2分解速率的外界因素有______________________
。
探究不同催化剂对过氧化氢分解速率的影响
二氧化锰的催化效果比氯化铁的催化效果好
6%的过氧化氢溶液
反应物的浓度、温度
以及催化剂的种类
4.同学们应用数字化实验探究外界条件对过氧化氢溶液分解速率的影响。实验
装置如下:
反思与评价
(4)经过多次实验,有的同学对比实验1的3号瓶、实验2的2号瓶中同为40s时的
气体压强,发现存在较大的差异,可能的原因是
图S5-3
实验1和实验2的温度不同
5.某化学兴趣小组用过氧化氢溶液制氧气,探究不同催化剂催化过氧化氢分解
的效果。
查阅资料
①MnO2、Cr2O3、Fe2O3、CuO、S对过氧化氢的分解均具有催化作用。
②海藻酸钠可以作为催化剂的载体支架,形成负载不同催化剂的海藻酸钠微球。
进行实验
①制备五种负载不同催化剂(MnO2、Cr2O3、Fe2O3、CuO、S)的海藻酸钠微
球,每个微球大小相同,且负载催化剂的质量相等。
②取30粒负载某种催化剂的海藻酸钠微球与20 mL 质量分数为5%的过氧化氢
溶液,在锥形瓶中迅速混合发生反应,实验装置如图S5-4甲,采集200 s内压强数
据,绘制曲线如图乙。
图S5-4
实验分析
(1)每次实验时,海藻酸钠微球数应相同的原因是____________________________
。
(2)本实验中,通过一段时间内 来反映生成氧气的快慢。
(3)本实验中,负载MnO2的微球显示了良好的催化效果,60s时竟将橡皮塞弹飞,
在图乙中对应的曲线是 (填“a”或“b”);负载 的微球催化
效果较好,反应温和;负载Fe2O3、Cr2O3的微球催化效果一般;负载 的
微球催化能力最弱。
控制变量,保证负载的催化剂
的总质量相等
压强变化的数值
a CuO
S