- 101.00 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
- 1 -
3.1 氧气的性质和用途
本章内容涉及的主题:
身边的化学物质:氧气的主要性质和用途;氧气的制法。
物质构成的奥秘:元素;元素符号及其意义;元素的简单分类;认识元素与人类的关系;
元素周期表。
物质的化学变化:化合反应;氧化反应;分解反应;催化剂。
化学与社会发展:燃烧、缓慢氧化和爆炸的条件及灭火、防火、防爆炸的方法和措施。
科 学 探 究:实验室制取气体的简单方法催化剂及催化作用的探究。
教学重点 氧气的化学性质;化合反应和氧化反应的概念
实验室用过氧化氢制取氧气的方法和原理
实验室用高锰酸钾制取氧气的方法和原理、分解反应
物质燃烧条件及探究活动
灭火原理和方法,防爆措施
元素概念的建立;元素符号及意义;单质、化合物、氧化物
教学难点 不同物质与氧气反应 的现象、原理的比较;氧化反应与化合反应的区别与联
系
对二氧化锰在过氧化氢分解反应催化作用和催化剂概念的理解。
用高锰酸钾制取氧气的装置原理
着火点,燃烧、缓慢氧化、自燃的联系与区别
灭火方法的确定
元素概念的建立
【复习的目的要求】
1.知道氧气的主要物理性质和化学性质(了解)。认识氧气能跟许多物质发生氧化反应
(理解)。知道氧气的主要用途,并能说出用途与性质的关系(了解)。
2.能正确书写碳、铁、石蜡等物质跟氧气反应的文字表达式,能说出这些反应的实验
现象,能说出这些反应的相同点和不同点(了解)。
3.能用氧气的性质解释和说明某些现象(应用)。
4.知道氧化反应初步概念,能根据氧化反应初步概念说出常见反应是否氧化反应(了
解)。认识什么是化合反应,能识别具体反应是否化合反应(理解)。
- 2 -
5.能说出催化剂的定义(了解),认识催化剂的重要作用(理解)。
6.初步学习实验室用过氧化氢制取氧气的方法,了解实验室用过氧化氢制取氧气的反
应原理(理解)。
7.初步学习实验室用高锰酸钾制取氧气的方法,了解实验室用高锰酸钾、氯酸钾制取
氧气的反应原理。初步学习检查装置气密性的方法(理解)。
8.认识什么是分解反应,能识别具体反应是否分解反应(理解)。
9.知道工业用空气制取氧气的方法和原理(了解)。
10.初步了解自然界中的氧循环(了解)。
11.懂得什么是燃烧,什么是缓慢氧化,什么是自燃,以及它们之间的联系与区别。认
识燃烧、缓慢氧化、自燃的条件(理解)。
12.知道燃烧、缓慢氧化、自燃在生活、生产中的重要意义和危害(了解)。
13.知道什么是着火点,不同的可燃物着火点不同(了解)。
14.懂得灭火、防火的原理和措施(理解)。
15.知道什么是爆炸(了解),认识爆炸的条件、防范爆炸的措施(理解)。
16.知道爆炸的利与弊(了解)。了解一些常见的易燃易爆品使用安全知识。
17.知道元素概念的含义(了解),初步认识元素与人类的密切关系(理解)。
18.记住几种常见元素在自然界里含量的排序(了解)。
19.记住并会书写常见的元素名称和符号,能说出元素符号的意义(了解)。
20.知道元素的简单分类(金属、非金属、稀有气体元素),能说出常见的具体元素属
于哪类元素(了解)。
21.能根据原子序数(核电荷数)在元素周期表中找到指定元素(了解)。
22.能运用元素概念认识单质、化合物、氧化物的概念,能根据物质的元素组成识别单
质、化合物、氧化物(理解)。
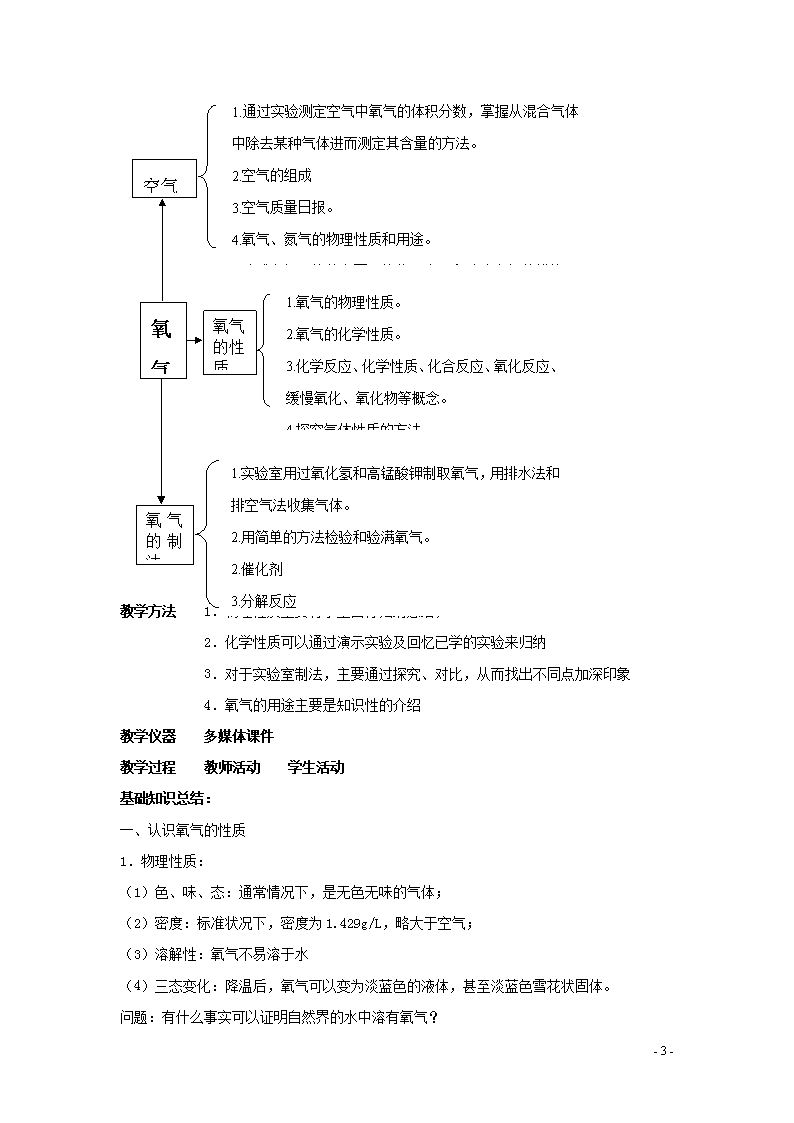
【知识网络】
- 3 -
教学方法 1.物理性质主要有学生自行归纳总结;
2.化学性质可以通过演示实验及回忆已学的实验来归纳
3.对于实验室制法,主要通过探究、对比,从而找出不同点加深印象
4.氧气的用途主要是知识性的介绍
教学仪器 多媒体课件
教学过程 教师活动 学生活动
基础知识总结:
一、认识氧气的性质
1.物理性质:
(1)色、味、态:通常情况下,是无色无味的气体;
(2)密度:标准状况下,密度为 1.429g/L,略大于空气;
(3)溶解性:氧气不易溶于水
(4)三态变化:降温后,氧气可以变为淡蓝色的液体,甚至淡蓝色雪花状固体。
问题:有什么事实可以证明自然界的水中溶有氧气?
氧
气
空气
氧 气
的 制
法
氧气
的性
质
1.通过实验测定空气中氧气的体积分数,掌握从混合气体
中除去某种气体进而测定其含量的方法。
2.空气的组成
3.空气质量日报。
4.氧气、氮气的物理性质和用途。
5.造成空气污染的主要污染物及来源和防止空气的措施。
1.氧气的物理性质。
2.氧气的化学性质。
3.化学反应、化学性质、化合反应、氧化反应、
缓慢氧化、氧化物等概念。
4.探究气体性质的方法。
1.实验室用过氧化氢和高锰酸钾制取氧气,用排水法和
排空气法收集气体。
2.用简单的方法检验和验满氧气。
2.催化剂
3.分解反应
4.工业上制取氧气的方法——分离液态空气法。
- 4 -
答:水中的生物就是依靠溶解在水中的氧气生存的。
2.化学性质:
(1)木炭在氧气中燃烧(黑色固体)
实验现象:剧烈燃烧,发出白光,放热,生成一种无色无味气体,该气体能使澄清石灰水变
浑浊。
文字表达式:碳(C)+ 氧气(O2 ) 点燃——→二氧化碳(CO2)
在空气中的燃烧情况:木炭红热,无烟、无焰,生成无色无味的气体
(2)铁丝在氧气中燃烧(银白色固体)——介绍铝箔在氧气中可以燃烧
实验现象:剧烈燃烧,火星四射,铁丝熔成小球,生成一种黑色固体。
文字表达式:铁(Fe) + 氧气(O2) 点燃——→四氧化三铁(Fe3O4)
注意事项:集气瓶底部铺少量的细沙或加少量的水,防止生成的固体物质溅落瓶底,致使集
气瓶炸裂。
在空气中加热情况:持续加热发红,离火后变冷。
(3)蜡烛在氧气中燃烧(白色固体)
实验现象:比空气中燃烧剧烈,发出白光,集气瓶内壁出现水珠,有使澄清石灰水变 浑浊
的无色无味气体产生。
文字表达式:石蜡+ 氧气(O2) 点燃——→二氧化碳(CO2)+ 水(H2O)
空气中燃烧情况:燃烧产生黄色火焰,放热,稍有黑烟。
(4)镁带在氧气中燃烧(银白色固体)
实验现象:剧烈燃烧,发出耀眼的白光,放热,生成白色粉末状固体。
文字表达式:镁(Mg) + 氧气(O2) 点燃——→ 氧化镁(MgO)
(5)铜丝在空气中灼烧(红色固体)
实验现象:加热后,铜丝红热,冷却后,在铜丝表面出现一层黑色物质。
文字表达式:铜(Cu) + 氧气(O2) 加热
——→ 氧化铜(CuO)
(6)红磷在氧气中的燃烧(暗红色固体)
实验现象:剧烈燃烧,发出白光,放出热量,生成大量的白烟
文字表达式:磷(P)+ 氧气(O2) 点燃——→ 五氧化二磷(P2O5)
空气中燃烧情况:黄白色火焰,放热,有大量白烟
- 5 -
(7)其他物质与氧气的反应
某些物质在一些条件下,与氧气发生缓慢的氧化反应,成为缓慢氧化。
如:动植物新陈代谢,金属的锈蚀,食物的腐烂等等。
结论:
(1)氧气是一种化学性质比较活泼的气体,在一定的条件下,能与许多物质发生反应。在
这些反应中,氧气提供氧,称为氧化反应。氧气便是常见的氧化剂;
(2)物质在纯氧气中燃烧程度比空气中燃烧要剧烈。说明物质燃烧程度,与氧气的浓度大
小成正比;
(3)物质燃烧时有的有火焰,有的会发光,有的会冒烟。一般来说,气体燃烧会有火焰产
生,固体直接燃烧,产生光或者火星。生成物有固体,一般都会产生烟,即固体小颗粒;
(4)物质与氧气反应不一定是燃烧现象,如缓慢氧化。
二、氧气的用途
1.供给呼吸:医疗上急救病人,登山、潜水、航空、宇航提供呼吸;
2.支持燃烧:炼钢、气焊与气接、液氧炸弹、火箭助燃剂
介绍:
(1)一般情况下,我们呼吸使用空气就可以了。正常的人呼吸用纯氧气对人体有害,吸入
纯氧气会损害肺的上皮层。吸入 100%的扬弃,只需几天就会发生肺氧气中毒。一般医院中
的氧气只是大于 40%;
(2)用氦气代替氮气与氧气混合,可得到“人造空气”。人造空气用于代替空气供深海潜水
员呼吸。因为用空气供潜水员呼吸时,在压强较大的深海里,会有较多的氮气溶解在潜水员
的血液 里,当潜水员从深海上升,血液里的氮气将成为气泡释放出来,大量气泡会阻塞微
血管,引起病变。
制取氧气
1.自然界氧气的获得:主要是来源于绿色植物的光合作用
二氧化碳 + 水
素叶绿
光照 葡萄糖 + 氧气
2.工业制法(分离液态空气法)
(1)具体过程
空气 空气除去二氧化碳
干燥
氮气
液态空气降温
加压
升温-196℃
液态氧 升温-183℃
氧气
- 6 -
(2)注意:该过程是物理变化
3.实验室制法
(1)高锰酸钾制取氧气
a. 实验原理:高锰酸钾(KMnO4) 加热——→ 锰酸钾(K2MnO4)+ 二氧化锰(MnO2)+氧气(O2)
b. 注意事项:
a). 试管口要略微向下倾斜:防止生成的水回流,使试管底部破裂。
b). 导气管伸入发生装置内要稍露出橡皮塞:有利于产生的气体排出。
c). 试管口塞一团棉花:防止高锰酸钾粉末进入导气管,污染制取的气体和水槽中的水。
d). 排气法收集气体时,导气管要伸入接近集气瓶底部:有利于集气瓶内空气排出,使收
集的气体更纯。
e). 实验结束后,先将导气管移出水面,然后熄灭酒精灯:防止水槽中的水倒流,炸裂试
管。
c. 实验步骤:
a). 仪器组装:先下后上,从左到右的顺序。
b). 气密性检查:将导管的一端浸入水槽中,用手紧握试管外壁,若水中的导管口有气泡
冒出,证明装置不漏气。松开手后,导管口出现一段水柱。
c). 装入药品:按粉末状固体取用的方法(药匙或纸槽)。
d). 加热药品:先使试管均匀受热,后在反应物部位用酒精灯外焰由前向后加热。
e). 收集气体:若用排水集气法收集气体,当气泡均匀冒出时再收集;或向上集气法。
f). 检验及验满:用带火星的木条伸入试管中,发现木条复燃,说明是氧气;
用带火星的木条靠近集气瓶口部,木条复燃,证明已满。
g). 仪器的拆卸:按先右后左,先上后下的顺序。
(2)双氧水(过氧化氢)制取氧气
a. 实验原理:过氧化氢(H2O2) ————→ 水(H2O) + 氧气(O2)
b. 注意事项:
a). 分液漏斗可以用长颈漏斗代替,但其下端应该深入液面以下,防止生成的气体从长
颈漏斗中逸出;
b). 导管只需略微伸入试管塞
c). 气密性检查:用止水夹关闭,打开分液漏斗活塞, 向漏斗中加入水,水面不持续下
二氧化锰
- 7 -
降,就说明气密性良好。
d). 装药品时,先装固体后装液体
e). 该装置的优点:可以控制反应的开始与结束,可以随时添加液体。
总结:若固体(或固体+固体)加热生成气体,选用高锰酸钾制氧气装置;
若固体+液体常温下制取气体,选用双氧水制取氧气装置。
催化剂:在化学反应中能改变其他物质的反应速率,但本身的化学性质和质量在反
应前后没有发生变化的物质。
补充练习测试题
(1)从液态空气分离氮气和氧气,为什么得到的是气态氮和液态氧?
(2)用氧炔焰焊接和切割金属时,发生三种变化:乙炔在氧气中燃烧;焊接处金属与金属
焊条熔化、冷却后凝固在一起;切割处的金属在高温下被氧气氧化除去。这三种变化哪些是
物理变化?哪些是化学变化?
(3)从液态空气、高锰酸钾、双氧水三种物质制氧气时,各物质发生的是物理变化还是化
学变化?为什么?
(4)空气中有氧气,带余烬的木条伸入装有空气的集气瓶,木条是否会复燃?为什么?