- 733.42 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时训练(二) 质量守恒定律
|夯实基础|
1.下列有关质量守恒定律的理解,正确的是( )
A.将10g水加热产生10g水蒸气,物质的总质量不变,遵循质量守恒定律
B.化学反应前后原子的总数一定不会发生变化
C.15g木炭和15g氧气完全反应后,生成物质量为30g
D.铁丝燃烧后质量增加,不遵循质量守恒定律
2.[2019·黔南]化学反应前后肯定没有发生变化的是 ( )
①原子数目 ②分子数目 ③元素种类 ④物质种类 ⑤原子种类 ⑥物质的总质量
A.①④⑥ B.①③⑤⑥
C.①②⑥ D.②③⑤
3.[2019·邵阳]某纯净物X在氧气中高温煅烧的化学方程式为4X+11O22Fe2O3+8SO2,则X的化学式是 ( )
A.FeS B.FeSO4 C.FeS2 D.Fe2O3
4.[2019·西宁]为及时发现煤气泄漏,常在燃气中加入少量特殊气味的乙硫醇,乙硫醇燃烧的化学方程式为2C2H5SH+9O24CO2+2X+6H2O。下列关于X的说法正确的是 ( )
A.X属于有机化合物
B.X中氧元素的质量分数为50%
C.X由碳、硫、氧三种元素组成
D.X中硫元素与氧元素的质量比为1∶2
5.[2019·绥化]在一定条件下,5gA物质和7gB物质恰好完全反应,只生成C、D两种物质。若生成6gC,则生成D的质量是 ( )
A.5g B.6g C.7g D.4g
6.下列实验能够直接用于验证质量守恒定律的是 ( )
图Z2-1
7.[2019·烟台]2018年10月,我国科学家成功合成新型复合光催化剂,实现了太阳能人工光合成燃料,反应的
9
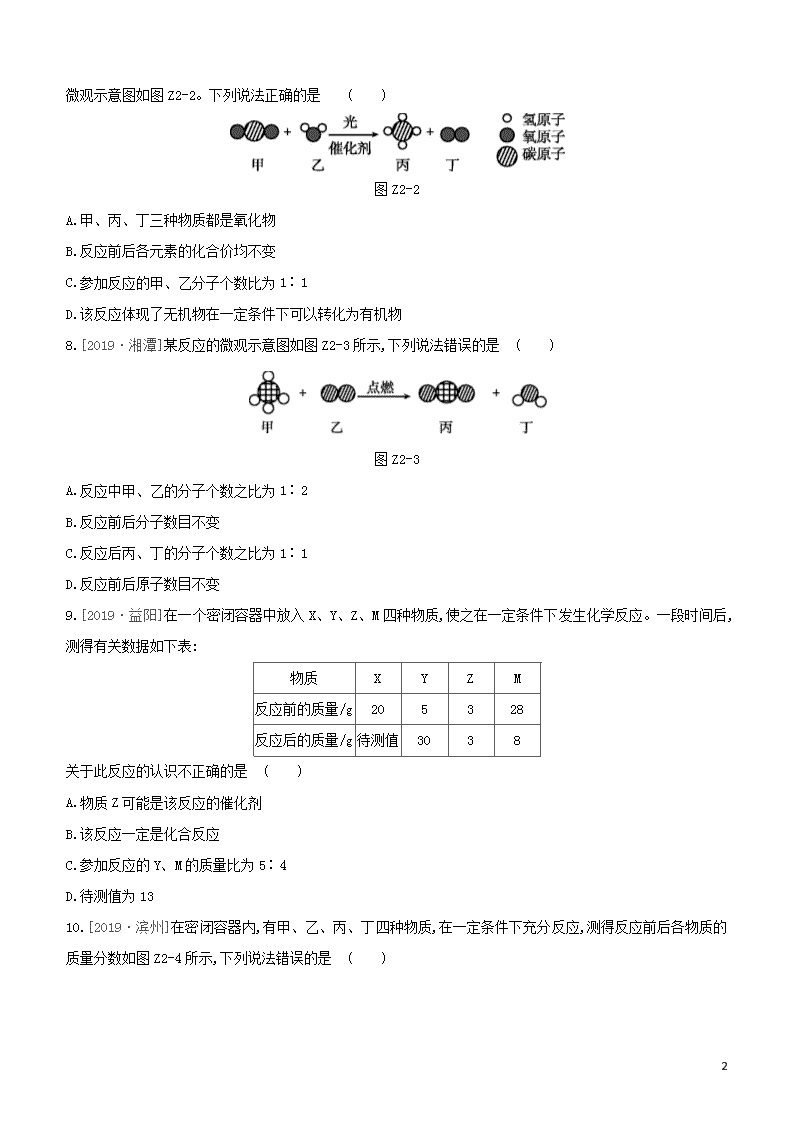
微观示意图如图Z2-2。下列说法正确的是 ( )
图Z2-2
A.甲、丙、丁三种物质都是氧化物
B.反应前后各元素的化合价均不变
C.参加反应的甲、乙分子个数比为1∶1
D.该反应体现了无机物在一定条件下可以转化为有机物
8.[2019·湘潭]某反应的微观示意图如图Z2-3所示,下列说法错误的是 ( )
图Z2-3
A.反应中甲、乙的分子个数之比为1∶2
B.反应前后分子数目不变
C.反应后丙、丁的分子个数之比为1∶1
D.反应前后原子数目不变
9.[2019·益阳]在一个密闭容器中放入X、Y、Z、M四种物质,使之在一定条件下发生化学反应。一段时间后,测得有关数据如下表:
物质
X
Y
Z
M
反应前的质量/g
20
5
3
28
反应后的质量/g
待测值
30
3
8
关于此反应的认识不正确的是 ( )
A.物质Z可能是该反应的催化剂
B.该反应一定是化合反应
C.参加反应的Y、M的质量比为5∶4
D.待测值为13
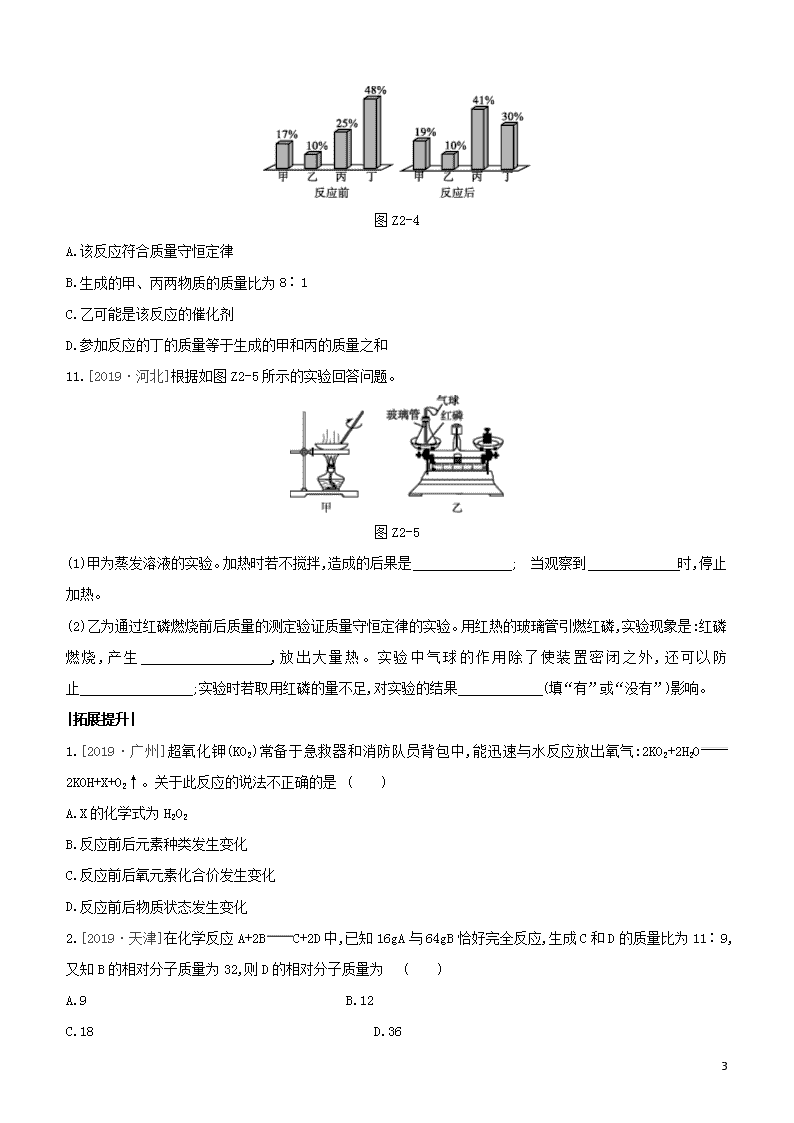
10.[2019·滨州]在密闭容器内,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图Z2-4所示,下列说法错误的是 ( )
9
图Z2-4
A.该反应符合质量守恒定律
B.生成的甲、丙两物质的质量比为8∶1
C.乙可能是该反应的催化剂
D.参加反应的丁的质量等于生成的甲和丙的质量之和
11.[2019·河北]根据如图Z2-5所示的实验回答问题。
图Z2-5
(1)甲为蒸发溶液的实验。加热时若不搅拌,造成的后果是 ; 当观察到 时,停止加热。
(2)乙为通过红磷燃烧前后质量的测定验证质量守恒定律的实验。用红热的玻璃管引燃红磷,实验现象是:红磷燃烧,产生 ,放出大量热。实验中气球的作用除了使装置密闭之外,还可以防止 ;实验时若取用红磷的量不足,对实验的结果 (填“有”或“没有”)影响。
|拓展提升|
1.[2019·广州]超氧化钾(KO2)常备于急救器和消防队员背包中,能迅速与水反应放出氧气:2KO2+2H2O2KOH+X+O2↑。关于此反应的说法不正确的是 ( )
A.X的化学式为H2O2
B.反应前后元素种类发生变化
C.反应前后氧元素化合价发生变化
D.反应前后物质状态发生变化
2.[2019·天津]在化学反应A+2BC+2D中,已知16gA与64gB恰好完全反应,生成C和D的质量比为11∶9,又知B的相对分子质量为32,则D的相对分子质量为 ( )
A.9 B.12
C.18 D.36
9
3.[2019·攀枝花]在密闭容器内进行某化学反应,测量反应前(t0)、反应中(t1)、反应后(t2)三个时刻甲、乙、丙、丁4种物质的质量分数,得到质量分数分布图分别如下:
图Z2-6
下列说法错误的是 ( )
A.该反应中,乙是反应物,丁是生成物
B.t1时刻,甲和丁的质量比为5∶7
C.若丙是Cu,丁是CO2,则甲、乙的化学计量数之比为2∶1
D.若反应前物质总质量为100g,如果再增加20g甲,则甲与乙可恰好完全反应
4.[2019·深圳]科学家研制出一种新型催化剂,可用于去除装修残留的甲醛(化学式为CH2O),该反应过程的微观示意图如图Z2-7所示。下列说法正确的是 ( )
图Z2-7
A.物质甲为甲醛,其分子由碳原子和水分子构成
B.物质乙中氧元素的化合价为-2价
C.该反应前后原子种类和数目均发生改变
D.该反应消耗物质甲和生成物质丁的质量比为5∶3
5.[2019·随州]把一定质量的甲、乙、丙、丁四种物质放入一个密闭容器中,在一定条件下反应一段时间后,测得反应后的质量如下表。下列说法不正确的是 ( )
物质
甲
乙
丙
丁
反应前的质量/g
4.0
2.0
3.0
2.0
反应后的质量/g
1.2
x
2.4
5.4
A.该反应是化合反应
B.x=2.0,乙可能是催化剂
C.参加反应的甲、丙的质量比是1∶2
D.丙可能是单质
9
6.[2019·衡阳]将一定量的丙醇(C3H8O)和氧气置于一个密封的容器中引燃,测得反应前后各物质的质量如表。下列说法错误的是 ( )
物质
丙醇
氧气
水
二氧化碳
X
反应前质量/g
6.0
14.8
0
0.4
0
反应后质量/g
0
2
7.2
9.2
a
A.表中a的值为2.8
B.参加反应的氧气和生成二氧化碳的质量比为16∶11
C.X中一定含碳元素、氧元素
D.该反应属于分解反应
7.[2019·衡阳]已知FeSO4、Fe2(SO4)3混合物中铁元素的质量分数为a%,则硫元素的质量分数为 ( )
A.1-a% B.1-a%3 C.2(1-a%)3 D.无法计算
8.为了探究化学反应前后物质的总质量是否发生改变,甲同学和乙同学分别设计了图Z2-8中A、B两个实验,请根据图示回答问题。
图Z2-8
(1)甲同学设计的实验如图A所示,反应前,托盘天平的指针指向刻度盘的中间;两种物质反应后,托盘天平的指针
(填“向左”“向右”或“不”)偏转。
(2)乙同学设计的实验如图B所示,通过实验得出结论:化学反应前后物质的总质量 。
(3)两位同学通过交流反思得到启示:在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或
9
有气体生成的反应一定要在 装置中进行。
(4)从微观角度分析,在化学反应前后一定不变的是 (填序号)。
①原子种类 ②分子种类 ③原子数目
④分子质量 ⑤分子数目 ⑥原子质量
(5)小李用盐酸与碳酸钙粉末反应验证质量守恒定律,实验装置如图C。
①根据实验目的,小李必须测量的数据是 (填序号)。
A.锥形瓶质量
B.气球质量
C.反应前整个反应装置(包括里边的物质)质量
D.反应后整个反应装置(包括里边的物质)质量
②将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中,反应结束后,气球鼓起,天平向右倾斜。小李按规范操作重新实验,得到相同结果。请你帮他分析原因: 。
(6)质量守恒定律的发现对化学的发展作出了巨大贡献。
Ⅰ.为验证质量守恒定律,小华设计如图D所示装置进行实验。实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡(如图D所示),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置放置于天平上,观察到 ,从而验证了质量守恒定律。若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是
。
Ⅱ.某反应的微观示意图如图E所示。
①X的化学式是 。
②根据上述微观示意图,可得出化学反应遵循质量守恒定律的本质原因是 。
9
【参考答案】
夯实基础
1.B [解析]水加热至沸腾变成水蒸气,属于物理变化,不遵循质量守恒定律;在化学变化中分子分解成原子,原子重新组合成新的分子,在原子重新组合的过程中,原子的总数一定不会发生变化;根据木炭和氧气反应生成二氧化碳的化学方程式可知木炭和氧气在反应中的质量比为3∶8,所以15 g木炭和15 g氧气完全反应后,木炭有剩余,生成物质量一定不为30 g;铁丝燃烧是铁丝和氧气发生了反应,所以反应后生成物的质量应该等于铁丝和氧气的质量之和,遵守质量守恒定律。
2.B [解析]化学变化是生成新物质的变化,反应前后物质种类不同,因此,化学变化前后物质的种类一定发生变化;化学变化的实质是构成反应物分子的原子进行重新组合,形成生成物分子的过程,该过程中,分子种类一定改变,分子数目可能不变,原子种类、数目一定不变,所以说原子是化学变化中的最小微粒;在化学变化前后,元素种类、质量不变,物质的质量总和不变。综合以上分析,化学反应前后肯定没有发生变化的是原子数目、元素种类、原子种类、物质的总质量。
3.C [解析]根据质量守恒定律,化学反应前后原子的种类和数目不变可知,X的化学式为FeS2。
4.B [解析]根据质量守恒定律,化学反应前后原子的数目、种类不变,可知X的化学式为SO2。X中无碳元素,不属于有机化合物;X中氧元素的质量分数为16×232+16×2×100%=50%;X由硫、氧两种元素组成;X中硫元素与氧元素的质量比为32∶(16×2)=1∶1。
5.B [解析]根据质量守恒定律,参加反应的各物质的质量总和等于反应后生成的各物质的质量总和。参加反应的各物质质量和为5 g+7 g=12 g,生成6 g C,则生成D的质量为12 g-6 g=6 g。
6.C [解析]镁燃烧生成氧化镁,有氧气参与反应,由于不是在密闭容器中进行,不能直接用于验证质量守恒定律;稀盐酸和石灰石反应生成的二氧化碳逸出装置,不能直接用于验证质量守恒定律;氯化钠和硝酸银反应生成氯化银沉淀和硝酸钠,能够用于验证质量守恒定律;锌和稀硫酸反应生成硫酸锌和氢气,生成的氢气逸出装置,不能直接用于验证质量守恒定律。
7.D [解析]由物质的组成可知,甲是氧化物,丙、丁两种物质不是氧化物;该反应有单质生成,反应前后一定有元素化合价的变化;由化学方程式可知,参加反应的甲、乙分子个数比为1∶2;CO2、H2O属于无机物,CH4属于有机物,该反应体现了无机物在一定条件下可以转化为有机物。
8.C [解析]由反应的微观示意图和质量守恒定律可知,1个甲分子与2个乙分子在点燃的条件下反应生成1个丙分子和2个丁分子。所以反应中甲、乙的分子个数之比为1∶2;反应前分子数为3,反应后分子数为3,数目不变;反应后丙、丁的分子个数之比为1∶2;化学反应前后原子数目不变。
9.D [解析]Z物质在反应前后质量不变,可能是催化剂也可能是不参加反应的其他物质;根据数据分析Y物质增加25 g,是生成物,M物质减少20 g,是反应物,根据质量守恒定律,可知另一反应物X质量应该减少5 g,所
9
以该反应是X与M反应生成Y,此反应是化合反应;参加反应的Y、M的质量比为25 g∶20 g=5∶4;待测值应为20-5=15。
10.B [解析]一切化学反应都符合质量守恒定律,故A正确;通过分析计算可知生成甲、丙的质量比为1∶8,故B错误;由于乙在反应前后的质量没有发生变化,所以乙可能是该反应的催化剂,故C正确;该反应是分解反应,根据质量守恒定律,参加反应的丁的质量等于生成的甲和丙的质量和,故D正确。
11.(1)液滴飞溅 出现较多固体
(2)大量白烟 气体膨胀冲开瓶塞 没有
[解析](1)在蒸发溶液的过程中,若没有用玻璃棒搅拌,则会导致受热不均,造成液滴飞溅;当蒸发皿中出现较多固体时,应停止加热,利用余热蒸干。(2)红磷燃烧时产生大量白烟,放出大量热,导致锥形瓶内气体压强增大,气球胀大,所以气球除了使装置密闭之外,还有平衡大气压,防止瓶塞弹出的作用;根据质量守恒定律可知,参加化学反应的物质的总质量和生成的各物质总质量相等,由于装置密闭,所以与红磷的量无关。
拓展提升
1.B [解析]由质量守恒定律可知,反应前后元素的种类不变。
2.C [解析]在化学反应A+2BC+2D中,已知16 g A与64 g B恰好完全反应,根据质量守恒定律,生成的C和D的质量之和为16 g+64 g=80 g,又因为生成C和D的质量之比为11∶9,所以D的质量是80 g×920=36 g,已知B的相对分子质量为32,设D的相对分子质量为x,则:
A+2BC+2D
64 2x
64 g 36 g
642x=64g36g x=18
3.C
4.D [解析]分子是由原子构成的,每个甲醛分子中含有一个碳原子、两个氢原子和一个氧原子;O2为单质,氧气中氧元素化合价为0;结合质量守恒定律可知,反应前后原子个数、种类不变;根据题目所给的微观示意图,该反应的化学方程式为CH2O+O2CO2+H2O,甲物质和丁物质的质量比为(12+1×2+16)∶(1×2+16)=5∶3。
5.C [解析]化学反应中,反应物质量减少,生成物质量增加,由表中实验数据可知,反应前后,甲减少了4.0 g-
1.2 g=2.8 g,丙减少了3.0 g-2.4 g=0.6 g,丁增加了5.4 g-2.0 g=3.4 g,甲、丙减少的质量和等于丁增加的质量,根据质量守恒定律,该反应可表示为甲+丙→丁,参加反应的甲、丙质量比为2.8 g∶0.6 g=14∶3。
6.D [解析]反应后丙醇、氧气质量减小,是反应物,水、二氧化碳和X质量增大,是生成物,故该反应不属于分解反应。
9
7.B [解析]已知FeSO4、Fe2(SO4)3混合物中铁元素的质量分数为a%,则硫、氧元素质量分数的和为1-a%,而硫元素和氧元素的质量比为32∶(16×4)=1∶2,所以硫元素的质量分数为1-a%3。
8.(1)向右 (2)不变 (3)密闭 (4)①③⑥
(5)①CD ②气球在空气中受到了浮力
(6)Ⅰ.天平平衡 生成的氢气逸散到了空气中
Ⅱ.①SO2 ②化学反应前后原子的种类、数目不变,原子的质量也不变
[解析](1)两种物质反应后,托盘天平的指针向右偏转,原因是碳酸钠和稀盐酸反应生成的二氧化碳气体逸出。
(2)乙同学设计的实验如图B所示,铁与硫酸铜反应生成了硫酸亚铁和铜,反应前后指针不发生偏转,通过实验得出结论:化学反应前后物质的总质量不变。(3)在探究化学反应前后物质的总质量是否发生改变时,对于有气体参加或有气体生成的反应一定要在密闭装置中进行。(5)小李用盐酸与碳酸钙粉末反应验证质量守恒定律,必须测量的数据是:反应前整个反应装置(包括里边的物质)质量和反应后整个反应装置(包括里边的物质)质量;将反应装置放在天平左盘,使天平平衡后,再将碳酸钙粉末倒入锥形瓶中,反应结束后,气球鼓起,天平向右倾斜,小李按规范操作重新实验,得到相同结果。原因是气球在空气中受到了浮力。(6)Ⅰ.若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是生成的氢气逸散到了空气中。Ⅱ.由反应的微观示意图中原子的数目和种类不变可知,X的化学式是SO2。
9