- 415.63 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题 36 元素的循环和物质的转化
【知识点回顾】
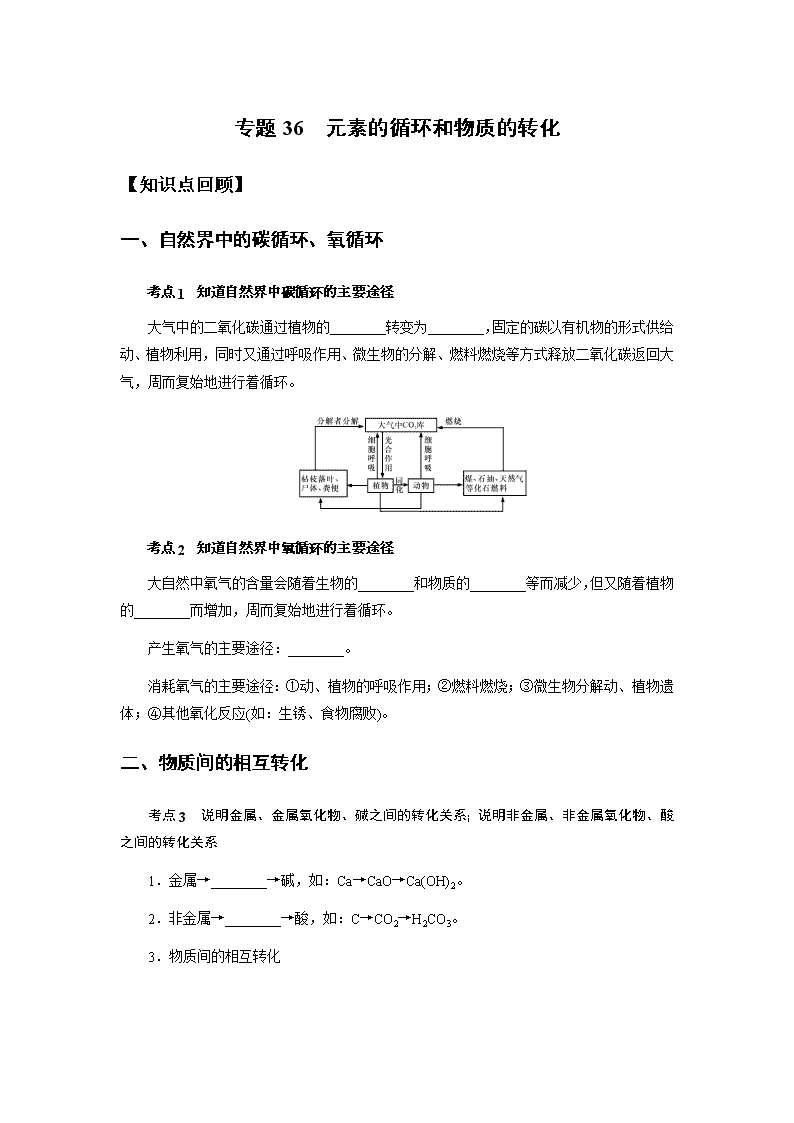
一、自然界中的碳循环、氧循环
考点 1 知道自然界中碳循环的主要途径
大气中的二氧化碳通过植物的________转变为________,固定的碳以有机物的形式供给
动、植物利用,同时又通过呼吸作用、微生物的分解、燃料燃烧等方式释放二氧化碳返回大
气,周而复始地进行着循环。
考点 2 知道自然界中氧循环的主要途径
大自然中氧气的含量会随着生物的________和物质的________等而减少,但又随着植物
的________而增加,周而复始地进行着循环。
产生氧气的主要途径:________。
消耗氧气的主要途径:①动、植物的呼吸作用;②燃料燃烧;③微生物分解动、植物遗
体;④其他氧化反应(如:生锈、食物腐败)。
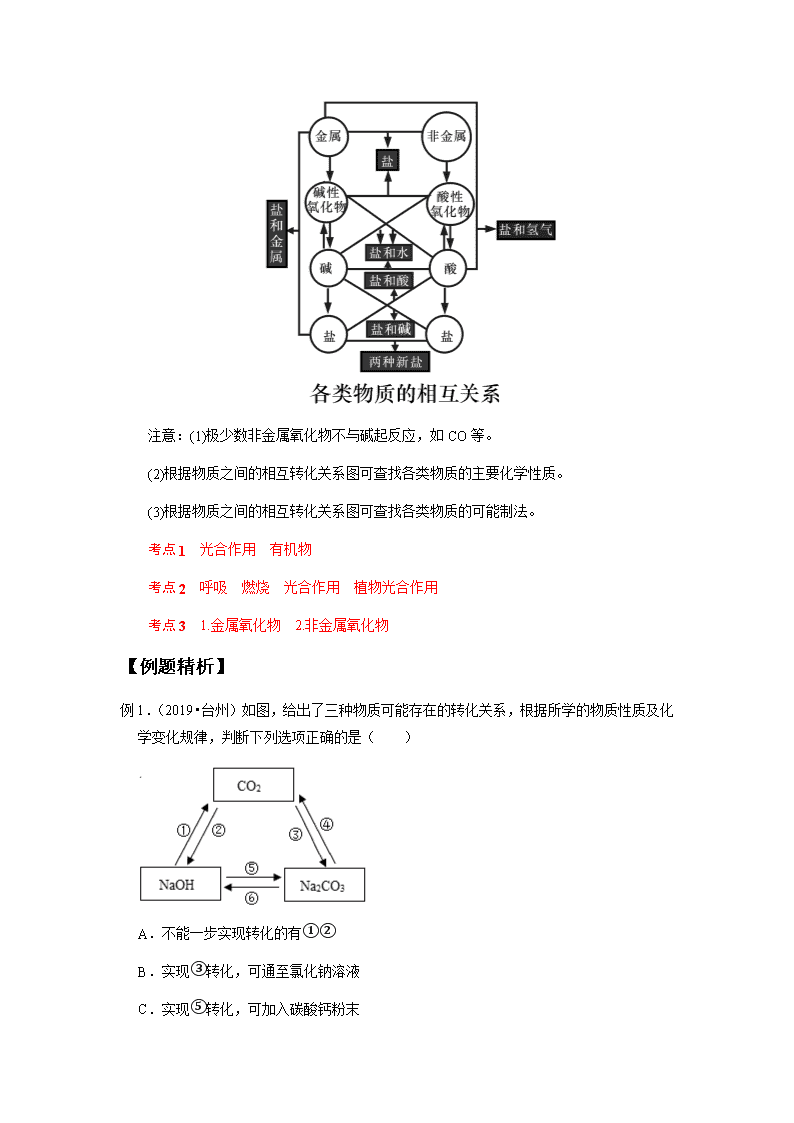
二、物质间的相互转化
考点 3 说明金属、金属氧化物、碱之间的转化关系;说明非金属、非金属氧化物、酸
之间的转化关系
1.金属→________→碱,如:Ca→CaO→Ca(OH)2。
2.非金属→________→酸,如:C→CO2→H2CO3。
3.物质间的相互转化
注意:(1)极少数非金属氧化物不与碱起反应,如 CO 等。
(2)根据物质之间的相互转化关系图可查找各类物质的主要化学性质。
(3)根据物质之间的相互转化关系图可查找各类物质的可能制法。
考点 1 光合作用 有机物
考点 2 呼吸 燃烧 光合作用 植物光合作用
考点 3 1.金属氧化物 2.非金属氧化物
【例题精析】
例 1.(2019•台州)如图,给出了三种物质可能存在的转化关系,根据所学的物质性质及化
学变化规律,判断下列选项正确的是( )
A.不能一步实现转化的有
①②B.实现
③
转化,可通至氯化钠溶液
C.实现
⑤
转化,可加入碳酸钙粉末
D.实现
⑥
转化,可加入氢氧化钾溶液
【解答】解:
A、氢氧化钠和二氧化碳之间不能相互转化。正确;
B、实现
③
转化,二氧化碳和氢氧化钠反应生成碳酸钠,所以可通入到氢氧化钠溶液而
非氯化钠。错误;
C、氢氧化钠转化为碳酸钠,需要通入二氧化碳或者某些可溶性碳酸盐,但是不能是难溶
性的碳酸钙粉末。错误;
D、碳酸钠转化为氢氧化钠,可以加入氢氧化钙或者氢氧化钡等,但是不能加入氢氧化钾。
错误;
故选:A。
例 2.(2018•金昌)下列变化,能通过加盐酸一步反应实现的是( )
①
AgNO3→HNO3
②
Fe2O3→FeCl2
③
Cu→CuCl2
④
Cu(OH)2→CuCl2
⑤
Fe→FeCl3
A.
①②
B.
②④
C.
①④
D.
③⑤【解答】解:
①
硝酸银溶液能与盐酸反应生成氯化银沉淀和硝酸,能通过加盐酸一步反
应实现。
②
Fe2O3 与稀盐酸反应生成氯化铁和水,不能生成 FeCl2,不能通过加盐酸一步反应实现。
③
Cu 与稀盐酸不反应,不能通过加盐酸一步反应实现。
④
Cu(OH)2 与稀盐酸反应生成 CuCl2 和水,能通过加盐酸一步反应实现。
⑤
Fe 与稀盐酸反应生成氯化亚铁溶液和氢气,不能生成 FeCl3,不能通过加盐酸一步反
应实现。
故
①④
能通过加盐酸一步反应实现。
故选:C。
例 3.(2018•杭州)如图为氢气还原氧化铜的实验装置图,下列有关分析正确的是( )
A.装置中试管口需略向下倾斜,主要是为了利于通入氢气
B.在给试管内药品加热前,需先通氢气排尽试管内的空气
C.待药品完全反应后,需同时撤去酒精灯和通氢气的导管
D.该实验装置也可直接用于一氧化碳还原氧化铜的实验
【解答】解:A.装置中试管口需略向下倾斜,主要是为了防止水冷凝水回流,炸裂试管,
故错误;
B.在给试管内药品加热前,需先通氢气排尽试管内的空气,以防加热时发生爆炸,故正
确;
C.实验结束后,先停止通氢再熄灭酒精灯,要继续通氢气至试管冷却为止,目的是防止
生成的铜再次被氧化,故错误;
D.氢气无毒,而一氧化碳有毒不能直接排放到空气中,而该装置无尾气处理装置,故错
误。
故选:B。
例 4.(2018•台州)电脑芯片的制作要用到高纯度的硅。目前广泛采用石英砂(主要成分是
SiO2)为原料制取,其中一步反应为:SiO2+2C
高温
�
Si+2CO↑.对该反应分析正确的是
( )
A.该反应属于置换反应
B.碳发生了还原反应
C.碳元素化合价由 0 价变为+4 价
D.该反应利用了 CO 的还原性
【解答】解:A、该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的
反应,属于置换反应,故选项说法正确。
B、碳夺取了二氧化硅中的氧,发生了氧化反应,故选项说法错误。
C、碳属于单质,故碳元素的化合价为 0;一氧化碳中氧元素显﹣2 价,碳元素显+2 价;
故选项说法错误。
D、碳夺取了二氧化硅中的氧,发生了氧化反应,具有还原性,故选项说法错误。
故选:A。
例 5.(2018•台州)下列选项所示的物质转化均能一步实现的是( )
A.Fe→�� Fe2O3 →���Fe(OH)3
B.CuO →�����CuSO4 →
稀
�㈹ㄮCuCl2
C.S→�� SO2 →���H2SO4
D.CO2 →�뭰��Na2CO3 →㈹뭰�����NaOH
【解答】解:A、铁和氧气能反应生成氧化铁,氧化铁不能一步反应生成氢氧化铁,错误;
B、氧化铜能与硫酸反应生成硫酸铜,硫酸铜不能与盐酸反应生成氯化铜,错误;
C、硫能与氧气反应生成二氧化碳,二氧化硫与水反应生成的是亚硫酸,错误;
D、二氧化碳能与氢氧化钠反应生成碳酸钠,碳酸钠能与氢氧化钙反应生成氢氧化钠,正
确;
故选:D。
例 6.(2020•宁波)铁的化合物有广泛用途,如碳酸亚铁(FeCO3)可作补血剂。某硫酸厂
产生的炉渣中除了有Fe2O3、FeO,还有一定量的SiO2.兴趣小组利用炉渣尝试制备FeCO3,
其 流 程 如 图 :
【已知:Fe+Fe2(SO4)3═3FeSO4;SiO2 不溶于水,也不与稀硫酸反应】
(1)操作
①
的名称是 过滤 。
(2)溶液 A 中的溶质除 H2SO4 外,还存在 硫酸铁、硫酸亚铁 。
(3)上述流程中生成固体 c 的化学方程式 FeSO4+Na2CO3=Na2SO4+FeCO3↓ 。
【解答】解:(1)操作
①
的名称是过滤,通过过滤把液体和固体分离。
故填:过滤。
(2)溶液 A 中的溶质除 H2SO4 外,还存在硫酸铁和硫酸亚铁,是因为加入的是过量的
稀硫酸,即完全反应后硫酸有剩余,稀硫酸和氧化铁反应生成硫酸铁和水,和氧化亚铁
反应生成硫酸亚铁和水,因此溶液中还含有硫酸铁和硫酸亚铁。
故填:硫酸铁、硫酸亚铁。
(3)上述流程中生成固体 c 是碳酸亚铁,是因为硫酸亚铁和碳酸钠反应生成碳酸亚铁沉
淀和硫酸钠,反应的化学方程式:FeSO4+Na2CO3=Na2SO4+FeCO3↓。
故填:FeSO4+Na2CO3=Na2SO4+FeCO3↓。
例 7.(2020•杭州)医用消毒酒精为 75%的乙醇溶液,化工生产中可用 A(主要成分的化学
式为 C8H18)作原料,经以下流程制取乙醇:
(1)步骤
①
的转化属于 化学 (选填“化或“物理”)变化。
(2)步骤
②
是乙烯和含两种元素的化合物 B 发生化合反应,则 B 中所含元素是 氢元
素、氧元素 。
【解答】解:(1)步骤
①
的 C8H18 转化成乙烯,是化学变化。
故填:化
(2)步骤
②
是乙烯和含两种元素的化合物 B 发生化合反应,由质量守恒定律可知,B
中所含元素是氢元素、氧元素。
故填:氢元素、氧元素。
例 8.(2020•金华)“飞花令”是中国诗词的一种接龙游戏。科学兴趣小组模仿“飞花令”
游戏规则,进行物质间转化的接龙比赛,其比赛规则是:从同一物质开始进行转化,接
龙物质不能重复且必须含有指定元素,以转化路径长且正确者为比赛胜者。某两场比赛
的过程记录如下(“→”表示某一种物质经一步反应可转化为另一种物质)。
(1)指定元素:氢元素 起始物质:HCl 比赛胜者:乙同学
甲同学:HCl→H2O
乙同学:HCl→H2O→□
乙同学在方框中应填物质的化学式是 Ca(OH)2 (写一种即可)。
(2)指定元素:钡元素 起始物质:BaO 比赛胜者:丁同学
丙同学:BaO→Ba(OH)2→BaSO4
下列能使丁同学获胜的方案有 BC (填字母)。
A.BaO→BaSO4→Ba(OH)2→BaCO3
B.BaO→BaCl2→Ba(NO3)2→BaSO4
C.BaO→Ba(OH)2→BaCO3→BaCl2→Ba(NO3)2→BaSO4
D.BaO→BaCl2→BaCO3→Ba(NO3)2→Ba(OH)2→BaSO4
【解答】解:(1)水和氧化钙反应生成氢氧化钙,乙同学在方框中应填物质的化学式可
以是 Ca(OH)2。
故填:Ca(OH)2。
(2)A.硫酸钡不能转化成氢氧化钡,该选项不符合题意;
B.氧化钡和盐酸反应生成氯化钡和水,氯化钡和硝酸银反应生成氯化银沉淀和硝酸钡,
硝酸钡和硫酸钠反应生成硫酸钡沉淀和硝酸钠,该选项符合题意;
C.氧化钡和水反应生成氢氧化钡,氢氧化钡和二氧化碳反应生成碳酸钡和水,碳酸钡和
盐酸反应生成氯化钡、水和二氧化碳,氯化钡和硝酸银反应生成氯化银沉淀和硝酸钡,
硝酸钡和硫酸钠反应生成硫酸钡沉淀和硝酸钠,该选项符合题意;
D.硝酸钡不能转化成氢氧化钡,该选项不符合题意。
故填:BC。
例 9.(2020•衢州)如图所示,是小科建构的铜及其化合物之间相互转化的关系图。
(1)写出图中“?”处物质的化学式 CuO 。
(2)要一步实现图中“Cu→Cu2+”的转化,可将铜加入适量的某种盐溶液中,则该溶液
的溶质是 硝酸银 。
(3)根据图中的转化关系,利用硝酸铜溶液制备纯净的硫酸铜晶体。请设计一个实验方
案,要求写出主要操
作步骤及所需要的试剂 在硝酸铜溶液中加入氢氧化钠溶液,过滤、洗涤沉淀,向沉淀
中加入适量稀硫酸,充分反应后蒸发结晶 。
【解答】解:(1)图中“?”处物质是+2 价铜元素,与氧元素结合生成的氧化物是氧化
铜,氧化铜中氧元素化合价是﹣2,根据化合物中元素化合价代数和为零可知,氧化铜的
化学式是 CuO。
故填:CuO。
(2)要一步实现图中“Cu→Cu2+”的转化,可将铜加入适量的某种盐溶液中,则该溶液
的溶质是硝酸银,是因为硝酸银和铜反应生成硝酸铜和银。
故填:硝酸银。
(3)实验方案:在硝酸铜溶液中加入氢氧化钠溶液,过滤、洗涤沉淀,向沉淀中加入适
量稀硫酸,充分反应后蒸发结晶得到硫酸铜晶体。
故填:在硝酸铜溶液中加入氢氧化钠溶液,过滤、洗涤沉淀,向沉淀中加入适量稀硫酸,
充分反应后蒸发结晶。
例 10.(2020•杭州)一种制备氢氧化镁的生产流程如图所示,MgCl2 和 NaOH 按恰好完全
反 应 的 比 例 加 料 。
(1)写出步骤 c 中发生反应的化学方程式: MgCl2+2NaOH═Mg(OH)2↓+2NaCl 。
(2)x= 280 。
(3)过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是 氯化钠 。
(4)如图流程中若用下列物质代替氢氧化钠,也能制得氢氧化镁的是
③
。
①
盐酸
②
氯化钙
③
氨水
④
硫酸镁
【解答】解:(1)步骤 c 中氯化镁和氢氧化钠反应生成氢氧化镁沉淀和氯化钠,发生反
应的化学方程式:MgCl2+2NaOH═Mg(OH)2↓+2NaCl。
故填:MgCl2+2NaOH═Mg(OH)2↓+2NaCl。
(2)根据题意有:
每分钟反应的氯化镁质量:332.5g/L×0.1L=33.25g,
MgCl2+2NaOH═Mg(OH)2↓+2NaCl,
95 80
33.25g xg/L×0.1L
�.
��䁚�.� �
��
��h���䁚䁡�
,
x=280。
故填:280。
(3)过滤得到的粗产品还要经过洗涤,洗涤时主要除去的杂质是反应生成的氯化钠。
故填:氯化钠。
(4)如图流程中若用下列物质代替氢氧化钠,也能制得氢氧化镁的是氨水,是因为氨水
是碱,能和氯化镁反应生成氢氧化镁沉淀和氯化铵。
故填:
③
。
例 11.(2020•湖州)一水硫酸四氨合铜的化学式为[Cu(NH3)4]SO4•H2O,是一种高效、
安全的杀菌剂。它在乙醇﹣﹣水混合溶剂中的溶解度随乙醇体积分数的变化曲线如图甲
所示。小明在实验室以氧化铜为主要原料合成该物质,他设计的合成路线如图乙所示:
(1)溶液 A 中一定存在的溶质为 硫酸铜 。
(2)溶液 B 中含硫酸四氨合铜,“一系列操作”是指向溶液 B 中加入适量 乙醇 、过
滤、洗涤、干燥等。
【解答】解:(1)溶液 A 中一定存在的溶质有稀硫酸和氧化铜反应生成的硫酸铜。
故填:硫酸铜。
(2)由图甲可知,一水硫酸四氨合铜不溶于乙醇,溶液 B 中含硫酸四氨合铜,“因此一
系列操作”是指向溶液 B 中加入适量乙醇、过滤、洗涤、干燥等。
故填:乙醇。
例 12.(2019•衢州)某 KCl 固体样品中含有少量 CaCl2 杂质,实验室提纯氯化钾的流程如
图。(氯化钾溶解度受温度影响较小)
(1)沉淀 a 是 碳酸钙 。
(2)操作Ⅰ是
②
。
①
冷却热饱和溶液
②
蒸发结晶
(3)若 KCl 固体样品中还含有少量杂质 K2SO4,小科认为提纯该样品只要在上述方案基
础上增加一步实验:在“加入过量 K2CO3 溶液”与“过滤”操作之间,加过量的硝酸钡
溶液。小江认为这种方案不合理,会导致所得 KCl 固体中含有新的杂质,新杂质是 硝
酸钾和硝酸钡 。
【解答】解:
(1)氯化钙和碳酸钾反应生成碳酸钙沉淀和氯化钾,所以沉淀 a 是 碳酸钙。
(2)由于溶液 C 为氯化钾和氯化氢的混合溶液,目的得到氯化钾,所以为方便和简单,
操作 I 是蒸发结晶。故选:
②
。
(3)若 KCl 固体样品中还含有少量杂质 K2SO4,小科认为提纯该样品只要在上述方案基
础上增加一步实验:在“加入过量 K2CO3 溶液”与“过滤”操作之间,加过量的硝酸钡
溶液。由于硝酸钡和碳酸钾反应生成硝酸钾和碳酸钡,同时硝酸钡是过量,所以会导致
所得 KCl 固体中含有新的杂质,新杂质是生成的硝酸钾和过量的硝酸钡,所以不合理。
故答案为:
(1)碳酸钙。
(2)
②
。
(3)硝酸钾和硝酸钡。
【习题巩固】
一.选择题(共 10 小题)
1.“五水共治”大大美化了河道环境,某学校实验室排出的废水中含有 Ag+、Ba2+和 NO3
﹣
三种离子,该校实验小组设计实验从该废水中回收银,并得到副产品碳酸钡固体,操作
步 骤 和 实 验 结 果 如 图 :
已知滤液 B 中只含有一种溶质,则下列说法不正确的是( )
A.蓝色沉淀是 Cu(OH)2
B.乙一定是氢氧化钡
C.若丙是 K2CO3,滤液 C 结晶后可以作为化学肥料
D.若得到 19.7g 碳酸钡,则证明原废水中含有 13.7g 钡
【解答】解:A、蓝色沉淀是氢氧化钡和硝酸铜反应生成的氢氧化铜,该选项说法正确;
B、滤液 B 中只含有一种溶质,乙中一定含有钡离子和氢氧根离子,因此乙是氢氧化钡,
该选项说法正确;
C、若丙是 K2CO3,碳酸钾和硝酸钡反应生成碳酸钡沉淀和硝酸钾,滤液 C 结晶后得到
硝酸钾,可以作为化学肥料,该选项说法正确;
D、若得到 19.7g 碳酸钡,则钡离子质量:19.7g×
䁡�㈮
䁡�㈮ �
13.7g,由于加入的乙是氢氧化
钡溶液,则原废水中的钡离子质量小于 13.7g,该选项说法不正确。
故选:D。
2.下列各组所示的化学变化中,不可能实现的是( )
A.Cu →
加硫酸钠溶液
E →
加烧碱溶液
F→� CuO
B.Fe2(SO4)3 →
加氯化钡溶液
滤液 X →
加烧碱溶液
沉淀 Y →
加硫酸
Fe2(SO4)3
C.CuO →
通氢气
�R →
加硝酸银溶液
滤液 J →
加烧碱溶液
Cu(OH)2
D.BaCO3 →
加盐酸
M →
加硝酸银溶液
滤液 Q →
加碳酸钠溶液
BaCO3
【解答】解:A、由于钠的活泼性大于铜,铜与硫酸钠不发生反应,故 A 变化不能实现;
B、硫酸铁与氯化钡反应生成了硫酸钡沉淀和氯化铁,氯化铁与氢氧化钠反应生成了氢氧
化铁,氢氧化铁与稀硫酸反应生成了硫酸铁,故 B 变化能实现;
C、氧化铜通入氢气在加热时生成了铜和水,铜与硝酸银反应生成了硝酸铜和银,硝酸铜
能与氢氧化钠反应生成了氢氧化铜蓝色沉淀,故 C 变化能实现;
D、碳酸钡和稀盐酸反应生成了氯化钡、二氧化碳和水,氯化钡与硝酸银反应生成了氯化
银白色沉淀和氯化钡,氯化钡与碳酸钠反应生成了碳酸钡沉淀。故 D 变化能实现。
故选:A。
3.火柴头原本是一种不被磁铁吸引的物体,但火柴烧过后,却能被磁铁吸引,原因是很多
火柴头用氧化铁着色,点燃后会与木棒中的碳反应产生四氧化三铁和二氧化碳,由此作
出的推断不合理的是( )
A.Fe3O4 与 Fe2O3 磁性不同,体现他们物理性质不同
B.Fe3O4 中铁的质量分数大于 Fe2O3
C.火柴头燃烧的方程式为 C+O2+6Fe2O3
点燃
�
4Fe3O4+CO2
D.火柴头不被磁铁吸引的是因为不易被磁化
【解答】解:A、磁性属于物理性质,Fe3O4 与 Fe2O3 磁性不同,体现他们的物理性质不
同,故选项说法正确。
B、在 Fe2O3、Fe3O4 中,将化学式变形得 FeO1.5、FeO1.3,其它原子的相对质量之和越小
的,在该化合物中铁元素的质量分数就越大,变形后 FeO1.3 中其它原子的相对质量之和
越小,则 Fe3O4 中铁的质量分数大于 Fe2O3,故选项说法正确。
C、很多火柴头用氧化铁着色,点燃后会与木棒中的碳反应产生四氧化三铁和二氧化碳,
反应的化学方程式为 C+6Fe2O3
点燃
�
4Fe3O4+CO2,故选项说法错误。
D、火柴头原本是一种不被磁铁吸引的物体,火柴头不被磁铁吸引的是因为不易被磁化,
故选项说法正确。
故选:C。
4.甲乙丙有如图所示的转化关系(“→”表示反应一步实现,部分反应物和反应条件略去),
下列各组物质按照甲乙丙的顺序不符合要求的是( )
A.C、CO2、CO B.H2O2、O2、H2O
C.CuO、Cu、Cu(NO3)2 D.NaOH、NaCl、NaNO3
【解答】解:
A、碳充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳,而一氧化碳和二氧化碳之间可
以相互转化。符合转化要求;
B、过氧化氢(甲)可以分解为氧气(乙)和水(丙),而氧气(乙)可以和含氢可燃物
反应生成水(丙),水(丙)也能分解生成氧气(乙)。符合转化要求;
C、氧化铜(甲)可以和还原性物质反应生成铜(乙),也可以和硝酸反应生成硝酸铜(丙),
而铜(乙)和硝酸银或者和浓硝酸反应生成硝酸铜(丙),硝酸铜(丙)也能和锌铁等金
属反应生成铜(乙)。符合转化要求;
D、氢氧化钠(甲)可以和盐酸或者可溶性金属氯化物如氯化镁、氯化铁等反应生成氯化
钠(乙),也可以和硝酸或者可溶性金属硝酸盐硝酸镁、硝酸铁等反应生成硝酸钠(丙),
而氯化钠(乙)可以和硝酸银生成硝酸钠(丙),硝酸钠(丙)不能转化为氯化钠(乙)。
不符合转化要求;
故选:D。
5.下列表中各组物质不能按照图中关系(“→”表示反应一步完成)转化的是( )
物质
选项
A B C D
X Na2SO4 BaCl2 Cu CaO
Y NaCl Ba(NO3)2 CuO CaCl2
Z NaNO3 BaCO3 CuSO4 CaCO3
A.A B.B C.C D.D
【解答】解:A、硫酸钠能与氯化钡一步反应生成氯化钠,氯化钠能与硝酸银一步反应生
成硝酸钠,硝酸钠不能一步反应生成硫酸钠;
B、氯化钡能与硝酸银一步反应生成硝酸钡,硝酸钡能与碳酸钠一步反应生成碳酸钡,碳
酸钡能与盐酸一步反应生成氯化钡;
C、铜能与氧气一步反应生成氧化铜,氧化铜能与硫酸一步反应生成硫酸铜,硫酸铜能与
铁一步反应生成铜;
D、氧化钙能与盐酸一步反应生成氯化钙,氯化钙能与碳酸钠一步反应生成碳酸钙,碳酸
钙能高温分解一步生成氧化钙;
故选:A。
6.三种物质间只通过一步反应就能实现如箭头所指方向的转化,下列符合要求的组合是
( )
A.
①②
B.
①③
C.
②③
D.
①②③【解答】解:
①
硫酸钠与氢氧化钡溶液反应生成硫酸钡沉淀和氢氧化钠,氢氧化钠与二
氧化碳反应生成碳酸钠和水,碳酸钠与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,
碳酸钠与硫酸反应生成硫酸钠、水和二氧化碳,只通过一步就能实现如箭头所指方向的
转化。
②
氢气与氧化铜反应生成铜和水,水通电分解生成氢气和氧气,氢气燃烧生成水,铜与
氧气在加热条件下生成氧化铜,只通过一步就能实现如箭头所指方向的转化。
③
锌与氯化亚铁溶液反应生成氯化锌和铁;铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜;
锌与硫酸亚铁溶液反应生成铁和硫酸锌,硫酸亚铁与氯化钡溶液反应生成硫酸钡沉淀和
氯化亚铁溶液;只通过一步就能实现如箭头所指方向的转化。
故
①②③
均只通过一步反应就能实现如箭头所指方向的转化。
故选:D。
7.下列物质的转化能实现的是( )
A.H2SO4→HCl B.CO→Na2CO3
C.Cu(OH)2→NaOH D.NaNO3→Ba(NO3)2
【解答】解:A、稀硫酸和氯化钡会生成硫酸钡沉淀和稀盐酸,故 A 正确;
B、一氧化碳不会转化成碳酸钠,故 B 错误;
C、氢氧化铜是不溶性碱,不会生成可溶性碱,故 C 错误;
D、所有的硝酸盐、钠盐都溶于水,发生的反应不符合复分解反应的条件,故 D 错误。
故选:A。
8.小科总结了三幅无机物之间的相互转化关系图。图中的每个转化在一定条件下均能一步
实现的是( )
A.
①②
B.
①
C.
②③
D.
①②③【解答】解:
①
铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜;铜在氧气中加热生成氧化
铜,氧化铜与稀硫酸反应生成硫酸铜和水;每一转化在一定条件下均能一步实现。
②
氢氧化钠与稀盐酸反应生成氯化钠和水,氯化钠转化为碳酸钠,假设能行,另一生成
物应为氯化银,但碳酸银难溶于水,不能与氯化钠发生复分解反应,每一转化在一定条
件下不能均一步实现。
③
氢气燃烧生成水,水不能通过一步反应生成过氧化氢,过氧化氢不能通过一步反应生
成氢气,每一转化在一定条件下不能均一步实现。
故
①
中的转化在一定条件下均能一步实现。
故选:B。
9.如下无机物转化关系图中,每个转化在一定条件下均能按箭头方向一步实现的是( )
A.只有
①②
B.只有
①③
C.只有
②③
D.
①②③
都是
【解答】解:氧化铜与硫酸反应可生成硫酸铜和水,铜与氧气反应在加热条件下生成氧
化铜,铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,每个转化在一定条件下均能按箭头
方向一步实现。
故选:D。
10.如图是以“铁氧化物”为催化剂,利用太阳能将 CO2 资源化利用的方法之一,在此转
化过程中包含化学反应
①
和
②
,则下列说法正确的是( )
A.
①
中 Fe(1﹣y)O 体现出氧化性,做氧化剂
B.
②
中的能量转化为:化学能转化为太阳能
C.此转化过程总的化学方程式为:CO2
铁氧化物
�太阳能 C+O2
D.做催化剂的“铁氧化物”是 Fe3O4
【解答】解:A、
①
中,铁元素的化合价升高,所以 Fe(1﹣y)O 体现出还原性,做还原
剂,故 A 错误;
B、
②
中的能量转化为:太阳能转化为化学能,故 B 错误;
C、CO2 热解为碳和氧气,碳元素化合价由+4 变成 0,氧元素化合价由﹣2 变成 0,故 C
正确;
D、通过分析可知,做催化剂的“铁氧化物”是 Fe(1﹣y)O,故 D 错误。
故选:C。
二.填空题(共 4 小题)
11.用某工业废弃固体(成分为 Cu2S 和 FeS2)制备硫酸铜溶液和硫酸亚铁晶体的流程如图
所示。(已知:
①
固体 B 含有氧化铜、氧化铁,
②
铁能与硫酸铁反应,生成硫酸亚铁)。
(1)操作Ⅱ的名称是 过滤 。
(2)固体 D 中含有 Fe、Cu (用化学式表示)。
(3)加入过量 x 的作用是 将溶液 C 中的 H2SO4、CuSO4 和 Fe2(SO4)3 全部转化成
FeSO4 同时生成铜 。
(4)写出固体 D 中加入过量 y 时发生反应的化学方程式 Fe+H2SO4═FeSO4+H2↑ 。
【解答】解:(1)由实验的流程可知,操作Ⅱ能将固液分开,名称是过滤。
(2)由实验的流程可知,Cu2S 和 FeS2 在空气中灼烧时生成固体氧化铜、氧化铁和气体
二氧化硫。固体氧化铜、氧化铁在加入过量的硫酸时生成了硫酸铜和氧化铁,为了得到
硫酸亚铁,加入的过量的 x 应是铁,铁能与过量的硫酸、硫酸铜和硫酸铁反应生成了硫
酸亚铁,得到的固体中 D 中含有 Fe、Cu。
(3)由上述分析可知,加入过量 x 的作用是:将溶液 C 中的 H2SO4、CuSO4 和 Fe2(SO4)
3 全部转化成 FeSO4 同时生成铜。
(4)为了将固体中铁除去同时得到硫酸亚铁,固体 D 中加入过量的 y 是稀硫酸,发生反
应的化学方程式:Fe+H2SO4═FeSO4+H2↑。
故答案为:(1)过滤。
(2)Fe、Cu。
(3)将溶液 C 中的 H2SO4、CuSO4 和 Fe2(SO4)3 全部转化成 FeSO4 同时生成铜。
(4)Fe+H2SO4═FeSO4+H2↑。
12.2020 年奥运会奖牌制作原料来自于电子垃圾中提炼出来的金属。从废线路板中提炼贵
重金属和制备硫酸铜晶体的一种工艺流程如图:
已知:在酸性环境中有过氧化氢存在时,铁和铜分别会转化为铁离子和铜离子。
(1)操作
①
的名称是 过滤 ;
(2)调节 pH 的主要目的是除去滤液中 Fe3+、Al3+ (填离子符号);
(3)写出粗铜中的铜与稀硫酸和过氧化氢的混合溶液发生反应的化学方程式:
Cu+H2SO4+H2O2=CuSO4+2H2O 。
【解答】解:(1)经过操作
①
得到了滤液和固体贵金属,实现了固液分离,常用方法为
过滤;
故答案为:过滤。
(2)经过调解 pH 析出固体为氢氧化铁和氢氧化铝,因此调解 pH 去除的主要离子为铁
离子和铝离子;
故答案为:Fe3+、Al3+。
(3)经过操作
②
得到了硫酸铜溶液,说明铜与硫酸和双氧水反应生成硫酸铜,根据质量
守恒定律,另一产物为水,所以铜、硫酸和过氧化氢反应生成硫酸铜和水,书写化学方
程式注意配平;
故答案为:Cu+H2SO4+H2O2=CuSO4+2H2O。
13.Ba(NO3)2 可用于生产信号弹、炸药等。利用钡泥(主要含有 BaCO3、BaSO3、Fe2O3)
可制取 Ba(NO3)2,其部分流程如图:
(1 ) 写出 Fe2O3 与 稀 HNO3 反 应的 化学 方程 式: Fe2O3+6HNO3 =2Fe (NO3 )
3+3H2O 。
(2)试剂 Y 为 Ba(OH)2 溶液 。
【解答】解:(1)Fe2O3 与 HNO3 反应生成硝酸铁和水,对应的化学方程式:Fe2O3+6HNO3
=2Fe(NO3)3+3H2O。
(3)由物质的转化可知,硝酸铁与试剂 Y 生成了硝酸钡和氢氧化铁,所以 Y 为 Ba(OH)
2 溶液。
故答案为:
(1)复分解反应 Fe2O3+6HNO3=2Fe(NO3)3+3H2O;
(2)Ba(OH)2 溶液。
14.小乐用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4•7H2O)相关信息如下:
①
金属离子形成氢氧化物沉淀的相关 pH 范围
金属离子 pH
开始沉淀 完全沉淀
Fe3+ 1.5 2.8
Fe2+ 5.5 8.3
Zn2+ 5.4 8.2
②
ZnSO4 的溶解度随温度变化曲线。
(1)步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是 产生气泡的速率变缓慢 。
(2)步骤Ⅱ,需加入过量 H2O2,理由是 把亚铁离子氧化成铁离子 。
(3)步骤Ⅲ,合适的 pH 范围是 2.8≤pH<5.4 。
【解答】解:(1)步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是产生气泡的速率变
缓慢,说明锌已经完全反应。
故填:产生气泡的速率变缓慢。
(2)步骤Ⅱ,需加入过量 H2O2,理由是把亚铁离子氧化成铁离子。
故填:把亚铁离子氧化成铁离子。
(3)步骤Ⅲ,合适的 pH 范围是 2.8≤pH<5.4,此范围内铁离子沉淀完全,锌离子没有
沉淀。
含有:2.8≤pH<5.4。
三.实验探究题(共 4 小题)
15.二氧化氯 ClO2 是目前国际上公认的第四代高效、无毒的消毒剂,是一种黄绿色的气体,
易溶于水。实验室可用 NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备 ClO2,其流程如
图:
(1)写出电解时发生反应的化学方程式: NH4Cl+2HCl
通电
�
3H2↑+NCl3 。
(2)除去 ClO2 中的 NH3 可选用的试剂是 C (填序号)。
A.饱和食盐水
B.碱石灰
C.浓硫酸
D.水
(3)测定 ClO2(如图 2)的过程如下:在锥形瓶中加入足量的碘化钾,用 100mL 水溶
解后,再加 3mL 硫酸溶液;在玻璃液封管中加入水;将生成的 ClO2 气体通过导管在锥
形瓶中被吸收;将玻璃封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液用 c mol•L﹣
1Na2S2O3 标准溶液滴定(I2+2Na2S2O3═2NaI+Na2S4O6),共用去 VmL Na2S2O3 溶液。
④
装置中玻璃液封管的作用是吸收残余的二氧化氯气体,并使 锥形瓶内外压强相等 。
②
请写出上述二氧化氯气体与碘化钾溶液反应的离子方程式: 10I﹣+8H++ClO2=5I2↓
+4H2O+2Cl﹣ 。
③
滴定终点的现象是 溶液蓝色褪去,且半分钟内颜色不再恢复 。
④
测得通入的 ClO2 质量
�㈮൬
���� �
。
【解答】解:(1)氯化铵与盐酸在通电条件下反应生成氯化氮和氢气,书写化学方程式
注意配平和气体符号,所以化成方程式为 NH4Cl+2HCl
通电
�
3H2↑+NCl3;
故答案为:NH4Cl+2HCl
通电
�
3H2↑+NCl3。
(2)A、二氧化氯易溶于水,因此不能使用饱和食盐水吸收氨气,选项 A 不符合题意;
B、碱石灰含有碱性物质,不会吸收氨气,选项 B 不符合题意;
C、浓硫酸具有酸性,可以吸收氨气,选项 C 符合题意;
D、二氧化氯和氨气都能溶于水,选项 D 不符合题意;
故答案为:C。
(3)
①
利用连通管,可以保持锥形瓶内外压强相等,利于装置内液体的进入锥形瓶;
故答案为:锥形瓶内外压强相等。
②
碘化钾、硫酸、二氧化氯反应生成碘单质、水、氯化钾和硫酸钾,所以化学方程式为
10KI+4H2SO4+2ClO2=5I2↓+4H2O+4K2SO4+2KCl,书写离子方程式时,将离子化合物碘
化钾、硫酸、硫酸钾和氯化钾拆分,然后去除反应前后都存在的离子,所以该反应离子
方程式为 10I﹣+8H++ClO2=5I2↓+4H2O+2Cl﹣;
故答案为:10I﹣+8H++ClO2=5I2↓+4H2O+2Cl﹣。
③
开始时生成了碘单质,加入淀粉后溶液变为蓝色,再加入硫代硫酸钠,碘被消耗,反
应刚好完成后,蓝色则会消失;
故答案为:溶液蓝色褪去,且半分钟内颜色不再恢复。
④
设碘单质的物质的量为 x,二氧化氯的物质的量为 y,硫代硫酸钠物质的量
� ൬㌳䁣ㄮ���䁡�㌳�
䁡���㌳ㄮ���䁡 � ൬
䁡���
mol
I2+2Na2S2O3═2NaI+Na2S4O6
1 2
x
൬
䁡��� ㌳䁣ㄮ据此可以得出碘单质物质的量 x
� ൬
���� ㌳䁣ㄮ
;
10I﹣+8H++ClO2=5I2↓+4H2O+2Cl﹣;
1 5
y
൬
���� ㌳䁣ㄮ据此可以得出二氧化氯物质的量 y
� ൬
䁡���� ㌳䁣ㄮ
,所以二氧化氯的质量=y×67.5g•mol﹣
1
� �㈮൬
���� �
;
故答案为:
�㈮൬
���� �
。
16.氢氧化铜化学性质不稳定,易在空气中分解成水和氧化铜,另外氢氧化铜还易与二氧化
碳和水蒸气发生化合反应,生成碱式碳酸铜(Cu2(OH)2CO3),为此实验室经常需要新
制氢氧化铜。小科同学在实验室用氧化铜、稀硫酸和氢氧化钠溶液制备氢氧化铜。
【查阅资料】不溶性碱受热易分解:Cu(OH)2
��
CuO+H2O;Cu2(OH)2CO3 为不溶于
水的绿色固体。
【实验原理】CuO+H2SO4═CuSO4+H2O,CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
【实验及现象】
实验步骤 实验现象
①
取少量氧化铜放于试管中,加入一定量的 稀硫
酸 ,
并用酒精灯对试管进行加热。
试管中黑色全部溶解,得到蓝色溶
液。
②
向试管中加入氢氧化钠溶液。 有蓝色沉淀但一会儿部分蓝色沉淀
变成黑色
【实验分析】小科的实验最终没有得到蓝色的氢氧化铜,却意外得到了黑色固体。
【实验反思】(1)实验中得到黑色固体是 CuO (写化学式)为了新制氢氧化铜,小
科又设计了实验步骤
②
的方案:
方案一:在步骤
①
结束后,趁热加入氢氧化钠溶液。
方案二:在步骤
①
结束后,等试管冷却后加入氢氧化钠溶液。请从两个方案中选出合理
的方案,并说明理由 方案二合理,是因为温度较高时生成的氢氧化铜容易分解 。
(2)小科同学改进实验方案后,当往试管中滴加氢氧化钠溶液的步骤中,产生蓝色沉淀
与滴加氢氧化钠溶液的体积关系如图所示。
由此可以判断步骤
①
结束后,试管中含有的溶质是 硫酸铜、硫酸 。对于“没有立即
产生沉淀”,小科又开始新的实验改进方案……
【解答】解:【实验及现象】
取少量氧化铜放于试管中,加入一定量的稀硫酸,并用酒精灯对试管进行加热,试管中
黑色全部溶解,得到蓝色溶液,是因为氧化铜和稀硫酸反应生成硫酸铜和水。
故填:稀硫酸。
【实验反思】
(1)实验中得到黑色固体是 CuO;
方案二合理,是因为温度较高时生成的氢氧化铜容易分解。
故填:CuO;方案二合理,是因为温度较高时生成的氢氧化铜容易分解。
(2)加入氢氧化钠后不能立即产生沉淀,是因为氢氧化钠先和硫酸反应,由此可以判断
步骤
①
结束后,试管中含有的溶质是反应生成的硫酸铜和过量的硫酸。
故填:硫酸铜、硫酸。
17.Fe(OH)2 是白色难溶于水的物质,可用于制颜料、药物等,但很容易被空气中的氧气
氧化为 Fe(OH)3,氧化过程中白色沉淀转化为灰绿色沉淀,最后变为红褐色沉淀。现
用铁片、稀盐酸、氢氧化钠溶液、水等试剂制取少量的 Fe(OH)2,装置如图。
(1)检查气密性。关闭阀门 A 和 B,让 1 中液体进入到容器 2 中。虚线框所在装置,发
生的反应的化学方程式是 Fe+2HCl═FeCl2+H2↑ 。
(2)容器 2 中充满氢气后,打开阀门 A,关闭阀门 B,应出现的现象是 容器 2 中液体
被压入容器 3,容器 3 中出现白色沉淀 。
(3)实验完毕,关闭阀门 A 和 B,制得的 Fe(OH)2 在容器 3 (选填“3”或“4”)
中。
(4)本实验中所有配制溶液的水需煮沸,容器 2、3 均密闭,其主要原因是 防止 Fe(OH)
2 被氧化 。
【解答】解:由所给药品的性质和装置的特点可知,该实验中利用铁片和盐酸反应制得
氯化亚铁,再使氯化亚铁与氢氧化钠溶液反应制得氢氧化亚铁,因此分液漏斗中加入稀
盐酸,容器 2 中加入铁片,容器 3 中加入氢氧化钠溶液,利用铁与稀盐酸反应生成的氢
气可将容器 2 中的氯化亚铁溶液压入容器 3 中与氢氧化钠溶液反应,因此制得的氢氧化
亚铁在容器 3 中,所以:
(1)检查气密性。关闭阀门 A 和 B,让 1 中液体进入到容器 2 中。虚线框所在装置是铁
与稀盐酸反应制取氯化亚铁的,发生的反应的化学方程式是:Fe+2HCl═FeCl2+H2↑。
(2)容器 2 中充满氢气后,打开阀门 A,关闭阀门 B,应出现的现象是容器 2 中液体被
压入容器 3,容器 3 中出现白色沉淀。
(3)由上述分析可知,实验完毕,关闭阀门 A 和 B,制得的 Fe(OH)2 在容器 3 中。
(4)由于水中溶有少量的氧气,空气中含有氧气,所以本实验中所有配制溶液的水需煮
沸,容器 2、3 均密闭,其主要原因是防止 Fe(OH)2 被氧化。
故答为:(1)Fe+2HCl═FeCl2+H2↑;(2)容器 2 中液体被压入容器 3,容器 3 中出现白
色沉淀;(3)3;(4)防止 Fe(OH)2 被氧化。
18.黄铜渣中约含 Zn 7%、ZnO 31%、Cu 50%、CuO 5%,其余为杂质.处理黄铜渣可得到
硫酸锌,其主要流程如下(杂质不溶于水、不参与反应):
已知:ZnO+H2SO4═ZnSO4+H2O;
CuO+H2SO4═CuSO4+H2O
( 1 ) Ⅱ 中 反 应 的 化 学 方 程 式 为 H2SO4+Zn ═ ZnSO4+H2 ↑ 、 CuSO4+Zn ═
ZnSO4+Cu ;
(2)下列说法正确的是 abc .
a.Ⅰ、Ⅱ中的操作均包含过滤
b.溶液 A 中 ZnSO4 的质量大于 CuSO4
c.溶液 A 的质量小于溶液 B
d.溶液 C 中溶质的质量分数小于溶液 B.
【解答】解:
①
由于锌排在氢和铜的前面,故锌既可以与酸反应,也可以与硫酸铜反应,
反应的化学方程式分别为:Zn+H2SO4═ZnSO4+H2↑,Zn+CuSO4=ZnSO4+Cu,
故答案为:Zn+H2SO4═ZnSO4+H2↑;Zn+CuSO4=ZnSO4+Cu;
②
a.由图可知,操作Ⅰ过滤除去铜和杂质,操作Ⅱ过滤是除去锌和置换出的铜,故 a 正
确;
b.因氧化锌的质量大于氧化铜,另外锌也能和硫酸反应生成硫酸锌,而铜和硫酸不反应,
故溶液 A 中硫酸锌的质量大于硫酸铜,故 b 正确;
c.溶液 A 加入锌后,反应的化学方程式分别为:Zn+H2SO4═ZnSO4+H2↑,Zn+CuSO4
=ZnSO4+Cu;对反应 Zn+H2SO4═ZnSO4+H2↑分析可知,每 65 份质量的锌进入溶液,
从溶液中出来 2 份质量的氢气,使得溶液质量增加,对于反应 Zn+CuSO4=ZnSO4+Cu 来
说,每 65 份质量的锌进入溶液,从溶液中析出 64 份质量的铜,也使得溶液质量增大,
故溶液 A 的质量小于溶液 B,故 c 正确;
d.溶液 C 为饱和溶液,质量分数达到同温度下的最大值,故 d 错误,
故选:abc.
故答案为:(1)H2SO4+Zn═ZnSO4+H2↑ CuSO4+Zn═ZnSO4+Cu
(2)a、b、c
四.解答题(共 2 小题)
19.氢氧化镁是一种重要的化工原料,某矿石由 MgO、Fe2O3、CuO 和 SiO2 组成,用它制
备氢氧化镁的流程示意图如图。
(1)溶液 A 中所含的阳离子有 Mg2+、Fe3+、Cu2+、H+ (填离子符号)。
(2)已知:部分金属阳离子以氢氧化物形成沉淀时溶液的 pH 见表:
沉淀物 Fe(OH)3 Cu(OH)2 Mg(OH)2
开始沉淀 1.9 4.2 9.1
完全沉淀 3.2 6.7 11.1
步骤二中加入熟石灰,调节溶液的 pH 范围为 7﹣9,其目的是为了防止沉淀 C 中出现 氢
氧化镁沉淀 。
(3)3 个步骤中均用到的操作是 过滤 。
(4)步骤三中生成产品的化学方程式为 MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2 。
【解答】解:(1)氧化镁和盐酸反应生成氯化镁和水,氧化铁和盐酸反应生成氯化铁和
水,氧化铜和盐酸反应生成氯化铜和水,以及加入的盐酸是过量的,所以溶液 A 中所含
阳离子有 Mg2+、Fe3+、Cu2+、H+;
(2)为保证产品纯度、减少产品损失,并便于操作,溶液 B 的 pH 可容许的范围为 7~9,
目的是为了防止沉淀 C 中出现氢氧化镁沉淀;
(3)过滤可以将不溶性固体从溶液中分离出来,所以 3 个步骤中均用到的操作是过滤;
(4)氯化镁和氢氧化钙反应生成氢氧化镁沉淀和氯化钙,化学方程式为:MgCl2+Ca(OH)
2═Mg(OH)2↓+CaCl2。
故答案为:(1)Mg2+、Fe3+、Cu2+、H+;
(2)氢氧化镁沉淀;
(3)过滤;
(4)MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2。
20.以镁矿石(主要成分为 MgCO3 和 SiO2,其中 SiO2 难溶于水和常见的酸)为原料生产
MgO 的工艺流程如图,回答问题:
(1)“沉镁”时 MgSO4 与 NH3•H2O 发生复分解反应。写出该反应的化学方程式
MgSO4+2NH3•H2O=Mg(OH)2↓+(NH4)2SO4 。
(2)对过滤 II 所得沉淀进行洗涤,判断沉淀已洗涤干净的方法是 取少量滤液于试管中,
滴加氯化钡溶液,如果不产生白色沉淀,说明洗涤干净 。
【解答】解:(1)“沉镁”时 MgSO4 与 NH3•H2O 发生复分解反应生成氢氧化镁沉淀和硫
酸铵,该反应的化学方程式:MgSO4+2NH3•H2O=Mg(OH)2↓+(NH4)2SO4。
故填:MgSO4+2NH3•H2O=Mg(OH)2↓+(NH4)2SO4。
(2)对过滤 II 所得沉淀进行洗涤,判断沉淀已洗涤干净的方法是:取少量滤液于试管中,
滴加氯化钡溶液,如果不产生白色沉淀,说明溶液中不含有硫酸铵,已经洗涤干净。
故填:取少量滤液于试管中,滴加氯化钡溶液,如果不产生白色沉淀,说明洗涤干净。
声明:试 题解析著作权 属菁优网所有 ,未经书面同 意,不得复制 发布
日期:2021/1/5 15:24:39 ;用户: 初中化;邮箱 :nsjy71@xyh.com;学号: 28079603