- 146.00 KB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2007年全国初中化学竞赛黑龙江省赛区初赛试题
考生注意:1.考试时间120分钟。 2.全卷共5大题,总分100分。
可能用到的相对原子质量:H-1 C-12 O-16 Mg-24 A1-27 C1-35.5 K-39 Ca-40 Fe-56
一、选择题(本题共20个小题,每题2分,共40分。1-15题每小题只有一个正确选项;16-20题每小题有一个或两个正确选项。将正确选项的序号填入括号内)
1.据统计,世界上的古建筑在20世纪所遭受的腐蚀比过去几百年甚至几千年所遭受的腐
蚀还要严重,其中最可能的原因是 ( )
A.管理部门维修不及时,引起古建筑的腐蚀
B.化石燃料大量使用,形成酸雨,加速了古建筑的腐蚀
C.参观的人数急剧增多,加速了古建筑的磨损
D.温室效应加剧,加速了古建筑的风化
2.为了及时发现煤气泄露,常在煤气中加入少量有特殊气味的乙硫醇(C2H5SH)。乙硫醇在煤 气燃烧过程中也可燃烧,其充分燃烧时反应的化学方程式为:
则X的化学式为 ( )
A.H2SO4 B.SO3 C.SO2 D.CO
3.金属活动性的强弱与人类开发和利用这些金属单质的时间顺序有着某种内在联系。由此推断,下列金属中人类开发利用最晚的是 ( )
A. Cu B.Fe C.Ag D.Al
4.某物质溶于水,所得溶液既能使紫色石蕊试液变蓝,也能与铵盐反应生成气体,此物质可能是①氧化物;②碱;③酸中的 ( )
A.①② B.②③ C.② D.①②③
5.在托盘天平两盘上分别放有盛有等质量的足量稀盐酸的烧杯,调整天平至平衡。向左边烧杯中加入10.8g镁条,向右边烧杯中加入10.8g铝条(两金属外形相同,表面均经过砂纸打磨处理)。反应过程中指针偏转情况正确的是 ( )
A. 先偏左,最后偏右 B.先偏右,最后偏左
C.先偏左,最后平衡 D.先偏右,最后平衡
6.铜和铝是目前常使用重要的金属。钛(Ti)因其有许多神奇的性能也将成为21世纪的重要金属之一。下列有关三种金属及其合金的相关说法错误是 ( )
A.钛或钛合金放到海水中数年取出后仍光亮如初,说明钛具有很强的抗腐蚀性
B.将大小厚薄相等的铜、铝、钛分别放入盛有稀盐酸的试管中,观察到钛的表面放出缓慢气泡,铝的表面气泡放出较快,铜的表面无现象,由此可推测三种金属的活动性顺序为:Al>Cu>Ti
C.某同学的铜制眼镜框表面出现绿色物质[主要成分Cu2(OH)2CO3],可用稀盐酸除去
D.高层建筑常采用铝合金门窗而不采用铁门窗,主要原因是铝的密度小且易形成一层致密的氧化物薄膜
7.实验室有失去标签的盐酸、碳酸钠、硫酸、氢氧化钾和硝酸钾五瓶溶液。为把它们区分开来,所加试剂及先后顺序合理的一组是 ( )
A. 氯化钡溶液、稀硝酸、石蕊试液 B.稀硝酸、石蕊试液、硝酸银溶液
C.石蕊试液、稀硝酸、硝酸银溶液 D.稀硝酸、酚酞试液、硝酸银溶液
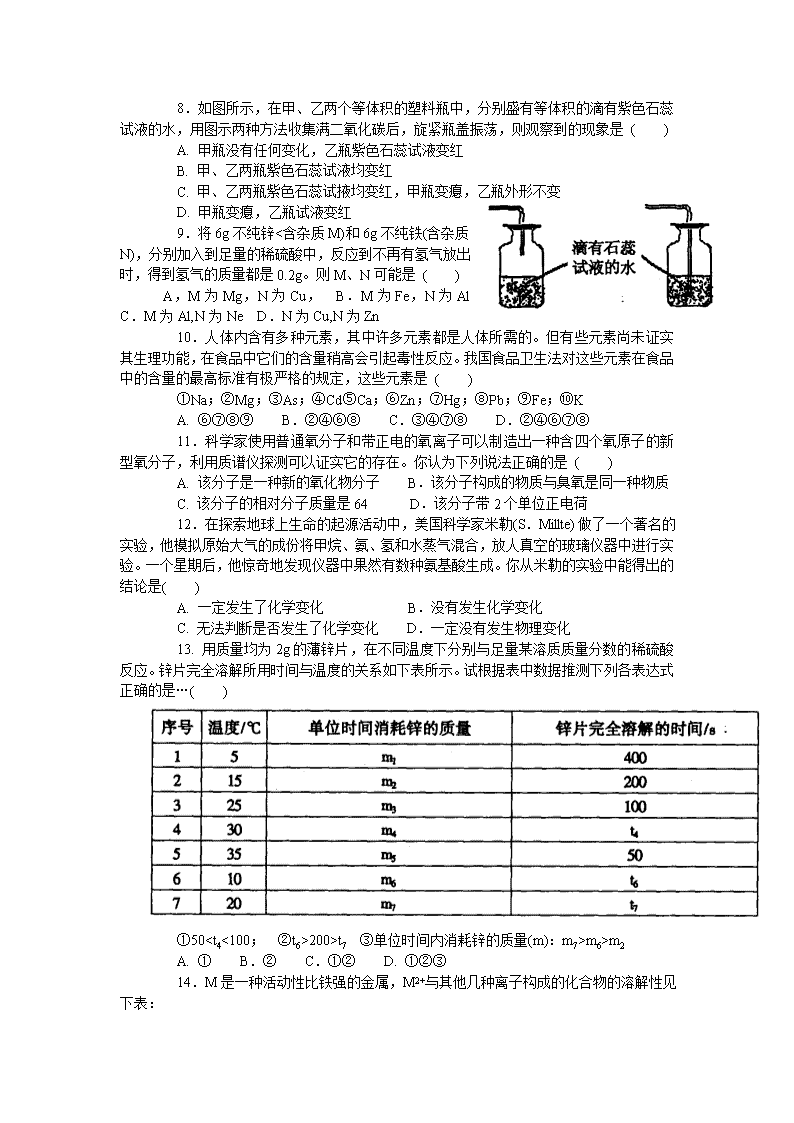
8.如图所示,在甲、乙两个等体积的塑料瓶中,分别盛有等体积的滴有紫色石蕊试液的水,用图示两种方法收集满二氧化碳后,旋紧瓶盖振荡,则观察到的现象是 ( )
A. 甲瓶没有任何变化,乙瓶紫色石蕊试液变红
B. 甲、乙两瓶紫色石蕊试液均变红
C. 甲、乙两瓶紫色石蕊试掖均变红,甲瓶变瘪,乙瓶外形不变
D. 甲瓶变瘪,乙瓶试液变红
9.将6g不纯锌<含杂质M)和6g不纯铁(含杂质N),分别加入到足量的稀硫酸中,反应到不再有氢气放出时,得到氢气的质量都是0.2g。则M、N可能是 ( )
A,M为Mg,N为Cu, B.M为Fe,N为Al C.M为Al,N为Ne D.N为Cu,N为Zn
10.人体内含有多种元素,其中许多元素都是人体所需的。但有些元素尚未证实其生理功能,在食品中它们的含量稍高会引起毒性反应。我国食品卫生法对这些元素在食品中的含量的最高标准有极严格的规定,这些元素是 ( )
①Na;②Mg;③As;④Cd⑤Ca;⑥Zn;⑦Hg;⑧Pb;⑨Fe;⑩K
A. ⑥⑦⑧⑨ B.②④⑥⑧ C.③④⑦⑧ D.②④⑥⑦⑧
11.科学家使用普通氧分子和带正电的氧离子可以制造出一种含四个氧原子的新型氧分子,利用质谱仪探测可以证实它的存在。你认为下列说法正确的是 ( )
A. 该分子是一种新的氧化物分子 B.该分子构成的物质与臭氧是同一种物质
C. 该分子的相对分子质量是64 D.该分子带2个单位正电荷
12.在探索地球上生命的起源活动中,美国科学家米勒(S.Millte)做了一个著名的实验,他模拟原始大气的成份将甲烷、氨、氢和水蒸气混合,放人真空的玻璃仪器中进行实验。一个星期后,他惊奇地发现仪器中果然有数种氨基酸生成。你从米勒的实验中能得出的结论是( )
A. 一定发生了化学变化 B.没有发生化学变化
C. 无法判断是否发生了化学变化 D.一定没有发生物理变化
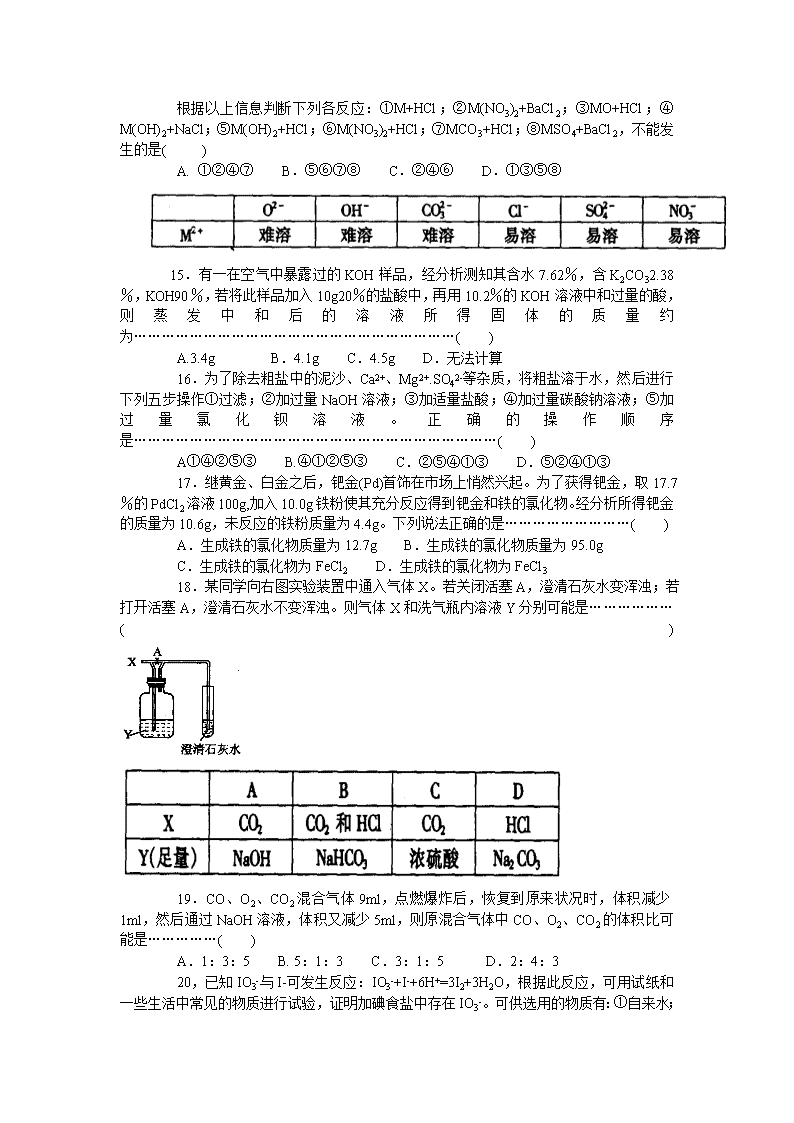
13. 用质量均为2g的薄锌片,在不同温度下分别与足量某溶质质量分数的稀硫酸反应。锌片完全溶解所用时间与温度的关系如下表所示。试根据表中数据推测下列各表达式正确的是…( )
①50200>t7 ③单位时间内消耗锌的质量(m):m7>m6>m2
A. ① B.② C.①② D. ①②③
14.M是一种活动性比铁强的金属,M2+与其他几种离子构成的化合物的溶解性见下表:
根据以上信息判断下列各反应:①M+HCl;②M(NO3)2+BaCl2;③MO+HCl;④M(OH)2+NaCl;⑤M(OH)2+HCl;⑥M(NO3)2+HCl;⑦MCO3+HCl;⑧MSO4+BaCl2,不能发生的是( )
A. ①②④⑦ B.⑤⑥⑦⑧ C.②④⑥ D.①③⑤⑧
15.有一在空气中暴露过的KOH样品,经分析测知其含水7.62%,含K2CO32.38%,KOH90%,若将此样品加入10g20%的盐酸中,再用10.2%的KOH溶液中和过量的酸,则蒸发中和后的溶液所得固体的质量约为……………………………………………………………( )
A.3.4g B.4.1g C.4.5g D.无法计算
16.为了除去粗盐中的泥沙、Ca2+、Mg2+.SO42-等杂质,将粗盐溶于水,然后进行下列五步操作①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量碳酸钠溶液;⑤加过量氯化钡溶液。正确的操作顺序是……………………………………………………………………( )
A①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.⑤②④①③
17.继黄金、白金之后,钯金(Pd)首饰在市场上悄然兴起。为了获得钯金,取17.7%的PdCl2溶液100g,加入10.0g铁粉使其充分反应得到钯金和铁的氯化物。经分析所得钯金的质量为10.6g,未反应的铁粉质量为4.4g。下列说法正确的是………………………( )
A.生成铁的氯化物质量为12.7g B.生成铁的氯化物质量为95.0g
C.生成铁的氯化物为FeCl2 D.生成铁的氯化物为FeCl3
18.某同学向右图实验装置中通入气体X。若关闭活塞A,澄清石灰水变浑浊;若打开活塞A,澄清石灰水不变浑浊。则气体X和洗气瓶内溶液Y分别可能是………………( )
19.CO、O2、CO2混合气体9ml,点燃爆炸后,恢复到原来状况时,体积减少1ml,然后通过NaOH溶液,体积又减少5ml,则原混合气体中CO、O2、CO2的体积比可能是……………( )
A.1:3:5 B. 5:1:3 C.3:1:5 D.2:4:3
20,已知IO3-与I-可发生反应:IO3-+I-+6H+=3I2+3H2O,根据此反应,可用试纸和一些生活中常见的物质进行试验,证明加碘食盐中存在IO3-。可供选用的物质有:①自来水;②蓝色石蕊试纸;③碘化钾淀粉试纸;④淀粉;⑤食盐;⑥食醋;⑦
白酒,进行上述实验时必须用到的物质是……………………………………………………………………………………( )
A.①③ B.③⑥ C.②④⑥ D.①③④⑤⑦
二、填空题(本题共7小题,共24分)
21.有A、B、C、D、E五种物质,其中A是酸;另外四种有一种是碱,三种是盐。D在医院常用作诊断肠胃部疾病的药品。它们之间可以发生以下反应:
(1)A+B→C+H2O (2)C+H2SO4→D↓+A (3)E+AgNO3→AgCl↓+C
根据上述反应,推断下列物质的化学式:
A ;B ;C
22.ZSM—5分子筛是由多个结构单元构成的,其中一个结构单元的化学式可表示为Si96O192。若用4个铝原子取代其中的4个硅原子,形成的原子团所带的负电荷数为 ,若用铵根离子与它结合成电中性,这些铵根离子中共含有 个氢原子
23.某一由盐酸、碳酸钠溶液、稀硫酸、氯化铜溶液四种物质中的两种混合形成的混合溶液,现向该混合溶液中滴入氢氧化钡溶液,产生沉淀的质量与加人氢氧化钡溶液体积的关系如图所示。
据此回答:
(1)该混合溶液是由 和 组成的。
(2)混合溶液中不含 理由是
混合溶液中不含 理由是
24.仿照下列化学方程式:
NaH+H2O=NaOH+H2↑
完成下列化学方程式:NH3+NO2
CaH2+H2O
25、王和小张两位伺学对化学计算很有心得。以下是他们解答一道计算题的实录。请你一起参与研究并完成相关问题。(计算结果精确到0.01)
题目:将15g氯酸钾和3g二氧化锰混合后放入大试管中加热,收集所需氧气后,停止加热让试管冷却。称得试管内剩余固体的质量为10.8g求生成氯化钾的质量。
(1)小王很快得到(15g+3g—10.8g)是 (填化学式)的质量,进而求出KCl的质量是 。
(2)小张依据上述计算的结果发现题目数据有问题。请你说明他发现的问题 。
(3)想要更正此题数据有许多方法。如将题目中“15g氯酸钾”改为“ag氯酸钾”,其他物质的质量不变,则a的取值范围是 。
26.已知:(1)向氯化铝溶液中滴加氢氧化钠溶液,有白色沉淀[A1(OH)3]生成。当继续滴加氢氧化钠溶液时,白色沉淀逐渐减少,直至消失,生成一种可溶性盐。此反应的化学方程式是:A1(OH)3+NaOH——NaAlO3(偏铝酸钠)+2H2O
(2)氢氧化铁固体不溶于氢氧化钠溶液。
现欲除去氯化铁溶液中混有的少量氯化铝杂质,得到较为纯净的氯化铁溶液,某同学设计了如下提纯方案:
试回答:(1)B溶液的名称是 .
(2)滤液中的溶质有 、 、 。(填化学式)
27.锶(元素符号Sr)的化学性质与钙相似。用同一浓度的稀盐酸分别溶解相同质量的SrO和Fe2O3,当依次滴入稀盐酸体积比约为1:2时,两种氧化物都恰好完全反应。则可断定SrO和Fe2O3相对分子质量之比约是 。
三、简箐题(本题共4小题,共16分)
28.氨气是生产铵态氮肥的主要原料,但一经泄漏,危害十分严重。请根据下列相关报导,回答问题:
某地一冷饮厂氨气泄漏,液氨冲破管道,喷射而出。当时,空气中弥漫着一股浓烈的刺激性气味,现场温度骤降到—30℃。抢险队员紧急中用柠檬水淋湿全身后冲进泄漏仓库堵泄,虽堵泄成功但抢险队员被冻伤。已泄漏的500Kg液氨经喷水12t后才将其稀释。这次事件造成百余人氨气中毒,距离事发地点5米的树木在短短半小时内叶子由绿色变成黄色。
(1)从以上报导获得的信息中,你了解到氨气有哪些性质?(至少写出3条)
(2)抢险队员用柠檬水淋湿全身的可能原因是什么?
(3)请解释接触液氨可能引起严重冻伤的原因。
29.某块农田里的农作物的植株矮小瘦弱,叶片发黄、茎杆软弱,容易倒伏,叶片的边缘和 尖端呈褐色并逐渐焦枯。根据以上特点,化学课外活动小组的成员经过分析讨论后,判断该农田缺少氮元素和钾元素。为了补充这两种元素,农民决定将碳铵和草木灰混合使用。请回答:
农民施用肥料的方法是否合理,为什么?
30.某同学在家中发现一种缓泻药——“果导片”,药品说明书中标明其主要成分是酚酞。该同学想知道它能否作为酚酞指示剂的代用品。他将果导片研成粉末加入消毒用酒精(酚酞不易溶于水,溶于酒精)中搅拌、静置。取上层清液滴人到澄清石灰水中,观察到 ;滴入到醋酸及食盐水中观察到 ,从而得出“果导片”可作酚酞指示剂代用品的结论。然后他又用饮料吸管缓缓向滴有“果导片”溶液的澄清石灰水中吹气,请问他观察到什么现象,为什么?
31.液化石油气和煤气燃烧的主要反应分别为 ,燃气灶是由灶体、进气管、电子开关等部件组成。目前管道煤气的用户迅速增加,根据以上分析,使用石油液化气的用户,在使用管道煤气后,重新购置的灶具与原来的灶具相比构造部件上最大的区别是什么?为什么?(提示:同温同压,相同体积的气体具有相同分子数。)
四、实验题(本题共2小题,共12分)
32.将一定量的铁粉加入到的Cu(NO3)2、AgNO3混合溶液中,充分反应后过滤,则滤出固体的组成最多有 种情况。请你设计实验对滤出固体中组成最复杂的情况进行验证,填写下列实验报告。
33.现有足量的稀硫酸、1.3g锌片、无水硫酸铜、氧化铜和水,请从下图中选择适当仪器,设计一个简单的实验,粗略测定锌的相对原子质量。(设环境为标准状况,标准状况下氢气的密度为0.08928g/L)
(1)应选用的装置是 。(填写装置代号)
(2)所用装置的连接顺序是 。(填写各接口的字母序号)
(3)如果实验中测得量筒中水的体积为450ml,请计算锌的相对原子质量 。
五、计算题(本题共2小题,共8分)
34.为研究某一镁铝合金的成分,进行甲、乙、丙三组实验。三组各取30ml同浓度的盐酸溶液,加入该种镁铝合金粉末。每组实验加入合金质量和产生气体质量的有关数据如下:
请根据袭中数据判断和计算:
(1)甲组实验中,盐酸 (填“过量""适量”或“不足量”),乙组实验中,盐酸 (填“过量”“适量”或“不足量”)。
(2)合金中镁、铝的质量比 。
35.某钙片的标签如右图所示,此钙片成分中只有碳酸钙含有钙元素。
(1)请通过计算说明此标签中的含钙量是否错误。
(2>为测定这种钙片含钙量,小东每次取10片钙片放入已称量的盛有足量盐酸的烧杯中,发生的化学反应是:CaCO3+2HCl=CaCl2+H2O+CO2↑
,充分反应后再称量烧杯和剩余物的总质量。小东做了三次实验,数据如下:
①请计算每片此钙片含碳酸钙的质量。
②你认为应该建议厂家如何更改标签?
2007年全国初中化学竞赛黑龙江省赛区初赛
参考答案和评分标准
一、选择题 (本题共20小题,每小题2分,共40分。1-15题每题各有一个正确选项,16-20题每题各有一个或两个正确选项。 双选题选对一个给1分,出项错误选项不给分。)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
B
C
D
A
B
B
A
C
A
C
C
A
C
C
B
题号
16
17
18
19
20
答案
C D
A C
B D
B D
B
二、填空题(共24分)
21.HNO3 , Ba(OH)2 ,Ba(NO3)2 (3分)
22.4(1分); 16(1分)。
23.(1)盐酸; 氯化铜; (2分)
(2)硫酸(1分);开始加入氢氧化钡溶液时没有产生沉淀(1分);
碳酸钠(1分);盐酸与碳酸钠溶液会发生化学反应,二者不能共存(1分)。
24.8NH3 + 6NO2 ==== 7N2 +12H2O (2分,其中配平化学方程式1分)
CaH2 + 2H2O ===== Ca(OH)2 + 2H2↑ (1分)
25.(1)O2(1分);11.18g(1分)
(2)因为通过计算得出氯化钾的质量为11.18g,大于10.8g(1分)。
(3) 7.8 g < a ≤ 12.83 g (2分)
26.(1)盐酸(1分);
(2)NaOH; NaAlO2; NaCl;(3分)
27.2:3(1分)
三、简答题 ( 本题共4小题,共16分 )
28.(4分)
(1)氨气有刺激性气味,易溶于水,有毒性。(1分)
(2)氨气溶于水呈碱性,柠檬水呈酸性,二者发生中和反应,减少氨对抢险队员的伤害(2分)。
(3)液氨汽化时会吸收大量的热,使温度降低。(1分)
29.(4分)
不合理(1分)。
草木灰的主要成分是碳酸钾,碳酸钾溶于水呈碱性(1分),能与碳铵发生化学反应释放出氨气(1分),降低肥效(1分)。
30.(5分)
溶液呈红色(1分);无明显变化(1分);出现白色沉淀,溶液红色消失(1分);
二氧化碳与石灰水中的氢氧化钙反应生成难溶于水的碳酸钙,所以出现白色沉淀(1分);反应使溶液的碱性明显降低,溶液红色褪去(1分)。
31.(3分)
区别进气管的管口比原来大(1分)。
因为由两种气体燃烧的化学方程式可知,等体积的液化石油气和煤气燃烧消耗的氧气体积相比,煤气消耗的氧气更少(1分)。在煤气灶周围氧气量相同的情况下,煤气燃烧量更大,所以煤气炉具的进气管管口更大。(1分)
四、实验题(本题包括2小题,共12分)
32.三种(1分)
实验报告:(6分)
猜 测
实验内容
实验现象
结论及化学方程式
铁、铜、银的混合物
(1分)
向滤出的固体中加入稀硫酸
(1分)
固体部分溶解,同时有气泡产生,溶液变为浅绿色。
(1分)
加入稀硫酸有气体产生,说明固体中含有铁(1分)。固体中含有铁说明银离子、铜离子被全部置换出来,即固体中还含有铜和银(1分)。则固体为铁、铜、银的混合固体。
Fe + H2SO4 = FeSO4+H2↑(1分)
33.(1)③④⑥ (1分)
(2)G → F → E→ I(1分)
(3) (3分)
解:由题意知氢气的质量为450÷1000L×0.08928g/L=0.04g(1分)
设锌的相对原子质量为 x
Zn + H2SO4 = Zn SO4 + H2↑ (1分)
x 2
1.3g 0.04g
x
2
=
1.3g
0.04g
解得,x = 65 (1分)
五、计算题(本题共2小题,共8分)
34.(1)过量(1分);不足量(1分);
(2)8:9(2分)
×40% = 0.32g
40 g
50
35.解:(1)本品若为纯碳酸钙,其含钙量为
每片含钙量为: , (1分)
因此本品每片不可能含钙0.75g。
(2)①设10片钙片含碳酸钙的质量为 x
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑ (1分)
100 44
x (22+8-26.7)g
100
44
=
x
3.3g
解得,x = 7.5g ,因此每片此钙片含碳酸钙 0.75g (1分)
②每片此钙片的含钙量 = 0.75g×40% = 0.3g
建议厂家将含钙量:“每片含钙0.75g”改为“每片含钙0.3g” (1分)