- 4.54 MB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第十单元 酸和碱
课题
1
常见的酸和碱
课题
2
酸和碱的中和反应
实验活动
6
酸、碱的化学性质
实验活动
7
溶液酸碱性的检验
课题
1
常见的酸和碱
(
第一课时
)
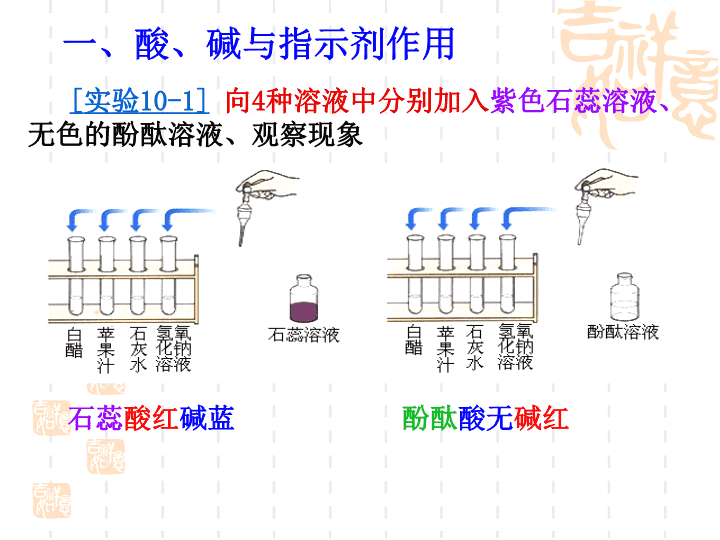
[
实验
10-1]
向
4
种溶液中分别加入
紫色石蕊溶液、
无色的酚酞溶液、观察现象
一、酸、碱与指示剂作用
石蕊
酸红
碱蓝
酚酞
酸无
碱红
课 题
1
常 见 的 酸 和 碱
[
实验
10-1]
加入紫色石蕊溶液后的
颜色变化
加入无色酚酞溶液后的
颜色变化
白 醋
苹果汁
石灰水
NaOH
溶液
变红色
变蓝色
变红色
变红色
变红色
变蓝色
不变色
不变色
结论:
1
、
酸能
使
紫色石蕊
溶液变成
红色
,
碱
能使无色的酚酞溶液变成
蓝色
(即
石蕊
酸红
碱蓝
)
2
、酸不能使无色酚酞溶液变色
,
碱溶液使无色的酚酞溶液
变红色
(即
酚酞
酸无
碱
红
)
酸碱指示剂
遇
酸性
溶液呈现颜色
遇
中性
溶液呈现颜色
遇
碱性
溶液呈现颜色
紫色
石蕊
溶液
红色
紫色
蓝色
无色
酚酞
溶液
无色
无色
红色
酸碱指示剂与酸中碱性溶液作用时显示的颜色:
酸性
溶液
酸
溶液
盐
溶液
碱性
溶液
碱
溶液
盐
溶液
课 题
1
常 见 的 酸 和 碱
1
、酸碱指示剂(指示剂)的概念
跟酸或碱的溶液起作用而显示
不同颜色
的物质。
2
、常用指示剂:
紫色石蕊溶液
和无色酚酞溶液
3
、变色规律
:
酸能使
紫色石蕊溶液
变成
红色
,不能使
无色酚酞溶液变色;碱能使
紫色石蕊溶液
变成
蓝色,使
无色酚酞溶液溶液变成
红色
(即
石蕊
酸红
碱蓝、
酚酞
酸无
碱红
)
4
、指示剂的作用
:
能检验溶液的酸碱性
5
、如何用酸碱指示剂检验溶液的酸碱性?
若溶液呈现
红色
,则说明该溶液为
酸性
溶液。
取少量该溶液,
滴入几滴
紫色石蕊溶液
若溶液呈现
蓝色
,则说明该溶液为
碱性
溶液。
自制指示剂原料
月季花
牵牛花
紫萝卜
美人焦
胡萝卜
紫包菜
自制酸碱指示剂
课 题
1
常 见 的 酸 和 碱
二、常见的酸
1
、几种常见的酸
[
实验
10-2]
(
1
)观察盐酸、硫酸的颜色和状态
(
2
)分别打开盛有盐酸、硫酸的试剂瓶的瓶盖,观察现象并闻气味。
盐酸
(HCl)
硫酸
(H
2
SO
4
)
颜色状态
打开瓶盖后的现象
气味
密度
常用浓盐酸
1.19g
/
cm
3
常用浓硫酸
1.84g
/
cm
3
无色液体
无色粘稠油状液体
瓶口有
白雾
无明显现象
有刺激性气味
无味
2.
用 途
(
P52
)
盐 酸
HCl
重要化工产品。用于金属表面
除锈
、
制造药物
(如盐酸麻黄素、氯化锌)等;
人体胃液中
有
盐酸
,可
帮助消化
。
硫 酸
H
2
SO
4
重要
化工原料
。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和
金属除锈
等。
浓硫酸有吸水性
,在实验室中常用它
做
干燥剂
。
浓硫酸不能干燥碱性气体
氨气
(
NH
3
)
课 题
1
常 见 的 酸 和 碱
2
、浓硫酸的腐蚀性
[
实验
10-3]
将纸、小木棍、布放在
玻璃片上
做实验。
实 验
放置一会儿后的现象
原 理
用玻璃棒蘸浓硫酸在纸上写字
用小木棍蘸
少量浓硫酸
将浓硫酸滴到
一小块布上
纸上显出
黑色
字迹
蘸有硫酸的部位
变黑
滴有硫酸的部位
变黑
甚至烧成洞
浓硫酸有
强烈的腐蚀性,
能夺取含碳、氢、氧等元素组成的化合物里的水分
(
氢、氧元素
),
生成黑色的炭。
浓盐酸
浓硫酸
↑
↓
稀释浓硫酸的方法
:
[
实验
10-4]
将浓硫酸沿烧杯壁缓慢地注入盛有水的 烧杯里,用玻璃棒不断搅动,并用手接触烧杯外壁。
事故处理:
(P53)
如果浓硫酸沾到皮肤或衣服上,应该怎么办?
立即用
大量水冲洗
,然后涂上
3%
~
5%
的
碳酸氢钠溶液
。
手的感觉
原因
发热或烫
浓硫酸溶于水 放出大量的热
散热
课 题
1
常 见 的 酸 和 碱
[
实验
]
将水注入到浓硫酸中
硫酸液滴向四周飞溅
再见
!
课 题
1
常 见 的 酸 和 碱
课题
1
常见的酸和碱
(第二课时)
物质导电性
结论:不同的酸、碱却具有
相似
的
化学性质
的
原因
?(
P57
)
1.
在不同的
酸溶液
中都含有相同的
H
+
,因此
不同的
酸的化学性质是
相似
的。
2.
在不同的
碱溶液
中都含有相同的
OH
-
,所以不同的碱也具有
相似
的化学性质。
3
、酸的化学性质
探究
(
1
) 酸溶液能与指示剂反应:
滴加紫色
石蕊溶液
滴加无色
酚酞溶液
稀盐酸
稀硫酸
变红色
变红色
不变色
不变色
结论
:
酸能使
紫色石蕊溶液
变成红色,不能使
无色
酚酞溶液
变色。
(
2
)酸溶液能与
活泼
金属反应(
请回忆第八单元并填表
)
与稀盐酸反应
与稀硫酸反应
镁
锌
铁
Mg+2HCl=MgCl
2
+
H
2
↑
Zn+2HCl=ZnCl
2
+
H
2
↑
Fe+2HCl=
FeCl
2
+
H
2
↑
Mg+H
2
SO
4
=MgSO
4
+
H
2
↑
Zn+H
2
SO
4
=ZnSO
4
+
H
2
↑
Fe+H
2
SO
4
=
FeSO
4
+
H
2
↑
讨论:上面反应的生成物有什么共同之处?
生成物都是
盐
和
氢气
结论
:
酸
+
活泼金属 → 盐
+
氢气
(置换反应)
(
3
)酸溶液能与金属氧化物反应
:
现 象
化学方程式
铁锈
+
盐酸
铁锈
+
硫酸
铁锈
消失
, 溶液由无色 变为
黄色
Fe
2
O
3
+ 6HCl
= 2
FeCl
3
+3H
2
O
Fe
2
O
3
+3H
2
SO
4
=
Fe
2
(SO
4
)
3
+3H
2
O
讨论:①
上面反应的生成物有什么共同之处?
生成物都是
盐
和
水
②
利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么?
不能。因为酸会与
金属
继续反应, 金属制品
被腐蚀
。
酸
+
金属氧化物→盐
+
水
(复分解反应)
引申
氧化铜也可以与这两种酸发生化学反应,写出方程式
CuO+H
2
SO
4
=
CuSO
4
+H
2
O
CuO+2HCl=
CuCl
2
+H
2
O
现象:黑色粉末逐渐
溶解
,溶液由无色逐渐变为
蓝色
(
4
)根据以上实验和讨论,试归纳出盐酸、硫酸等酸有哪些
相似
的
化学性质
。
①
酸能使酸碱
指示剂
显示不同的颜色;
②
酸能与多种
活泼金属
反应,生成氢气;
③
酸能与某些
金属氧化物
反应,生成水。
练习:
向放有铁锈的钉子的试管中加入
过量
盐酸
,
充分 反应后
,
铁锈消失
,
并有
气泡
产生
,
写出有关反应的化学方程式
:__________________________
、
_____________________________ .
Fe
2
O
3
+ 6HCl = 2FeCl
3
+ 3H
2
O
Fe + 2HCl = FeCl
2
+ H
2
↑
④
酸能与
碱
反应:
NaOH + HCl = NaCl + H
2
O
2
NaOH + H
2
SO
4
= Na
2
SO
4
+ 2H
2
O
Al(OH)
3
+
3
HCl =
Al
Cl
3
+
3
H
2
O
酸
+
碱 → 盐
+
水
2
Al(OH)
3
+
3
H
2
SO
4
=
Al
2
(SO
4
)
3
+
6
H
2
O
(复分解反应)
实验
1
:稀盐酸和硝酸银溶液反应
HCl+AgNO
3
=
AgCl↓
+HNO
3
(白色沉淀)
实验
2
:稀硫酸和氯化钡溶液反应
H
2
SO
4
+BaCl
2
=
BaSO
4
↓
+2HCl
(白色沉淀)
注意:
AgCl
、
BaSO
4
不溶于水,也不溶于酸。
⑤
酸跟某些
盐
发生的反应
酸
+
盐→ 新盐
+
新酸
(复分解反应)
1
、酸能使酸碱指示剂显示不同的颜色;
2
、酸能与多种活泼金属反应,生成盐和氢气;
3
、酸能与某些金属氧化物反应,生成盐和水。
4
、酸能与碱反应生成盐和水
预习常见的碱
学完本课题你应该知道
酸的化学性质
5
、酸能与某些盐反应生成新盐和新酸
【
小结
】
1
、
跟
指示剂
反应
2
、
跟
活泼金属
反应
3
、
跟
金属氧化物
反应
4
、
跟
碱
反应
5
、
跟某些
盐
反应
石蕊试液遇酸变成
红色
,酚酞试液遇酸
不变色
。
酸
+
金属
==
盐
+
氢气↑
Fe
2
O
3
+6HCl= 2FeCl
3
+3H
2
O
金属氧化物
+
酸
==
盐
+
水
Na
OH+HCl= NaCl+H
2
O
酸
+
碱
==
盐
+
水
酸的化学性质
再见
!
课 题
1
常 见 的 酸 和 碱
课题
1
常见的酸和碱
(
第三课时
)
氢氧化钠:
氢氧化钾:
氢氧化钙:
氢氧化钡:
氨水:
四强碱
NaOH
KOH
Ca(OH)
2
Ba(OH)
2
NH
3
·
H
2
O
实验
10—5
氢氧化钠
NaOH
实验
现象
分析
观察氢氧化钠的颜色、状态
将氢氧化钠放置于表面皿上,放置一会儿
将氢氧化钠放入盛有少量水的试管里,并用手
触碰试管外壁
白色固体
表面潮湿并逐渐溶解
容易吸收水分
发热
NaOH
溶于水 放出热量
。
用镊子夹取
3
小块氢氧化钠分别进行实验(切勿用手拿)
实验
10—6
取一药匙氢氧化钙,观察它的颜色和状态,然后放入小烧杯中,加入约
30mL
水,搅拌,观察氢氧化钙在水中的溶解情况。然后向上层澄清的溶液中通入二氧化碳,
现 象
颜色、状态
在水中的溶解情况
向澄清溶液中通入
CO
2
白色粉末状固体
没有完全溶解
,
呈浑浊状态
产生白色浑浊
氢氧化钙
[
Ca(OH)
2
]
CaO + H
2
O Ca(OH)
2
生石灰
与水反应得到
氢氧化钙
。
生石灰
CaO
现象:
放出大量的热
熟石灰
Ca(OH)
2
溶解性顺口溜 (
P114
)
钾钠铵硝酸(盐)溶
盐酸(盐)不溶
AgCl
硫酸(盐)不溶
BaSO
4
碳酸(盐)只溶钾钠铵
溶碱只有氨钠钙钾钡
氨水:
NH
3
·
H
2
O
氢氧化钠:
NaOH
氢氧化钙:
Ca(OH)
2
氢氧化钾:
KOH
氢氧化钡:
Ba(OH)
2
再见
!
课 题
1
常 见 的 酸 和 碱
课题
1
常见的酸和碱
(
第四课时
)
1.
碱
与
指示剂
反应
碱溶液
能
使
紫色石蕊
溶液变
蓝色
,
使
无色酚酞
溶液变
红色
。不溶于水的碱
不能
使指示剂变色。
2.
碱
与某些
非金属氧化物
反应
碱
的化学性质
2NaOH + CO
2
= Na
2
CO
3
+ H
2
O
Ca(OH)
2
+CO
2
=CaCO
3
↓
+H
2
O
氢氧化钠必须
密封
保存
? (P56)
(
检验
CO
2
)
(
除去
CO
2
)
(
氢氧化钠变质原理
)
CO
2
和
NaOH
反应,无明显现象,如何证明发生了反应呢?
NaOH
溶液
2NaOH +
SO
2
=
Na
2
SO
3
+ H
2
O
2NaOH + SO
3
= Na
2
SO
4
+ H
2
O
Ca(OH)
2
+
SO
2
=
CaSO
3
↓
+H
2
O
Ca(OH)
2
+SO
3
=CaSO
4
+H
2
O
碱
+
非金属氧化物 → 盐
+
水
(化合价不变,不属于任何基本反应类型)
2NaOH + CO
2
= Na
2
CO
3
+ H
2
O
Ca(OH)
2
+CO
2
=CaCO
3
↓
+H
2
O
3.
碱跟
酸
反应
:
酸
+
碱 → 盐
+
水
(复分解反应)
KOH + HCl == KCl +H
2
O
4.
碱
跟某些
盐
反应
:
碱
+
盐→ 新碱
+
新盐
(复分解反应)
CuSO
4
+2NaOH ==
Cu(OH)
2
↓
+Na
2
SO
4
FeCl
3
+
3NaOH ==
Fe(OH)
3
↓
+3NaCl
蓝色沉淀
红褐色沉淀
碱与盐
反应的条件
反应物
:都可溶
生成物
:有沉淀、气体或水
Na
2
CO
3
+Ca(OH)
2
== CaCO
3
↓
+2NaOH
白色沉淀
酸碱溶液中的粒子
酸溶液为什么具有一些相似的化学性质
?
碱溶液为什么也具有一些相似的化学性质
?
物质
盐酸
硫酸
NaOH
溶液
Ca(OH)
2
溶液
蒸馏水
乙醇
导电性
酸溶液、碱溶液为什么能导电?
而蒸馏水、乙醇为什么不导电?
×
×
酸碱溶液中的粒子
分子
不能自由
移动的离子
能
自由移动
的
离子
酸
H
+
+
酸根离子
在水溶液中
解 离
碱 金属离子
+
OH
—
在水溶液中
解 离
HCl H
+
+ Cl
—
Ca(OH)
2
Ca
2+
+ 2OH
—
在不同的
酸溶液
中都含有相同的
H
+
,所以,酸有一些
相似
的性质。
在不同的
碱溶液
中都含有相同的
OH
—
,所以碱也有一些
相似
的性质。
碱的化学性质
1.
碱溶液
能与
酸碱指示剂
反应
,
碱溶液
能使紫色石蕊试液变蓝,无色酚酞试液变红。
2.
碱溶液
能和
某些
非金属氧化物
反应,生成盐和水。
3.
碱
能和
酸
反应,生成盐和水。
4.
碱溶液
能和
某些
盐
溶液
反应,生成新碱和新盐。
1
、
下列气体中,既能用固体
NaOH
干燥又能用浓
H
2
SO
4
干燥的是( )
A.
CO
2
B.
HCl
C.
SO
2
D.
O
2
D
【
解析
】
干燥原理:
干燥剂只吸收水分,但不能与与被干燥的气体发生反应。
CO
2
、
SO
2
、
HCl
都能与
NaOH
反应,故三者均不能用
NaOH
来干燥,而
O
2
既不能与
NaOH
反应,也不能与浓
H
2
SO
4
反应,故用浓
H
2
SO
4
、
NaOH
干燥都可以。
2
、
若将潮湿的空气依次通过烧碱溶液、浓硫酸和红热的铜网,将会依次除去空气中的
_____
、
________
、和
________
,最后剩余的气体主要是
_______
。
CO
2
水蒸气
O
2
N
2
3
、
将混有少量氧化铜的铁粉,加入到盛有稀硫酸的烧杯中,充分反应,有部分铁剩余,过滤后,滤液中含有的溶质是( )
A.
H
2
SO
4
B.
FeSO
4
C.
FeSO
4
和
CuSO
4
D.
H
2
SO
4
和
FeSO
4
B
4.
下列物质中,不用密封保存的是( )
A.
浓硫酸
B.
氯化钠固体
C.
浓盐酸
D.
烧碱固体
5.
氢氧化钠是
____
色的
______
固体,
_________
于水。它露置在空气中,表面会发生潮解,这是因为它
______________________
的缘故。同时它还能与空气中的
_______
发生反应,其化学方程式为
_______________________
,从而使氢氧化钠变质;因此,氢氧化钠固体必须
__________
保存;而它的水溶液也必须
_________
保存。
B
白
片状
易溶解
吸收了空气中的水分
CO
2
2NaOH+CO
2
==Na
2
CO
3
+H
2
O
密封
密封
7.
盛放在敞口瓶内的下列物质长期暴露在空气中,瓶内物质的质量会减少的是( )
A.
食醋
B.
生石灰
C.
食盐
D.
烧碱固体
6.
在某些食品的包装内,有一个装有白色颗粒固体的小纸袋,上面写着
“
干燥剂,主要成分为生石灰
”
。为什么生石灰能做干燥剂?如果将小纸袋拿出来放在空气中,经过一段时间后,会发现纸袋内的白色颗粒粘在一起成为块状。这是为什么?试写出有关反应的化学方程式。
CaO + H
2
O == Ca
(
OH
)
2
Ca
(
OH
)
2
+ CO
2
== CaCO
3
↓ + H
2
O
A
8.
将
2.8g
生石灰放入
47.4g
水中,充分反应,所得溶液中溶质的质量分数是( )
A.5.6% B. 7.4% C.10% D.
小于
1%
D
分析:
本题属条件隐蔽型的习题
,
在解题时应注重审题,挖掘出隐含条件。其隐含条件是: (
1
)生石灰与水反应生成氢氧化钙,即溶质为氢氧化钙。(
2
)氢氧化钙微溶于水。因此选
D
。
9.
下列氧化物中,通常情况下既不与酸反应,又不与碱反应的是( )
A.CO
2
B.CO C.CaO D.CuO
B
10.
如图所示,向小试管内加入浓
H
2
SO
4
会使下图
U
型管的左边液面
_____
,右边液
_____
,其原因是
______________________________________________
。你还能另外再选择两种同样作用的物质吗?(
1
)
__________
,(
2
)
__________
。
下降
上升
浓
H
2
SO
4
溶于水放出大量的热,使瓶内压强增大
NaOH
CaO
自制的叶脉书签
再见
!