- 6.41 MB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
化学人教九年级下第九单元 溶液单元检测
(时间:45 分钟 满分:100 分)
一、快乐点击(每小题 3 分,共 30 分)
1.洗衣机减轻了人们的劳动强度。下列说法中正确的是( )。
A.洗涤剂加水稀释后溶质的质量分数变大
B.洗涤后衣服上一定没有残留洗涤剂
C.洗涤后排出的液体一定是溶液
D.洗涤时适当提高水温能加快洗衣粉的溶解
2.为了测定在一定温度时某物质的溶解度,待测液必须是该温度下该物质的( )。
A.浓溶液 B.稀溶液 C.不饱和溶液 D.饱和溶液
3.下列关于生理盐水的说法中,错误的是( )。
A.生理盐水的溶剂是水
B.各部分一样咸,体现了溶液成分的均一性
C.医用生理盐水可以为人体补充无机盐
D.水分子是保持 NaCl 性质的最小微粒
4.25 ℃向氯化钠饱和溶液中加入一定量的水后,下列有关该溶液的叙述正确的是
( )。
A.仍为饱和溶液 B.溶质的溶解度不变
C.溶液的质量不变 D.溶质的质量分数不变
5.配制 100 g 溶质的质量分数为 10%的氯化钠溶液,下列操作中正确的是( )。
A.将 10 g 氯化钠固体直接放在天平的托盘上称量
B.量取 90 mL 水时,俯视读数
C.为加快固体溶解,用温度计搅拌溶液
D.将配好的溶液倒入细口瓶中,盖紧瓶塞,并贴上标签
6.小明用 50 ℃的水泡了一杯蔗糖水,充 分搅拌后,发现杯子底部还有部分蔗糖不能
溶解。已知蔗糖的溶解度随温度的升高而增大。下列能使杯底的蔗糖继续溶解的方法是
( )。
A.把蔗糖水放入冰箱 B.给蔗糖水加热
C.往蔗糖水里继续加蔗糖 D.把蔗糖水放在通风处
7.下列有关溶液及其性质的说法错误的是( )。
A.海水的凝固点比水低
B.溶液和浊液特征的不同主要与物质分散在液体中的颗粒大小有关
C.一定温度下,物质的溶解度随水的量的变化而变化
D.食盐水能导电是因为食盐水中含有较多自由移动的离子
8.常温下,将盛有饱和硝酸钾溶液的试管插入盛有冰水混合物的烧杯中,如下图所示。
下列说法正确的是( )。
A.试管内溶液中溶质的质量不变 B.试管内溶液的总质量不变
C.试管内溶液变为不饱和溶液 D.试管内水的质量不变
2
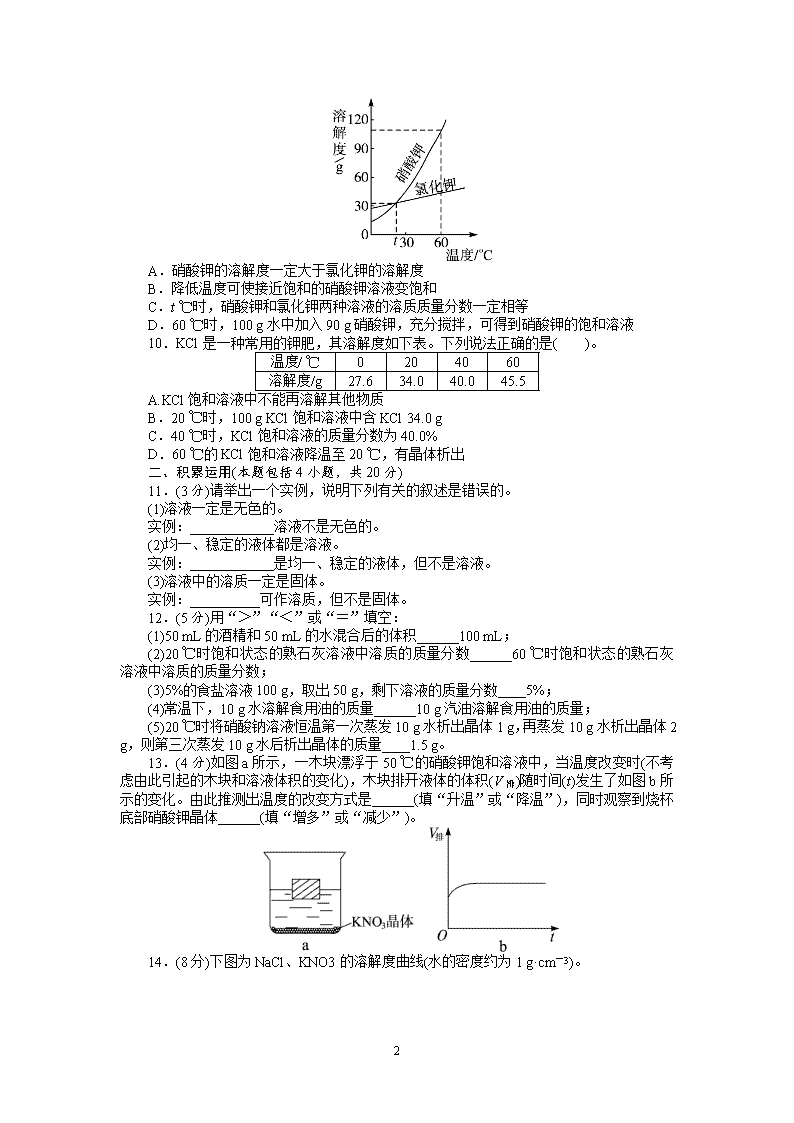
9.硝酸钾和氯化钾的溶解度曲线如图所示,下列叙述正确的是( )。
A.硝酸钾的溶解度一定大于氯化钾的溶解度
B.降低温度可使接近饱和的硝酸钾溶液变饱和
C.t ℃时,硝酸钾和氯化钾两种溶液的溶质质量分数一定相等
D.60 ℃时,100 g 水中加入 90 g 硝酸钾,充分搅拌,可得到硝酸钾的饱和溶液
10.KCl 是一种常用的钾肥,其溶解度如下表。下列说法正确的是( )。
温度/ ℃ 0 20 40 60
溶解度/g 27.6 34.0 40.0 45.5
A.KCl 饱和溶液中不能再溶解其他物质
B.20 ℃时,100 g KCl 饱和溶液中含 KCl 34.0 g
C.40 ℃时,KCl 饱和溶液的质量分数为 40.0%
D.60 ℃的 KCl 饱和溶液降温至 20 ℃,有晶体析出
二、积累运用(本题包括 4 小题,共 20 分)
11.(3 分)请举出一个实例,说明下列有关的叙述是错误的。
(1)溶液一定是无色的。
实例:____________溶液不是无色的。
(2)均一、稳定的液体都是溶液。
实例:____________是均一、稳定的液体,但不是溶液。
(3)溶液中的溶质一定是固体。
实例:__________可作溶质,但不是固体。
12.(5 分)用“>”“<”或“=”填空:
(1)50 mL 的酒精和 50 mL 的水混合后的体积______100 mL;
(2)20 ℃时饱和状态的熟石灰溶液中溶质的质量分数______60 ℃时饱和状态的熟石灰
溶液中溶质的质量分数;
(3)5%的食盐溶液 100 g,取出 50 g,剩下溶液的质量分数____5%;
(4)常温下,10 g 水溶解食用油的质量______10 g 汽油溶解食用油的质量;
(5)20 ℃时将硝酸钠溶液恒温第一次蒸发 10 g 水析出晶体 1 g,再蒸发 10 g 水析出晶体
2 g,则第三次蒸发 10 g 水后析出晶体的质量____1.5 g。
13.(4 分)如图 a 所示,一木块漂浮于 50 ℃的硝酸钾饱和溶液中,当温度改变时(不考
虑由此引起的木块和溶液体积的变化),木块排开液体的体积(V 排)随时间(t)发生了如图 b 所
示的变化。由此推测出温度的改变方式是______(填“升温”或“降温”),同时观察到烧杯
底部硝酸钾晶体______(填“增多”或“减少”)。
14.(8 分)下图为 NaCl、KNO3 的溶解度曲线(水的密度约为 1 g·cm-3)。
3
(1)20 ℃时,KNO3 的溶解度是______g,以下实验中:
10 mL 水 x y z
x、y、z 中为饱和溶液的是__________。
(2)若使 NaCl 溶液由不饱 和变为饱和溶液,一般采用的方法是________________或
____________________________。
(3)除去 KNO3 固体中混有的少量 NaCl,提纯的步骤是:加水溶解、______、________,
然后过滤、洗涤、干燥。
三、情景分析(本题包括 2 小题,共 18 分)
15.(12 分)2011 年初,我国南方部分地区再次遭受特大冰雪灾害。灾情发生后,各级
政府纷纷启动应急预案,全力开展抗灾救灾工作。为了疏通交通,环卫工人采用了在交通要
道上铺撒“氯盐融雪剂”的方法。为了解“氯盐融雪剂”融雪的原理,小红同学查阅到以下
资料。请根据材料回答下列问题:
材料一:“氯盐融雪剂”一般是由氯化钠、氯化钾、氯化镁等物质中的一种或多种组成。
材料二:在通常情况下,纯水的冰点为 0 ℃;20%的氯化钠溶液的冰点为-10 ℃;35%
的氯化钠溶液的冰点是-19 ℃。
(1)铺撒“融雪剂”可快速融雪的原因是____________________________;空气中的液
态水变成雪花,其分子间间隔变________。
(2)“氯盐融雪剂”溶液中溶质的质量分数与融雪效果的关系为______________。
16.(6 分)下面是利用海水提取食盐的过程:
(1)根据所学知识推断:上图中①是__________池(填“蒸发”或“冷却”)。
(2)下列分析正确的是(填序号)________。
A.海水进入贮水池,氯化钠的质量分数基本不变
B.在①的溶液中氯化钠的质量分数不改变
C.在①的溶液中氯化钠的质量减少了
D.析出晶体后的母液是食盐的不饱和溶液
E.海洋中蕴藏着丰富的资源
四、实验探究(本题包括 1 小题,21 分)
17.以下是某化学兴趣小组实施的从硝酸钾、氯化钠、氯化钾的混合物(其中氯化钠和
氯化钾的质量和小于总质量的 3%)中分离出硝酸钾的实验步骤:(三种物质的溶解度曲线见
下图)
4
Ⅰ.用托盘天平称得样品的总质量为 87.5 g;
Ⅱ.配制成 80 ℃左右的饱和溶液;
Ⅲ.将热饱和溶液冷却至室温(20 ℃)后进行过滤,并用少量水洗涤 2~3 次;
Ⅳ.取出过滤器中的固体,干燥后分装。
请回答以下问题:
(1)用天平称取 87.5 g 样品时,砝码应放在天平的______盘。
(2)某同学发现,无论将称量物还是砝码放置于托盘上,天平均不发生偏转,原因是
______。
A.天平未放置于水平桌面上 B.天平没有调零
C.托盘下的垫圈未取下 D.游码未归零
(3)将这些样品制成 80 ℃左右的热饱和溶液,约需______水(填序号)。
A.12.5 mL B.50 mL C.100 mL D.112.5 mL
(4)该实验中,玻璃棒除了用于搅拌和引流外,还用于______________。
(5)步骤Ⅲ中,只能用少量水洗涤固体的原因是_______________________________
________________________________________________________________________。
(6)过滤并洗涤后,氯化钾存在于______中。
(7)如果实验中热饱和溶液未完全冷却至室温就进行过滤将会影响晶体的产量,理由是
________________________________________________________________________。
五、计算应用(本题包括 1 小题,11 分)
18.2011 年 3 月 11 日,日本发生 8.6 级地震,震中位于日本本州岛仙台港东,震源深
度约 24 千米,东京有强烈震感,地震引发海啸。为了防止灾后疫情的发生,在震区需要喷
洒大量的消毒液。
(1)800 kg 质量分数为 0.5%的过氧乙酸消毒液中,过氧乙酸的质量为________ kg。
(2)要配制 800 kg 质量分数为 0.5%的过氧乙酸消毒液,需质量分数为 16%的过氧乙酸溶
液的质量是多少?
5
参考答案
1. 答案:D
2. 答案:D
3. 答案:D
4. 解析:
答案:B
5. 答案:D
6. 解析:本题实质是考查饱和溶液与不饱和溶液的转化,由于蔗糖的溶解度随温度的
升高而增大,要使蔗糖继续溶解,可采用加溶剂或升高温度的方法,故 B 选项正确。
答案:B
7. 解析:海水中溶解的盐类物质使水的凝固点降低,A 正确;溶液中溶质以分子或离
子的形式分散,而浊液中分散在液体中的物质颗粒较大,B 正确;在溶解度的 概念中,溶
剂的标准是 100 g,是一个定值,C 错误;食盐水中含有自由移动的离子,通电时,这些离
子定向移动形成电流,这是食盐水导电的原因,D 正确。
答案:C
8. 解析:降低温度,饱和硝酸钾溶液中会有硝酸钾晶体析出,溶液中溶质的质量会减
少,因此溶液的质量会减少,但溶剂的质量不变;由于所得溶液底部有未溶解的硝酸钾,故
溶液仍饱和。
答案:D
9. 解析:比较两种物质的溶解度一定要指明温度,A 错;硝酸钾的溶解度随温度的降
低而减小,故降低温度可使接近饱和的硝酸钾溶液变饱和,B 对;t ℃时,硝酸钾和氯化钾
的溶解度相等,其饱和溶液的溶质质量分数一定相等,不饱和溶液不能确定,C 错;从图中
看出,硝酸钾的溶解度大于 90 g,故该温度下 100 g 水中加入 90 g 硝酸钾达不到饱和,D 错。
答案:B
10. 解析:KCl 的饱和溶液还可以溶解其他溶质,A 错误;20 ℃时,KCl 的溶解度为
34.0 g,可知该温度下,100 g 水中最多能溶解 34.0 g KCl,即 134.0 g KCl 的饱和溶液中含
KCl 34.0 g,B 错误;40 ℃时,KCl 的溶解度为 40.0 g,该温度下 KCl 饱和溶液中溶质的质
量分数为 40
100g+40g
×100%≠40.0%,C 错误;KCl 的溶解度随温度的升高而增大,故 60 ℃
的 KCl 饱和溶液降温至 20 ℃,溶解度减小,有 KCl 晶体析出,D 正确。
答案:D
11. 答案:(1)硫酸铜
(2)水(或汽油、酒精等)
(3)酒精(只要答案合理即可)
12. 答案:(1)< (2)> (3)= (4)< (5)>
13. 解析:从图像中看出,随着时间的变化,木块排开水的体积逐渐增大,即溶液的密
度减小,此时烧杯底部应有晶体析出,温度的改变方式是降温。
答案:降温 增多
14. 解析:(1)从图中看出,20 ℃时,KNO3 的溶解度是 31.6 g;该温度下,10 mL 水中
6
最多溶解 3.16 g KNO3 达到饱和,x 溶液是在 10 mL 水中加入 2.5 g KNO3 形成的,属于不饱
和溶液;y 溶液是在 10 mL 水中加入 5 g KNO3 形成的,属于饱和溶液。从图中看出,50 ℃
时, KNO3 的溶解度是 85.5 g,则该温度下,10 mL 水中最多溶解 8.55 g KNO3 达到饱和,
而 z 溶液是在 10 mL 水中溶解了 5 g KNO3 形成的,属于不饱和溶液。(2)氯化钠的溶解度受
温度的影响不大,故将其不饱和溶液变为饱和溶液可以采用蒸发溶剂或增加溶质的方法。(3)
除去 KNO3 固体中混有的少量 NaCl,主要采用降温结晶的方法,在降温之前,先蒸发浓缩,
减少溶剂,便于较多的硝酸钾晶体析出。
答案:(1)31.6 y (2)蒸发溶剂至饱和 加 NaCl 固体至不再溶解 (3)蒸发浓缩 降温
结晶
15. 解析:本题是信息给予题,认真分析所给信息是解题关键。由材料二可知,水中加
入氯化钠后冰点降低,因此铺撒“融雪剂”可快速融雪;“氯盐融雪剂”溶液中溶质的质量
分数越大,冰点越低,则融雪的效果越好;水凝固后体积增大,是分子间间隔变大的缘故。
答案:(1)盐溶于水形成盐溶液后冰点降低(其他合理答案均可) 大
(2)“氯盐融雪剂”溶液中溶质的质量分数越大,融雪的效果越好
16. 解析:(1)海水晒盐是利用蒸发溶剂的方法使食盐结晶析出,故①是蒸发池。(2)海
水进入贮水池,此时水分还未蒸发,氯化钠的质量分数基本不变,A 正确;海水进入蒸发池,
随着水分的不断蒸发,氯化钠的质量分数将不断增大,此时氯化钠还未结晶析出,溶液中氯
化钠的质量基本不变,B、C 错误;析出晶体后的母液应为食盐的饱和溶液,D 错误;海水
中蕴藏着盐类、矿物、生物等丰富资源,E 正确。
答案:(1)蒸发 (2)AE
17. 解析:(1)用托盘天平称量药品时,应“左物右码”。(2)托盘天平下的垫圈起到固
定托盘的作用,以免在移动过程中天平托盘左右摇摆损伤刀口,称量前应取下垫圈,否则托
盘不会发生偏转。(3)由于氯化钠和氯化钾的含量较少,需要水的量应由硝酸钾决定,在 80 ℃
时,硝酸钾的溶解度为 170 g,即 170 g 硝酸钾需要至少 100 g 水才能全部溶解,87.5 g 样品
中含有硝酸钾的质量约为 85 g,需水的质量大约为 50 g,即 50 mL。(4)取出过滤器中的固体
时,需用玻璃棒转移固体。(5)由于硝酸钾易溶于水,若用大量水冲洗,则会使较多量的硝
酸钾溶解在水中而造成损失。(6)由于氯化钾的量较少且溶解度随温度变化不大,不会结晶
析出,因而应 存在于滤液中。(7)由于硝酸钾的溶解度随温度变化较大,若热饱和溶液未完
全冷却至室温,那么部分硝酸钾就不会结晶析出,致使析出的晶体减少。
答案:(1)右
(2)C
(3)B
(4)转移固体
(5)因晶体易溶于水,洗涤用水越少,晶体质量损失越小
(6)滤液
(7)根据溶解度曲线可知,该硝酸钾饱和溶液在较高温度下结晶,析出的晶体质量较少
18. 答案:(1)4
(2)解:设需要质量分数为 16%的过氧乙酸溶液的质量为 x。
x·16%=4 kg
x=25 kg
答:需要质量分数为 16%的过氧乙酸溶液的质量为 25 kg。