- 5.55 MB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
化学方程式
1.下列化学方程式中,正确的有( )
①Fe+O2 FeO2
②2P+5O P2O5
③Mg+O2 MgO
④S+O2===SO2↑
⑤KClO3 KCl+O3↑
⑥2NaOH+CuSO4===Cu(OH)2+Na2SO4
A.①②③ B.④⑤⑥
C.①③⑤ D.都不正确
2.下列化学反应可用下图表示的是( )
A.H2CO3===CO2↑+H2O
B.2H2SO3+O2===2H2SO4
C.2HClO 2HCl+O2↑
D.CaCO3 CaO+CO2↑
3.铝在空气中表面能生成一层致密的氧化膜,其反应的化学方程式为 4Al+
3O2===2Al2O3。该反应中,Al、O2、Al2O3 三者之间的质量比为( )
A.4∶3∶2 B.108∶96∶204
C.4∶96∶204 D.108∶96∶156
4.已知某两种物质在光照条件下能发生化学反应,其微观示意图如图所示:
(说明:一种小球代表一种原子)
则下列说法正确的是( )
A.图示中的反应物都是单质
B.图示中共有 4 种分子
C.该反应属于化合反应
D.该图示不符合质量守恒定律
5.配平下列化学方程式。
(1)____H2O2 ____H2O+____O2↑
(2)____Fe+____O2 ____Fe3O4
(3)____C6H6+____O2 ____CO2+____H2O
(4)____Fe+____CuSO4===____Cu+____FeSO4
(5)____H2O ____H2↑+____O2↑
6.“纳米材料”特指微粒直径 1~100 nm(1 nm=10-9 m)的颗粒。纳米材料和纳米技术
应用几乎涉及现代工业的各个领域。用纳米级的某种氧化物作催化剂,使汽车尾气中的 CO
跟 NO 反应转化为两种气体,其中一种可参与植物的光合作用,另一种是空气中含量最多的
2
气体。这两种气体是________,写出 CO 和 NO 反应的化学方程式:__________________。
7.(2010 海南)为测定贝壳中碳酸钙的含量,小红将贝壳粉碎后,取样品 10 g,与足量
的稀盐酸充分反应(杂质不与盐酸反应),产生二氧化碳 1.76 g。计算贝壳中碳酸钙的质量
分数。
(CaCO3+2HCl===CaCl2+H2O+CO2↑)
能力提升 NENGLI TISHENG
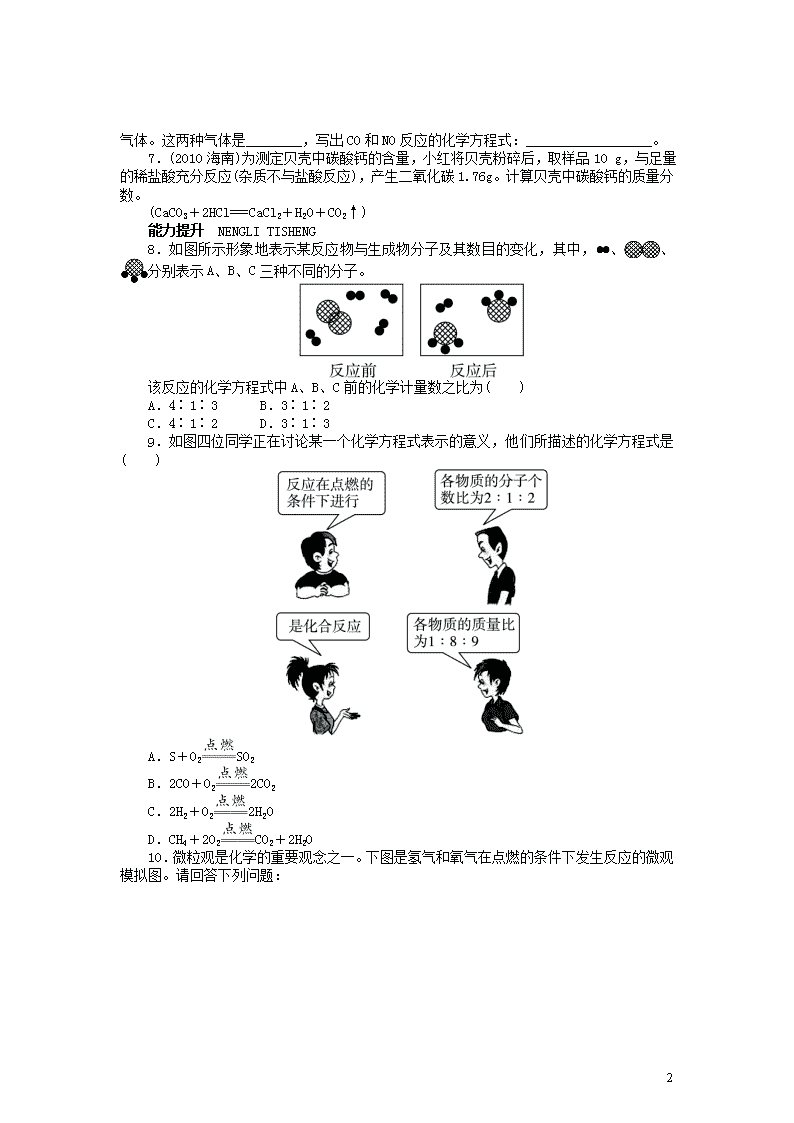
8.如图所示形象地表示某反应物与生成物分子及其数目的变化,其中, 、 、
分别表示 A、B、C 三种不同的分子。
该反应的化学方程式中 A、B、C 前的化学计量数之比为( )
A.4∶1∶3 B.3∶1∶2
C.4∶1∶2 D.3∶1∶3
9.如图四位同学正在讨论某一个化学方程式表示的意义,他们所描述的化学方程式是
( )
A.S+O2 SO2
B.2CO+O2 2CO2
C.2H2+O2 2H2O
D.CH4+2O2 CO2+2H2O
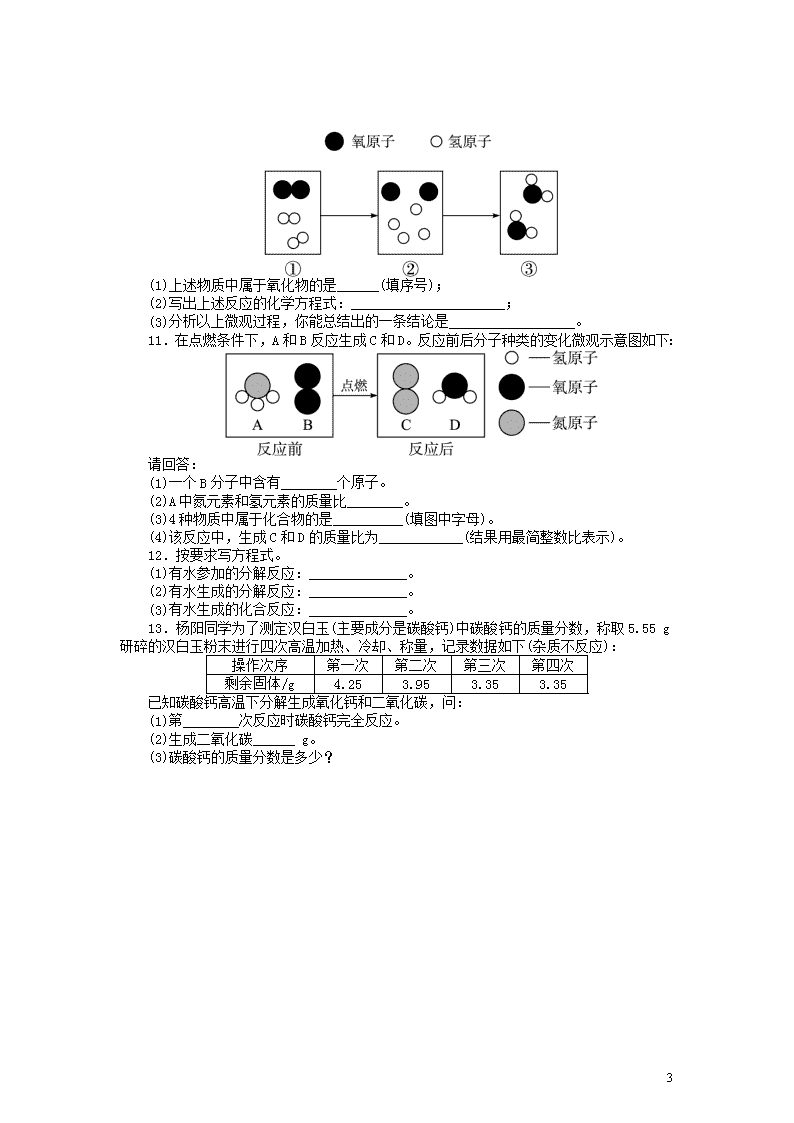
10.微粒观是化学的重要观念之一。下图是氢气和氧气在点燃的条件下发生反应的微观
模拟图。请回答下列问题:
3
(1)上述物质中属于氧化物的是______(填序号);
(2)写出上述反应的化学方程式:______________________;
(3)分析以上微观过程,你能总结出的一条结论是__________________。
11.在点燃条件下,A 和 B 反应生成 C 和 D。反应前后分子种类的变化微观示意图如下:
请回答:
(1)一个 B 分子中含有________个原子。
(2)A 中氮元素和氢元素的质量比________。
(3)4 种物质中属于化合物的是__________(填图中字母)。
(4)该反应中,生成 C 和 D 的质量比为____________(结果用最简整数比表示)。
12.按要求写方程式。
(1)有水参加的分解反应:______________。
(2)有水生成的分解反应:______________。
(3)有水生成的化合反应:______________。
13.杨阳同学为了测定汉白玉(主要成分是碳酸钙)中碳酸钙的质量分数,称取 5.55 g
研碎的汉白玉粉末进行四次高温加热、冷却、称量,记录数据如下(杂质不反应):
操作次序 第一次 第二次 第三次 第四次
剩余固体/g 4.25 3.95 3.35 3.35
已知碳酸钙高温下分解生成氧化钙和二氧化碳,问:
(1)第________次反应时碳酸钙完全反应。
(2)生成二氧化碳______ g。
(3)碳酸钙的质量分数是多少?
4
参考答案
1.D 点拨:题中六个化学方程式都有错误。①中,生成物的化学式应是 Fe3O4,写成
FeO2 不符合客观事实。②中,氧气化学式应写为 O2,反应条件一般是点燃。③中,等号两边
并不相等,应配平为 2Mg+O2 2MgO。④中,漏掉了反应条件,应注明条件为点燃,SO2
后面不应写“↑”。⑤中,生成的氧气化学式为 O2,不是 O3,反应条件必须注明“△”。⑥
中,Cu(OH)2 后面应标“↓”。
2.C 点拨:从图中看出,反应物是一种且每个分子是由三个原子构成,生成物是两种,
一种单质,一种化合物,故只有 C 符合要求。
3.B 点拨:质量比等于相对分子质量与化学计量数的乘积之比。
4.B 点拨:通过微观示意图可知该反应的特点是:一种化合物分子与一种单质分子发
生反应,生成两种不同的化合物分子。由此可见,A 错误,B 正确;从图中看出,反应物和
生成物都是两种,故不是化合反应,C 错误;任何一个化学反应都要遵循质量守恒定律,所
以 D 也是错误的。
5.(1)2 2 1 (2)3 2 1 (3)2 15 12 6 (4)1 1 1 1 (5)2 2 1
6.CO2 和 N2 2CO+2NO N2+2CO2
点拨:解答此题关键在于抓住题目中给出的信息。很明显,“可参与植物的光合作用”
的气体是 CO2,空气中含量最多的是 N2,由此可知生成物;又知反应物为 CO 和 NO,所以注
明条件和符号,配平,即可完成此化学方程式。
7.解:设 10 g 贝壳中碳酸钙的质量为 x
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
x 1.76 g
100∶x=44∶1.76 g
求得 x=4 g
则碳酸钙的质量分数为: 4 g 100% 40%10 g
答:碳酸钙的质量分数为 40%。
8.B 点拨:分子个数比就是化学方程式中 A、B、C 前的计量数之比。反应前有 4 个 A
分子,1 个 B 分子;反应后有 1 个 A 分子,2 个 C 分子,所以有 3 个 A 分子和 1 个 B 分子反
应生成 2 个 C 分子,化学方程式可表示为 3A+B===2C,检验一下反应前后的原子种类和个
数,前后相等,故应选 B。
9.C 点拨:分析四位同学的描述,A 选项不符合分子个数比;B 选项不符合质量比;D
选项不符合反应类型,同时符合要求的只有 C 选项。
10.(1)③
(2)2H2+O2 2H2O
(3)在化学变化中,分子分裂为原子,原子重新结合成分子(或分子种类改变、原子的种
类不变等,合理即可)
点拨:氧化物是由两种元素组成的化合物,从分子的角度看,其分子中含有两种原子,
故只有③符合要求。从图中看出,该反应是氢气与氧气反应生成水的过程,其中,水是氧化
物。
11.(1)2 (2)14∶3 (3)AD (4)14∶27
点拨:从图中看出,A、B、C、D 四种物质的化学式分别为 NH3、O2、N2、H2O。A 中氮、
氢元素的质量比为 14∶3,四种物质中属于化合物的是 A 和 D;该反应的化学方程式为
4NH3+3O2 2N2+6H2O,故生成物的质量比为 56∶108=14∶27。
5
12.(1)2H2O 2H2↑+O2↑
(2)2H2O2 2H2O+O2↑
(3)2H2+O2 2H2O
13.解:(1)三、四
(2)根据质量守恒定律可得生成二氧化碳质量为:5.55 g-3.35 g=2.2 g
(3)设汉白玉中碳酸钙的质量为 x
CaCO3 CaO+CO2↑
100 44
x 2.2 g
100 44
2.2 gx
x=5 g
答:碳酸钙的质量分数为 5 g 100% 90.1%5.55 g
。
点拨:做数据分析类型题时要善于抓住数据变化特征,如由大→小→不变,或由小→大
→不变或成比例关系,把数据变化规律与题意结合起来分析就可以解题。碳酸钙高温分解生
成一种固体和一种气体,根据质量守恒定律,随着反应的进行,固体质量逐渐减少,当不再
减少时证明已完全反应。因此第三次、第四次时碳酸钙反应完全且固体质量的减少即为生成
二氧化碳的质量。注意剩余 3.35 g 固体中有生成的氧化钙和杂质,不能当成纯氧化钙来计
算。