- 211.58 KB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题 28 化学式、物质的分类
【知识点回顾】
一、相对原子质量和相对分子质量
考点 1 知道相对原子质量和相对分子质量的概念
1.相对原子质量:原子的实际质量跟 C-12 原子质量的 1/12 相比后得出的________。
相对原子质量与该原子的实际质量成________。
2.相对分子质量:一个分子中各原子的________总和。
考点 2 查阅相对原子质量,根据化学式计算物质的相对分子质量
相对分子质量的计算方法:①查表得化学式中各元素的相对原子质量;②根据算式计算。
二、化学式
考点 3 认识常见物质的化学式;解释化学式所表示的含义
1.化学式:用元素符号来表示________的式子。
2.化学式表示的含义:①表示________;②表示这种物质的________;③表示组成物
质的________;④表示这种物质的一个分子中所含的原子及原子的数量。
考点 4 根据化学式计算组成物质的元素的质量比
物质中各元素的质量比=(A 元素的相对原子质量×A 元素的原子个数)∶(B 元素的相对
原子质量×B 元素的原子个数)∶……
考点 5 根据化学式计算组成物质的某元素的质量分数
化合物中某元素的质量分数=
该元素的相对原子质量×该元素的原子个数
化合物的相对分子质量 ×100%
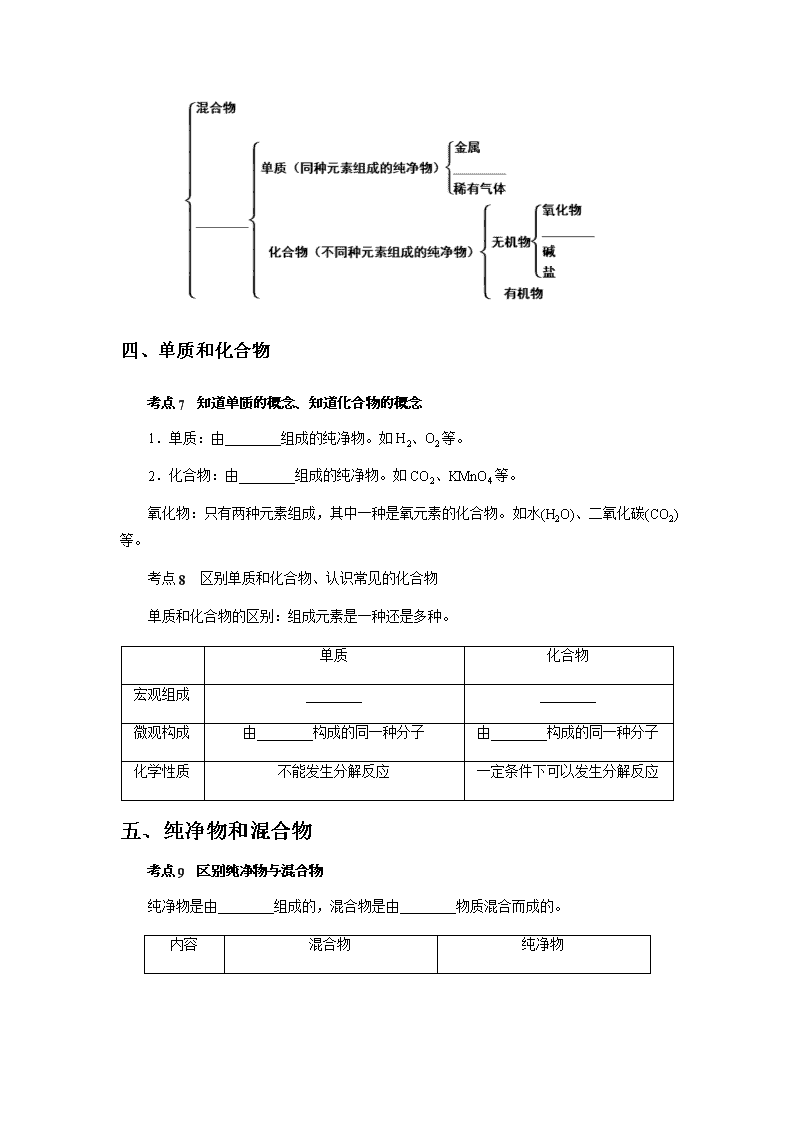
三、物质的分类
考点 6 根据物质的组成对常见物质进行分类 指认具体物质的类别
四、单质和化合物
考点 7 知道单质的概念、知道化合物的概念
1.单质:由________组成的纯净物。如 H2、O2 等。
2.化合物:由________组成的纯净物。如 CO2、KMnO4 等。
氧化物:只有两种元素组成,其中一种是氧元素的化合物。如水(H2O)、二氧化碳(CO2)
等。
考点 8 区别单质和化合物、认识常见的化合物
单质和化合物的区别:组成元素是一种还是多种。
单质 化合物
宏观组成 ________ ________
微观构成 由________构成的同一种分子 由________构成的同一种分子
化学性质 不能发生分解反应 一定条件下可以发生分解反应
五、纯净物和混合物
考点 9 区别纯净物与混合物
纯净物是由________组成的,混合物是由________物质混合而成的。
内容 混合物 纯净物
概
念
宏
观
由多种物质组成 由一种物质组成
微
观
分子构成的物质中,由不同分子
构成
分子构成的物质中,由一种分子
构成
特性
1.________固定组成
2.没有固定的性质,各种成分仍
保持原物质的性质
1.具有固定组成
2.有固定的性质
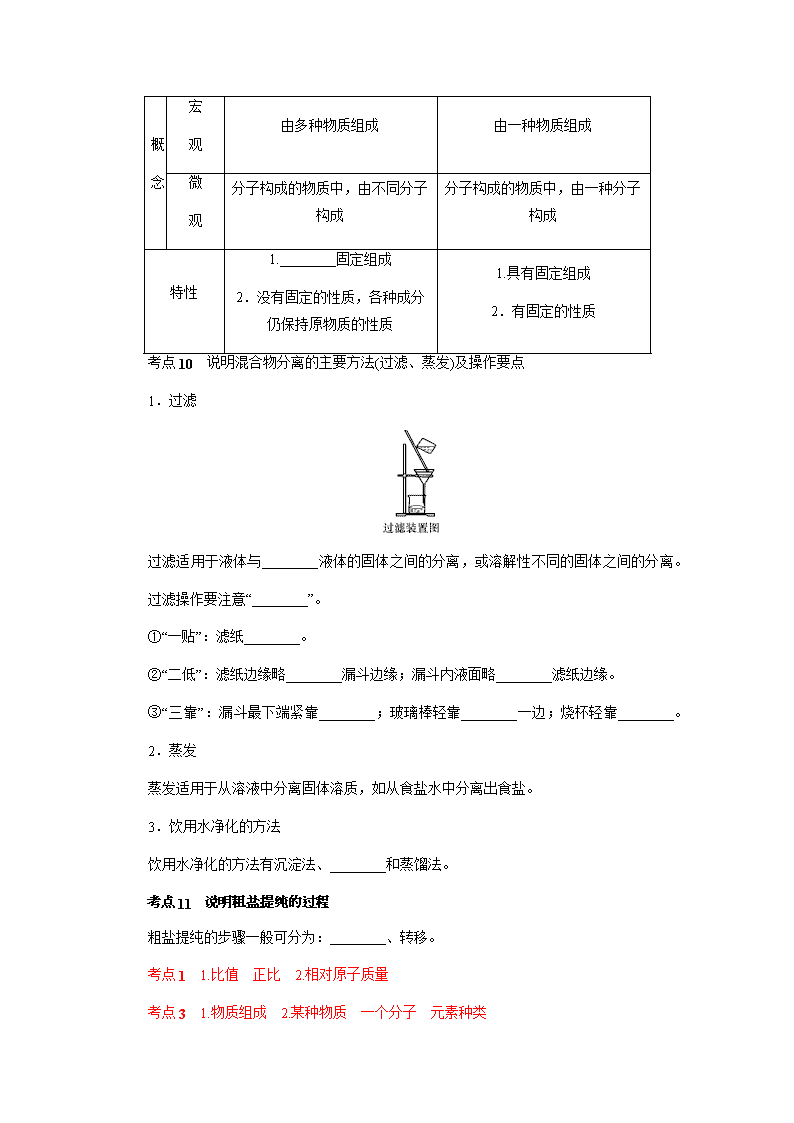
考点 10 说明混合物分离的主要方法(过滤、蒸发)及操作要点
1.过滤
过滤适用于液体与________液体的固体之间的分离,或溶解性不同的固体之间的分离。
过滤操作要注意“________”。
①“一贴”:滤纸________。
②“二低”:滤纸边缘略________漏斗边缘;漏斗内液面略________滤纸边缘。
③“三靠”:漏斗最下端紧靠________;玻璃棒轻靠________一边;烧杯轻靠________。
2.蒸发
蒸发适用于从溶液中分离固体溶质,如从食盐水中分离出食盐。
3.饮用水净化的方法
饮用水净化的方法有沉淀法、________和蒸馏法。
考点 11 说明粗盐提纯的过程
粗盐提纯的步骤一般可分为:________、转移。
考点 1 1.比值 正比 2.相对原子质量
考点 3 1.物质组成 2.某种物质 一个分子 元素种类
考点 6 纯净物 非金属 酸
考点 7 1.同种元素 2.不同种元素
考点 8 同种元素 不同种元素 同种原子 不同种原子
考点 9 一种物质 两种或多种 没有
考点 10 1.不溶于 一贴二低三靠 ①紧贴漏斗内壁 ②低于 低于 ③烧杯内壁
三层滤纸 玻璃棒 3.过滤法
考点 11 溶解、过滤、蒸发
【例题精析】
例 1.(2018•徐州)下列对几种有机化合物的叙述正确的是( )
A.甲烷中含有 1 个碳原子和 4 个氢原子
B.乙醇(C2H6O)中碳、氢、氧元素的质量比为 2:6:1
C.尿素[CO(NH2)2]的相对分子质量为 60g
D.葡萄糖(C6H12O6)中碳元素的质量分数为 40%
【解答】解:A.甲烷是由甲烷分子构成的,每个甲烷分子是由 1 个碳原子和 4 个氢原子,
故错误;
B.乙醇中碳、氢、氧元素的质量比为(12×2):(1×6):(16×1)=12:3:8,故错误;
C.相对分子质量单位是“1”,不是“克”,常常省略不写,故错误;
D.葡萄糖(C6H12O6)中碳元素的质量分数为
�㈠��
�㈠��晦���㈠晦���� � �ͲͲͲ � ΨͲͲ
,故
正确。
故选:D。
例 2.(2018•温州)茶叶中含有茶氨酸(C7H14O3N2),茶氨酸中各元素质量分数如图所示。
其中①表示的元素是( )
A.碳 B.氢 C.氧 D.氮
【解答】解:茶氨酸中碳、氢、氧、氮元素的质量比为:(12×7):(1×14):(16×3):(14×2)
=84:14:48:28,可见其中碳元素的质量分数最大,而图示中①所占质量分数最大,
所以①表示的是碳元素。
故选:A。
例 3.(2018•金华)如图是微信热传的“苯宝宝表情包”,苯(化学式 C6H6)、六氯苯(化学
式 C6Cl6)都是重要的化工原料,下列有关说法正确的是( )
A.苯分子由碳、氢两种元素组成
B.苯中氢元素的质量分数小于 10%
C.六氯苯中碳氯两种元素的质量比为 1:1
D.六氯苯有 6 个碳原子和 6 个氯原子构成
【解答】解:A.苯是由苯分子构成的,苯是由碳元素与氢元素组成的,故错误;
B.苯中氢元素的质量分数为
���
���晦�㈠�� � �ͲͲͲ � �耀�Ͳ
<
�ͲͲ
,故正确;
C.由六氯苯的化学式 C6H6 可知,其中碳元素和氢元素的质量比为:(12×6):(35.5×6)
=12:35.5,故错误;
D.六氯苯是由六氯苯分子构成的,而不是由原子直接构成的,故错误。
故选:B。
例 4.(2019•潍坊)实验室有一包白色固体,其中除了碳酸钠以外,还可能含有硝酸钡、硫
酸钠、氢氧化钠中的一种或几种。为确定其组成进行如下实验:①取少量白色固体于烧
杯中,向烧杯中加入足量水并不断搅拌,固体部分溶解;②继续向烧杯中逐滴加入足量
稀硝酸并不断搅拌,此时固体质量变化如图。下列说法正确的是( )
A.A→B 段对应的实验现象是固体部分溶解,无气泡冒出
B.B→C 段对应溶液 pH 逐渐变大
C.原白色固体中一定含有碳酸钠、硫酸钠、硝酸钡
D.C 点对应溶液中一定含有的溶质是硝酸、硝酸钠、碳酸钠、硝酸钡
【解答】解:碳酸钠和硝酸钡反应生成溶于酸的碳酸钡沉淀,硫酸钠和硝酸钡反应生成
不溶于酸的硫酸钡沉淀,所以
步骤①:取少量白色固体于烧杯中,向烧杯中加入足量水并不断搅拌,固体部分溶解,
步骤②:接着向烧杯中加入足量稀硝酸并不断搅拌,所以固体中含有碳酸钠、硫酸钠、
硝酸钡
A、A→B 段对应的反应是碳酸钡和硝酸反应生成硝酸钠、水和二氧化碳,实验现象是固
体部分溶解,有气泡冒出,故 A 错误;
B、B→C 段对应溶液 pH 逐渐变小,故 B 错误;
C、原白色固体中一定含有碳酸钠、硫酸钠、硝酸钡,可能含有氢氧化钠,故 C 正确;
D、C 点对应溶液中一定含有的溶质是硝酸、硝酸钠、硝酸钡,故 D 错误。
故选:C。
例 5.(2019•台州)空气的组成成分中,属于化合物的是( )
A.氧气 B.二氧化碳 C.氮气 D.稀有气体
【解答】解:A、氧气属于单质,故选项错误;
B、二氧化碳属于化合物,故选项正确;
C、氮气属于单质,故选项错误;
D、稀有气体属于混合物,故选项错误;
故选:B。
例 6.(2019•绍兴)为了研究和识别物质,需要对它们进行分门别类。表中物质分类正确的
是( )
选项 酸 碱 盐 氧化物
A HNO3 Na2CO3 Cu(NO3)2 Fe3O4
B HCl NaOH NaCl C2H6O
C H2SO4 KOH NH4NO3 H2O
D H2O2 Ca(OH)2 ZnSO4 O2
【解答】解:A、硝酸是由氢离子和酸根离子构成的化合物,属于酸;Na2CO3 是由钠离
子和碳酸根离子构成的化合物,属于盐,故选项错误。
B、盐酸是由氢离子和酸根离子构成的化合物,属于酸;NaOH 是由钠离子和氢氧根离子
组成的化合物,属于碱;NaCl 是由钠离子和氯离子构成的化合物,属于盐;C2H6O 是由
碳、氢、氧三种元素组成的化合物,不属于氧化物;故选项错误。
C、硫酸是由氢离子和酸根离子构成的化合物,属于酸;KOH 是由钾离子和氢氧根离子
组成的化合物,属于碱;NH4NO3 是由铵根离子和硝酸根离子构成的化合物,属于盐;
H2O 是由两种元素组成的且有一种是氧元素的化合物,属于氧化物;故选项正确。
D、过氧化氢不属于酸,故选项错误。
故选:C。
例 7.(2018•绍兴)如图所示,围棋棋盘上有五枚棋子,代表铁、稀盐酸、氢氧化钡、碳酸
钙、硝酸银五种物质,相邻棋子间的连线表示物质间可以反应。已知与戊的反应中:甲
﹣戊的反应类型不同于其它几个反应;丙﹣戊反应能产生一种气体,且该气体还能与丁
反应生成沉淀。则下列对应关系正确的是( )
甲 乙 丙 丁 戊
A 铁 硝酸银 碳酸钙 氢氧化钡 稀盐酸
B 硝酸银 铁 稀盐酸 氢氧化钡 碳酸钙
C 硝酸银 铁 碳酸钙 氢氧化钡 稀盐酸
D 铁 氢氧化钡 碳酸钙 硝酸银 稀盐酸
A.A B.B C.C D.D
【解答】解:丙﹣戊反应能产生一种气体,且该气体还能与丁反应生成沉淀,盐酸与碳
酸钙反应生成二氧化碳,铁与盐酸反应产生氢气,但氢气不能与其他物质产生沉淀,所
以丙﹣戊反应只能是盐酸与碳酸钙反应,甲﹣戊的反应类型不同于其它几个反应,只有
铁与盐酸反应属于置换反应,其他反应都是复分解反应,所以甲是铁,戊是盐酸,丙是
碳酸钙,丙﹣戊反应能产生一种气体,且该气体还能与丁反应生成沉淀,二氧化碳与氢
氧化钡反应产生白色沉淀,所以丁是氢氧化钡,剩下的乙属于硝酸银了。
故选:A。
例 8.(2019•益阳)今年 4 月,多家媒体报道,中科院专家的研究成果中完整阐明了抗癌活
性物质汉黄芩素(C16H12O5)的合成机制,成功解析了一种使用 2000 多年的药用植物中
的珍贵化学物质合成途径。请计算:
(1)汉黄芩素的相对分子质量是 284 。
(2)汉黄芩素中各元素质量的最简整数比 m(C):m(H):m(O)= 48:3:20 。
【解答】解:(1)汉黄芩素的相对分子质量为 12×16+1×12+16×5=284;
(2)汉黄芩素(C16H12O5)中碳、氢、氧三种元素组成的质量比为:(12×16):(1×12):
(16×5)=48:3:20。
故填:(1)284;
(2)48:3:20。
例 9.(2018•泰安)儿童缺锌会引起食欲不振、发育不良等症状。如图为某补锌口服液说明
书的部分信息,图中葡萄糖酸锌化学式已不完整,请根据相关信息回答下列问题:
(1)葡萄糖酸锌的化学式量是 455,则葡萄糖酸锌化学式氢原子右下角的数字为 22 ;
(2)若儿童 lkg 体重每日需要 0.5mg 锌,每天从食物中只能摄入所需锌的一半。体重为
20kg 的儿童,理论上一天还需服该口服液 1 支?
【解答】解:(1)葡萄糖酸锌的化学式量是 455,即 12×12+x+16×14+65=455,x=22;
故填:22;
(2)儿童 1kg 体重每日需要 0.5mg 锌,则体重为 20kg 的儿童每天需要锌的质量为
0.5mg×20=10mg;每天从食物中只能摄入所需锌的一半,则每天从该口服液中摄入所需
锌的质量为 10mg
� �
㈠ �
5mg;而每支口服液中含锌 5.0mg/支,故体重为 20kg 的儿童每天
还需服该口服液 1 支;故填:1。
例 10.(2020•台州)碰碰香是一种常见的室内盆栽植物,因触碰后可散发出令人舒适的香
气而得名,其香气具有提神醒脑、驱避蚊虫的作用。碰碰香的香味物质中含量最多的是
柠檬烯,其化学式为 C10H16.计算:
①柠檬烯中碳元素、氢元素的质量比为 15:2 。
②柠檬烯中碳元素的质量分数是多少?(计算结果精确到 0.1%)
【解答】解:①柠檬烯中碳元素、氢元素的质量比为(12×10):(1×16)=15:2。
②柠檬烯中碳元素的质量分数是
�㈠��Ͳ
�㈠��Ͳ晦���� �
100%≈88.2%。
故答案为:
①15:2;②88.2%。
【习题巩固】
一.选择题(共 13 小题)
1.常温下,下列各组物质只用一种试剂不能鉴别出来的是( )
①食盐、烧碱、氢氧化镁
②焦炭、氧化铜、氧化亚铁
③碳酸钠溶液、硝酸钠溶液、氯化钠溶液
④蔗糖、硫酸铜粉末、碳酸钙粉末
A.全部 B.①②③ C.①③④ D.只有③
【解答】解:①、食盐溶于水温度不变,烧碱溶于水放热,氢氧化镁不溶于水,故可以
使用水这一种试剂鉴别出来;
②焦炭不与稀硫酸反应,氧化铜与稀硫酸反应固体溶解、溶液变蓝,氧化亚铁与稀硫酸
反应固体溶解、溶液为浅绿色,故可以使用稀硫酸这一种试剂鉴别出来;
③碳酸钠溶液、硝酸钠溶液、氯化钠溶液使用一种试剂无法鉴别;
④蔗糖溶于水水溶液为无色,硫酸铜粉末溶于水水溶液为蓝色,碳酸钙粉末不溶于水,
故可以使用税这一种试剂鉴别出来;
故选:D。
2.2017 年 7 月,中国海域天然气水合物﹣“可燃冰”首次试采圆满成功(如图),取得了持
续产气时间最长、产气总量最大、气流稳定、环境安全等多项重大突破性成果,创造了
产气时长和总量的世界纪录。“可燃冰”是( )
A.纯净物 B.化合物 C.混合物 D.氧化物
【解答】解:A、纯净物是由一种物质组成,故选项错误;
B、由两种或两种以上的元素组成的纯净物叫化合物,故选项错误;
C、混合物是由两种或两种以上的物质组成,可燃冰是主要成分是甲烷,属于混合物;故
选项正确;
D、氧化物是指由两种元素组成的化合物中,其中一种元素是氧元素;故选项错误;
故选:C。
3.磁光存储的研究是 Williams 等人在 1957 年使 Mn 和 Bi 形成的晶体薄膜磁化并用光读取
之后开始的。如图是 Mn 和 Bi 形成的某种晶体的结构示意图,则该晶体物质的化学式可
表示为( )
A.Mn2Bi B.MnBi C.MnBi3 D.Mn4Bi3
【解答】解:由晶胞的结构图可知,锰原子分布在正六棱柱的顶点、上下底面的面心上、
棱边的中点上和体心上,所以锰原子的个数为:12
� �
� 晦
2
� �
㈠ 晦
6
� �
� 晦
1=6,铋原子分布
在六棱柱的体内,数目为 6,所以锰原子和铋原子的个数比为 6:6=1:1,所以化学式
为 MnBi,
故选:B。
4.某家庭式空气净化器在工作时会释放出臭氧(O3),利用其强氧化性杀菌消毒并转化为
无污染的氧气(O2)。下列分析合理的是( )
A.O3 的强氧化性是由 O3 分子结构决定的
B.相同质量的 O3 与 O2 所含的分子个数相同
C.相同分子个数的 O3 与 O2 中,所含氧原子的个数相同
D.O3 与 O2 都由氧元素组成,它们的化学性质完全相同
【解答】解:A、物质的组成决定物质的性质,故 O3 的强氧化性是由 O3 结构决定的,
合理,符合题意;
B、臭氧和氧气的分子含有的氧原子个数不同,等质量的臭氧和氧气含有不同分子数臭氧
和氧气的分子含有的氧原子个数不同,等质量的臭氧和氧气含有不同分子数,不合理,
不符合题意;
C、相同分子个数的 O3 与 O2 中,所含氧原子的个数不同,不合理,不符合题意;
D、构成它们的分子不同,化学性质不同,不合理,不符合题意;
故选:A。
5.类价图反映的是元素的化合价与物质类别之间的关系。如图是碳元素的类价图,图中物
质“乙” 是( )
A.CH4 B.CO C.CO2 D.K2CO3
【解答】解:A、CH4 不是氧化物,选项错误;
B、CO 是氧化物,碳元素化合价为+2 价,选项正确;
C、CO2 是氧化物,碳元素化合价为+4 价,选项错误;
D、K2CO3 是盐,选项错误;
故选:B。
6.小凡是个爱探究的同她以化合价为纵坐标,以物质类别为横坐标绘制图象,这种图象叫
价类图。如图是有关硫的价类图,分析不正确的是( )
A.A 点表示的物质类别为单质
B.B 点表示的物质的化学式为 SO2
C.C 点表示的物质的化学式为 H2SO4
D.G 点所代表的物质类别中有可以与 Ba(OH)2 反应生成两种沉淀的物质
【解答】解:A、单质中元素的化合价为 0,A 点表示的物质中硫元素的化合价为 0,类
别为单质,故选项说法正确。
B、B 点表示的物质属于氧化物,硫元素显+4 价,氧元素显﹣2 价,化学式为 SO2,故选
项说法正确。
C、C 点表示的物质中硫元素显+6 价,属于酸,硫酸中硫元素的化合价为+6 价,则 C 点
表示的物质的化学式不可能为 H2SO4,应为 H2SO3,故选项说法错误。
D、G 点所代表的物质中硫元素显+6 价,属于盐,可以是硫酸铜,硫酸铜与 Ba(OH)2
反应生成硫酸钡沉淀和氢氧化铜沉淀,故选项说法正确。
故选:C。
7.下列有关物质的化学式、名称、俗名不完全对应的是( )
A.NaOH 氢氧化钠 烧碱
B.CaO 氢氧化钙 生石灰
C.Na2CO3 碳酸钠 纯碱
D.NaCl 氯化钠 食盐
【解答】解:A.氢氧化钠俗称火碱、烧碱、苛性钠,其化学为 NaOH,其化学式、名称、
俗名完全对应。
B.氧化钙俗称生石灰,其化学式为 CaO,其化学式、名称、俗名不完全对应。
C.碳酸钠俗称纯碱,物质的化学式为 Na2CO3、化学式、名称、俗名完全对应。
D.氯化钠的俗称是食盐,其化学式为 NaCl,其化学式、名称、俗名完全对应。
故选:B。
8.下列化学符号错误的是( )
A.氧化铝中铝元素的化合价:Al23+O3
B.氦气:He
C.氯化镁:MgCl2
D.2 个氮原子:2N
【解答】解:A、氧化铝中铝元素的化合价为+3 价,可表示为
��
晦�2O3,则 A 错误,故 A
符合题意;
B、稀有气体是单原子分子,可用元素符号表示其化学式,则氦气可用 He 表示,正确,
故 B 不符合题意;
C、氯化镁是金属和非金属形成的化合物,化学式中金属在前,右下角数字表示原子个数,
则 MgCl2 正确,故 C 不符合题意;
D、在元素符号前面的数字表示原子个数,则 2 个氮原子表示为 2N 正确,故 D 不符合题
意;
故选:A。
9.某混合物中含有的化学成分和分子个数组合为:x 份 CaCO3,y 份 CaO,2y 份 CaSO4 和
p 份 NaCl(假定混合物中各化合物均匀存在)。已知混合物中氧的质量分数为 39%,则混
合物中钙的质量分数为( )
A.32.5% B.31.3% C.33.2% D.70%
【解答】解:CaCO3 中钙元素与氧元素的个数比为 1;3,故 x 份 CaCO3 中钙元素与氧元
素的原子个数分别为 x、3x;
CaO 中钙元素与氧元素的个数比为 1;1,故 y 份 CaO 中钙元素与氧元素的原子个数分别
为 y、y。
CaSO4 中钙元素与氧元素的个数比为 1;4,故 2y 份 CaSO4 中钙元素与氧元素的原子个
数分别为 2y、8y。
混合物中钙元素与氧元素的个数应为混合物中各物质含有的钙元素、氧元素的原子个数
之和。
故混合物中钙元素与氧元素的原子个数比为:(x+y+2y):(3x+y+8y)=1:3。
元素的质量比是各元素的相对原子质量乘以原子个数之比;
故混合物中钙元素与氧元素的质量比为:(40×1):(16×3)=5:6。
因元素的质量与它的质量分数成正比。
设混合物中钙的质量分数为 a%
�
� �
�Ͳ
�tͲ
a%=32.5%
故选:A。
10.在 NaHS、NaHSO4 和 MgSO4 组成的混合物中,测得其中 S 元素的质量分数为 4X%,
则该混合物中氧元素的质量分数( )
A.(100﹣4X)% B.(100﹣5X)% C.(100﹣6X)% D.(100﹣7X)%
【解答】解:因为 NaHS、NaHSO4 组成中钠和氢的个数比是 1:1,可以把钠元素和氢元
素放在一起看做镁元素(23+1=24),这样三种物质相当于是 MgS、MgSO4、MgSO4,
此时三种物质中镁和硫的个数比都是 1:1;硫元素的质量分数为 4X%,所以镁元素的质
量分数为
㈠Ψ
�㈠ �
4X%=3X%,则混合物中氧元素的质量分数为 1﹣4X%﹣3X%=(100﹣
7X)%。
故选:D。
11.已知一个 SO2 分子的质量为 n 克,一个 SO3 分子的质量为 m 克,若以氧原子质量的
�
��作为相对原子质量的标准,则 SO3 的相对分子质量( )
A.
��㜳
㜳‴㜳
B.
��㜳
㜳‴㜳
C.
��㜳
㜳‴㜳
D.
�㈠㜳
㜳‴㜳【解答】解:1 个氧原子的质量为:(m﹣n)g;
氧原子的相对原子质量为:
�㜳‴㜳ꀀ香
�㜳‴㜳ꀀ香�
�
��
�
16;
1 个硫原子的质量为:n﹣2(m﹣n)g;
硫原子的相对原子质量为:
㜳‴㈠�㜳‴㜳ꀀ香
�㜳‴㜳ꀀ香�
�
��
�
����㜳‴㈠㜳ꀀ
㜳‴㜳根据相对分子的质量为组成分子的各原子的相对原子质量之和,所以 SO3 的相对分子质
量为
����㜳‴㈠㜳ꀀ
㜳‴㜳 晦
16×3
� ��㜳
㜳‴㜳
。
故选:A。
12.由 NaHS、MgSO4、NaHSO3 组成的混合物中,已知 S 元素的质量分数 w(S)=a%,
则 O 元素的质量分数 w(O)为( )
A.1.75a% B.1﹣1.75a% C.1.25a% D.无法计算
【解答】解:因为 NaHS、NaHSO3 组成中钠和氢的比例是 1:1,可以把钠元素和氢元素
放在一起看做镁元素(23+1=24),这样三种物质相当于是 MgS、MgSO4、MgSO3,所
以这时三种物质镁和硫的比例相同都是 1:1;因为 S 是 a%,所以镁元素的质量分数可
通过计算:
设镁元素的质量分数为 x
S~Mg
32 24
a% x
�㈠
㈠Ψ �
�Ͳ
�x=0.75a%;
这样硫和镁(即镁、氢、钠)元素的质量分数和=a%+0.75a%=1.75a%,用总量 1 减去
硫和镁(即镁、氢、钠)元素所占的质量分数和即氧元素的质量分数,即 1﹣1.75a%。
故选:B。
13.在 FeO、Fe2O3 和 CaCO3 的混合物中,已知铁元素的质量分数为 56%,则 CaCO3 的质
量分数可能是( )
A.10% B.25% C.30% D.35%
【解答】解:假设混合物共 100g,极端假设。设混合物只有 FeO 和 CaCO3,则含 Fe56g,
则与 Fe 结合的 O 应该是 16g,余下的 28g 是 CaCO3;同理若为 Fe2O3 和 CaCO3 的混合
物,则含 Fe56g,与 Fe 结合的 O 应该是 24g,应该含 CaCO3 的质量为 20g,所以碳酸钙
含量介于 20g 和 28g 之间。则 CaCO3 的质量分数 20%﹣﹣﹣28%之间。
故选:B。
二.填空题(共 5 小题)
14.含有相同阳离子的两种常见的正盐甲和乙,甲由 3 种元素组成,乙由 4 种元素组成。在
185~200℃时,一定量的甲完全分解产生相对分子质量为 44 的气体(不是二氧化碳)丙
和 3.6g H2O.盐乙和盐丁含有相同阴离子,它们的混合溶液通过小火加热、蒸发浓缩、
结晶可制得一种浅绿色晶体戊[(NH4)2Fe(SO4)2],它是一种工业上用作废水处理的
混凝剂,农业上又可用作农药及肥料。回答下列问题:
(1)甲的化学式为 NH4NO3 ;
(2)生成气体丙的质量为 4.4g ;
(3)检验乙中阳离子的常用实验方法为 取适量的乙溶于水加氢氧化钠溶液,加热,把
湿润的红色石蕊试纸放在试管口,试纸变蓝 ;
(4)写出一个用化合反应生成丁的方程式 Fe+2FeCl3=3FeCl2 ;
(5)价电子数(原子核最外层电子数)和原子数相同的分子、离子或原子团互称为等电
子体。与丙互为等电子体的是 AD 。
A.CS2 B.O3 C.SO2 D.SCN﹣。
【解答】解:(1)含有相同阳离子的两种常见的正盐甲和乙,盐乙和盐丁含有相同阴离
子,它们的混合溶液通过小火加热、蒸发浓缩、结晶可制得一种浅绿色晶体戊,它是一
种工业上用作废水处理的混凝剂,农业上又可用作农药及肥料,即为(NH4)2Fe(SO4)
2,所以乙为(NH4)2SO4,丁为 FeSO4,甲由 3 种元素组成,乙由 4 种元素组成,在 185~
200℃时,一定量的甲完全分解产生相对分子质量为 44 的气体(不是二氧化碳)丙和 3.6g
H2O,所以该气体是丙是 N2O,甲为 NH4NO3,经过验证,推导正确,所以甲的化学式为
NH4NO3;
(2)
NH4NO3
��
N2O↑+2H2O,
44 36
4.4g 3.6g
由化学方程式可知,生成气体丙的质量为 4.4g;
(3)乙中阳离子是铵根离子,铵根离子在加热条件下,可以和强碱溶液反应生成氨气,
所以检验乙中阳离子的常用实验方法为:取适量的乙溶于水加氢氧化钠溶液,加热,把
湿润的红色石蕊试纸放在试管口,试纸变蓝;
(4)用化合反应生成丁的反应是硫酸铁和铁反应生成硫酸亚铁,化学方程式为:Fe+Fe2
(SO4)3=3Fe(SO4)2;
(5)丙是 N2O,价电子数(主族元素就是最外层电子数)和原子数分别是:16、3,
A、CS2 价电子数(主族元素就是最外层电子数)和原子数分别是:16、3,和 N2O 互为
等电子体,故 A 正确;
B、O3 价电子数(主族元素就是最外层电子数)和原子数分别是:18、3,和 N2O 不互
为等电子体,故 B 错误;
C、SO2 价电子数(主族元素就是最外层电子数)和原子数分别是:18、3,和 N2O 不互
为等电子体,故 C 错误;
D、SCN﹣价电子数(主族元素就是最外层电子数)和原子数分别是:16、3,和 N2O 互
为等电子体,故 D 正确。
故选:AD。
故答案为:(1)NH4NO3;
(2)4.4g;
(3)取适量的乙溶于水加氢氧化钠溶液,加热,把湿润的红色石蕊试纸放在试管口,试
纸变蓝;
(4)Fe+Fe2(SO4)3=3Fe(SO4)2;
(5)AD。
15.某科学兴趣小组本着“在游戏中学习,在学习中成长”的理念,开发了一款名为“化学跑
得快”的纸牌游戏。游戏规则是:每张牌对应一种物质,按顺序抽完牌,上家出牌后,下
家所出牌中的物质能与上家所出牌中的物质反应,或者能由上家所出牌中的物质转化而
来。如图是某五位同学出的牌,请根据游戏规则回答:
(1)写出反应④的化学方程式 CO2+H2O=H2CO3 。
(2)以上四个反应中,反应前后各种元素的化合价均无变化的是 ④ ( 填序号①②
③④)。
【解答】解:(1)游戏规则是:每张牌对应一种物质,按顺序抽完牌,上家出牌后,下
家所出牌中的物质能与上家所出牌中的物质反应,或者能由上家所出牌中的物质转化而
来,戊能使澄清石灰水变浑浊,所以戊是二氧化碳,常见的无色液体丁会与二氧化碳反
应,所以丁是水,丙是能供给呼吸的气体,所以丙是氧气,非金属氧化物会与氧气反应,
所以乙是一氧化碳,一氧化碳会与黑色的金属氧化物反应,所以 A 可以是氧化铜,经过
验证,推导正确,所以④是水和二氧化碳反应生成碳酸,化学方程式为:CO2+H2O=H2CO3;
(2)①中铜元素的化合价从+2 变成 0,②中氧元素的化合价从 0 变成﹣2,③中氧元素
的化合价从 0 变成﹣2,④中各物质的化合价不变,所以以上四个反应中,反应前后各种
元素的化合价均无变化的是④;
故答案为:(1)CO2+H2O=H2CO3;
(2)④。
16.有 X,Y,Z 三种元素,它们的原子核内质子数均不超过 18,它们能相互形成 XZ 和
YZ 型化合物,X2+和氖原子的核外电子排布相同;Y 原子和 X2+的电子层数相同,但比 Z
原子少 2 个电子,Y 原子的最外层电子数是次外层的 2 倍.试求:
(1)X,Y,Z 原子核内的质子数 12、6、8 .
(2)若 X,Y,Z 的原子核内的质子数与中子数均相等,则化合物 XYZ3,的相对分子质
量是 84 .
【解答】解:(1)核外电子在分层排布时,应遵循各电子层最多容纳电子数 2n2(n 为电
子层数,且最外层电子数不超过 8 个,次外层电子数不超过 18 个).由题意知:X2+和氖
原子的核外电子排布相同,可推知 x 为镁元素,其原子核内质子数为 12;Y 原子和 X2+
的电子层数相同,也就是和 Mg2+的电子层数相同,可知 Y 原子的电子层数为 2,又知 Y
原子的最外层电子数是次外层的 2 倍,可推知 Y 的核电荷数是 6,Y 是碳元素,其原子
核内质子数为 6;Y 原子比 Z 原子少 2 个电子,推知 Z 为氧元素,其原子核内质子数为 8;
(2)由(1)可知 X、Y、Z 原子核内质子数分别为:12、6、8,又 X,Y,Z 的原子核
内的质子数与中子数均相等,则 XYZ 的相对原子质量分别为:24、12、16;
根据:相对分子质量=相对原子质量与相应原子个数的乘积和,化合物 XYZ3 的相对分
子质量=24+12+16×3=84.
故答案为:
(1)12、6、8;
(2)84.
17.平安和健康是幸福生活的前提,科技可以帮助我们更好地保持平安和健康。
(1)某些汽车配置的安全气囊内有叠氮化钠(NaN3)。它是由钠离子和叠氮根离子构成。
据此写出叠氮化铜的化学式 Cu(N3)2 ;
(2)在抗疫一线,卫生部使用了负压救护车。负压就是利用技术手段,使车内气压低于
外界大气压,所以空气在自由流动时只能由车外向内流动。下列例子中,同样处于负压
状态的是 C 。
A.充完气的轮胎 B.高空飞行中的飞机机舱 C.正在工作的吸尘器 D.烧
煮食物的高压锅
【解答】解:(1)叠氮化钠(NaN3)是由钠离子和叠氮根离子构成,叠氮根离子为﹣1
价,则形成叠氮化铜的化学式为:Cu(N3)2,故填:Cu(N3)2。
(2)A.充完气的汽车轮胎内的气压大于大气压,不处于负压状态,故错误;
B.高空飞行中的飞机机舱外气体流速大、压强小,小于机舱内的气压,不处于负压状态,
故错误;
C.正在工作的吸尘器,内部压强减小,小于外界的大气压,处于负压状态,故正确;
D.烧煮食物的高压锅的气压大于大气压,不处于负压状态,故错误。
故选 C。
18.温室效应(英文:GreenhouseEffect),又称“花房效应”,是大气保温效应俗称,而二氧
化碳是数量最多的温室气体,约占大气总容量的 0.03%,其分子式为 CO2,化学结构式
为:16O=C=16O;最近据国外媒体报道,“火星快车”号和“金星快车”号探测器日前分别
在火星和金星大气层中发现了一种非常特殊的气态化合物,这种化合物的存在不但会导
致金星上的温室效应被成倍的放大,而且可能会在火星上也诱发温室效应的产生。它的
结构式为:16O=C=18O,请你结合所学知识分析作答:
(1)16O=C=16O 与 16O=C=18O 互为同位素吗?为什么? 不是互为同位素;16O=C
=16O 与 16O=C=18O 不是互为同位素,因为它们不是同种元素的不同原子 ;
(2)相同质量的 16O=C=16O 分子与 16O=C=18O 分子所含的氧元素质量之比为 184:
187 。
【解答】解:(1)同位素是指具有相同质子数而中子数不同的原子之间的互称,所以 16O
=C=16O 与 16O=C=18O 不是互为同位素,因为它们不是同种元素的不同原子;故填:
不是互为同位素;16O=C=16O 与 16O=C=18O 不是互为同位素,因为它们不是同种元
素的不同原子;
(2)相同质量的 16O=C=16O 分子与 16O=C=18O 分子所含的氧元素质量之比
� �㈠
ΨΨ �
�ͲͲͲ
:
�Ψ
Ψ� � �ͲͲͲ �
184:187.故填:184:187。
三.计算题(共 2 小题)
19.我国的“长征”系列运载火箭的第一、第二级燃料多数采用偏二甲肼(C2H8N2)和四氧
化二氮(N2O4)的“二元推进剂”。请回答下列问题:
(1)偏二甲肼(C2H8N2)由 三 种元素组成。
(2)偏二甲肼中 C、H、N 元素质量比为 6:2:7 。
(3)120kg 偏二甲肼中含氮量与质量为多少千克四氧化二氮的含氮量相同? 184kg 。
【解答】解:(1)由化学式可知,偏二甲肼(C2H8N2)由碳、氢、氧三种元素组成;故
填:三;
(2)偏二甲肼中 C、H、N 元素质量比为:(12×2):(1×8):(14×2)=6:2:7;故填:
6:2:7;
(3)设四氧化二氮的质量为 x,则:
120kg
� �Ψ�㈠
�㈠�㈠晦���晦�Ψ�㈠ � �ͲͲͲ �
x
� �Ψ�㈠
�Ψ�㈠晦���Ψ � �ͲͲͲx=184kg
故填:184kg。
20.有 X、Y、Z 三种元素,它们的原子序数依次增大,且都大于 10 小于 18,价电子数之
和为 10,它们的最高价氧化物的水化物,任意两种都能反应生成盐和水,M 元素原子的
L 电子层上有 4 个电子,试写出:
(1)X、M 的元素名称:X 钠 、M 碳 ;
(2)Z 原子的原子结构示意图: ;
(3)M 的氧化物与 X 的最高价氧气物对应的水化物反应的化学方程式: CO2+2NaOH
=Na2CO3+H2O ;
(4)X、Y、Z 的最高价氧气物的水化物之间两两反应的化学方程式分别为(不按顺序):
NaOH+Al(OH)3=NaAlO2+2H2O;Al(OH)3+H2SO4=Al2(SO4)3+6H2O .
【解答】解:X、Y、Z 三种元素,它们的原子序数依次增大,且都大于 10 小于 18,价
电子数之和为 10,它们的最高价氧化物的水化物,任意两种都能反应生成盐和水,则 Y
为铝,X 为钠,Z 的最外层电子数为 10﹣1﹣3=6,则 Z 为硫;M 元素原子的 L 电子层
上有 4 个电子,故 M 为碳.故:
(1)X 是钠元素,M 是碳元素;(2)Z 原子的原子结构示意图为: ;
(3)M 的氧化物为二氧化碳,X 的最高价氧气物对应的水化物为氢氧化钠,反应的方程
式为:CO2+2NaOH=Na2CO3+H2O;
(4)X、Y、Z 的最高价氧气物的水化物分别为:NaOH、Al(OH)3、H2SO4,反应的
方程式为:NaOH+Al(OH)3=NaAlO2+2H2O;Al(OH)3+H2SO4=Al2(SO4)3+6H2O.
故答案为:
(1)钠、碳;
(2) ;
(3)CO2+2NaOH=Na2CO3+H2O;
(4)NaOH+Al(OH)3=NaAlO2+2H2O;Al(OH)3+H2SO4=Al2(SO4)3+6H2O.