- 617.13 KB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
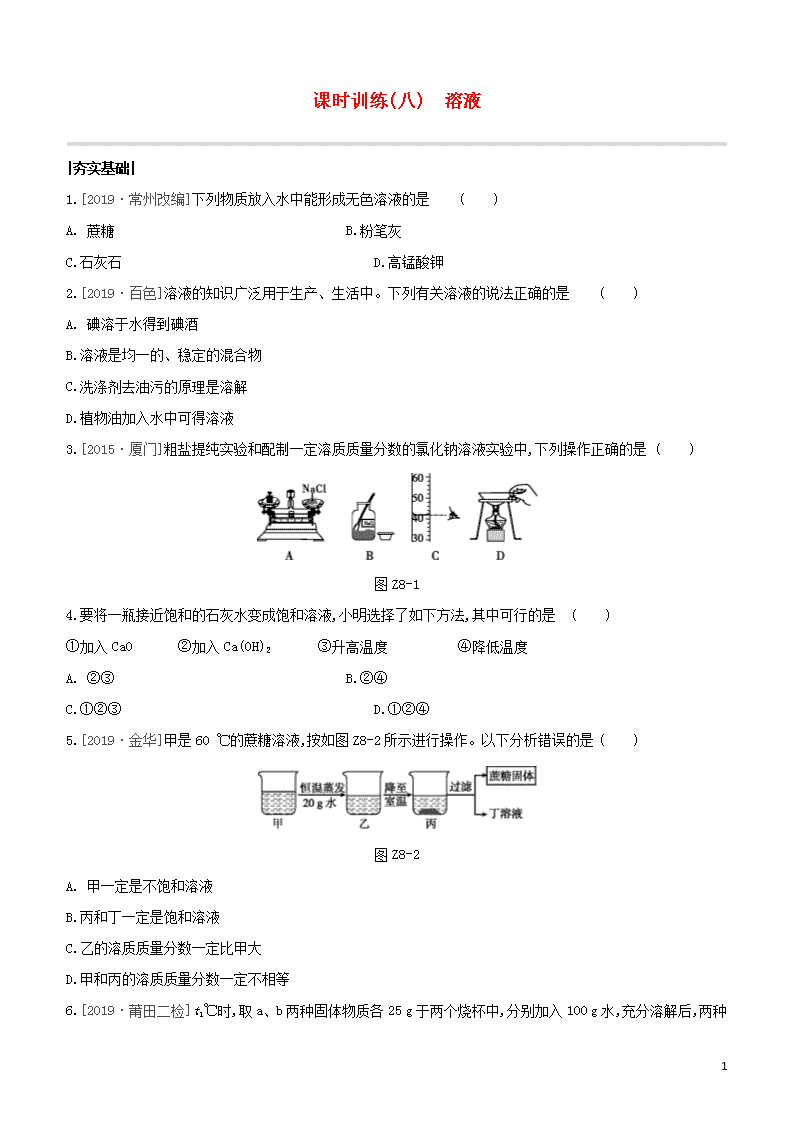
课时训练(八) 溶液
|夯实基础|
1.[2019·常州改编]下列物质放入水中能形成无色溶液的是 ( )
A. 蔗糖 B.粉笔灰
C.石灰石 D.高锰酸钾
2.[2019·百色]溶液的知识广泛用于生产、生活中。下列有关溶液的说法正确的是 ( )
A. 碘溶于水得到碘酒
B.溶液是均一的、稳定的混合物
C.洗涤剂去油污的原理是溶解
D.植物油加入水中可得溶液
3.[2015·厦门]粗盐提纯实验和配制一定溶质质量分数的氯化钠溶液实验中,下列操作正确的是 ( )
图 Z8-1
4.要将一瓶接近饱和的石灰水变成饱和溶液,小明选择了如下方法,其中可行的是 ( )
①加入 CaO ②加入 Ca(OH)2 ③升高温度 ④降低温度
A. ②③ B.②④
C.①②③ D.①②④
5.[2019·金华]甲是 60 ℃的蔗糖溶液,按如图 Z8-2 所示进行操作。以下分析错误的是 ( )
图 Z8-2
A. 甲一定是不饱和溶液
B.丙和丁一定是饱和溶液
C.乙的溶质质量分数一定比甲大
D.甲和丙的溶质质量分数一定不相等
6.[2019·莆田二检]t1℃时,取 a、b 两种固体物质各 25 g 于两个烧杯中,分别加入 100 g 水,充分溶解后,两种
2
固体均有剩余。升温到 t2℃时,a 完全
溶解,b 固体增多。a、b 两种物质的溶解度曲线如图 Z8-3。下列判断正确的是 ( )
图 Z8-3
A. 图中曲线 M 表示物质 b 的溶解度曲线
B.t1℃时,两个烧杯中剩余固体的质量不相等
C.t2℃时,两个烧杯中的溶液都是饱和溶液
D.t2℃时,两个烧杯中溶液的溶质质量分数相同
7.为研究物质的溶解现象,设计并进行了如下实验。
实验
现象 固体溶解,形成紫色溶液 固体几乎不溶解 固体溶解,形成紫红色溶液
(1)对比实验①②的现象,可得出的结论是 。
(2)设计实验②③的目的是 。
8.[2019·厦门二检]兴趣小组对粗盐进行提纯,并配制 NaCl 溶液。实验流程如图 Z8-4:
图 Z8-4
(1)操作③的名称是 。
(2)操作①②③都要用到的一种玻璃仪器是 ,在操作②中,这种玻璃仪器的作用是 。
(3)计算精盐的产率,结果偏低,可能的原因是 (写一种)。
(4)配制 100 g 6%的 NaCl 溶液,若实际配得的溶液溶质质量分数偏大,可能的原因是 (填序号)。
a.称量 NaCl 所用天平砝码已生锈 b.用量筒取水时俯视读数
c.用量筒取水时仰视读数 d.用残留蒸馏水的烧杯配制溶液
(5)欲配制 20 g 质量分数为 3%的 NaCl 溶液,需要 6%的 NaCl 溶液 mL(假设 NaCl 溶液的密度均为 1.0
g·cm-3)。
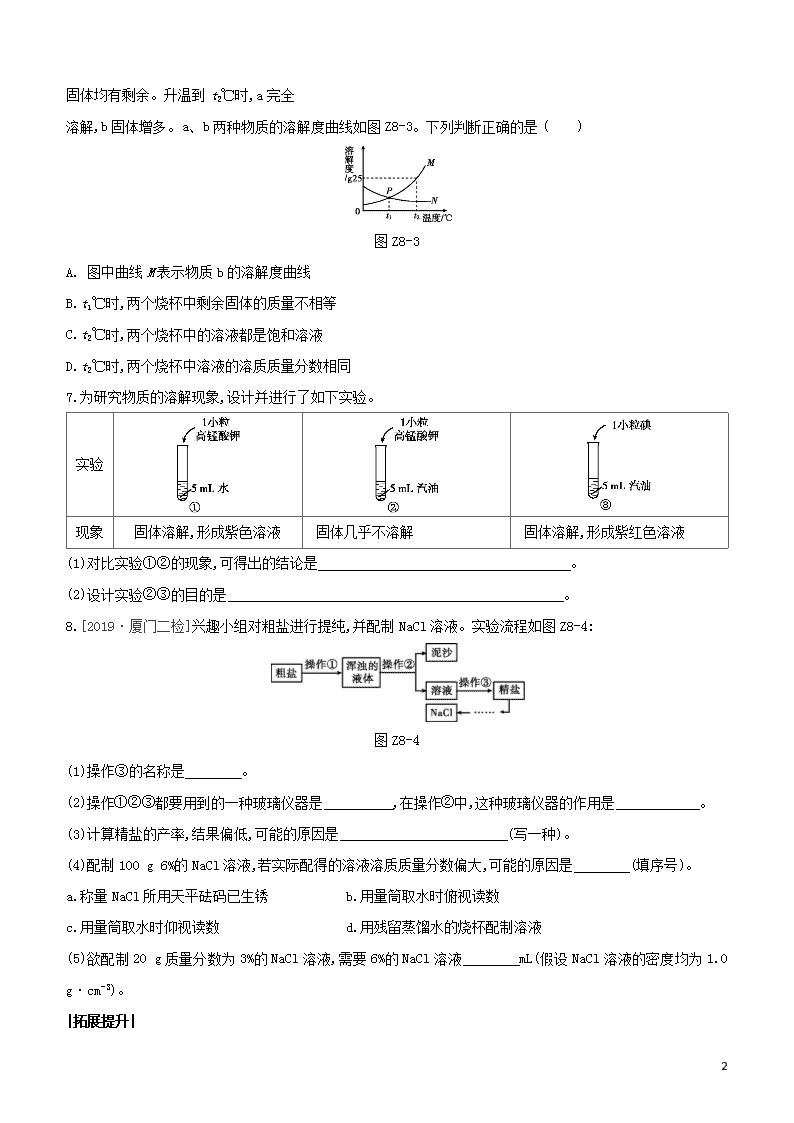
|拓展提升|
3
1.[2018·江西]t2℃时,向盛有 10 g 水的烧杯中加入 13 g 固体甲,搅拌后固体完全溶解,放置一段时间后,溶液
中有固体析出,甲的溶解度曲线如图 Z8-5 所示。下列说法正确的是 ( )
图 Z8-5
A. 图中 P 点表示甲的溶解度为 98 g
B.搅拌的目的是增大甲的溶解度
C.通过升温可以将甲的不饱和溶液变为饱和溶液
D.甲溶于水的过程中一定放出热量
2.[2019·泸州]以下是 Na2CO3、NaHCO3 的溶解度表,下列说法中错误的是 ( )
温度/℃ 0 10 20 30 40 50 60
Na2CO3 的溶解度/g 7.1 12.5 21.5 39.7 49.0 48.5 46.0
NaHCO3 的溶解度/g 6.9 8.1 9.6 11.1 12.7 14.5 16.4
A. 40 ℃的饱和 Na2CO3 溶液升温到 60 ℃会析出晶体
B.60 ℃的 NaHCO3 溶液蒸干并充分灼烧,可得到 NaHCO3 晶体
C.30 ℃的溶质质量分数为 25%的 Na2CO3 溶液降温到 20 ℃,会有晶体析出
D.20 ℃的饱和 Na2CO3 溶液中通入足量的 CO2,生成的 NaHCO3 会部分析出
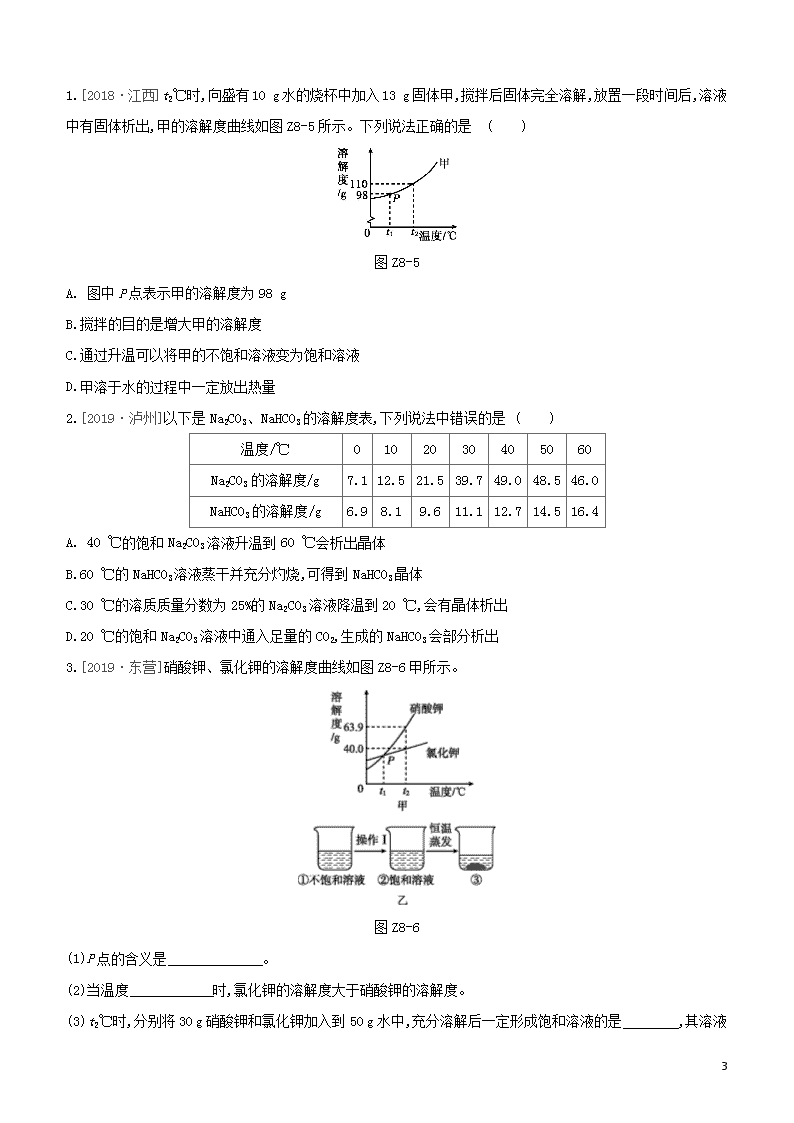
3.[2019·东营]硝酸钾、氯化钾的溶解度曲线如图 Z8-6 甲所示。
图 Z8-6
(1)P 点的含义是 。
(2)当温度 时,氯化钾的溶解度大于硝酸钾的溶解度。
(3)t2℃时,分别将 30 g 硝酸钾和氯化钾加入到 50 g 水中,充分溶解后一定形成饱和溶液的是 ,其溶液
4
的溶质质量分数为 (结果精确到 0.1%)。
(4)图乙是有关硝酸钾溶液的实验操作及变化情况。若保持溶液的质量不变,操作Ⅰ为 。
(5)下列有关说法不正确的是 。
A. ①与②的溶质质量可能相等
B.②与③的溶质质量分数一定相等
C.等温度、等质量的硝酸钾和氯化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量:硝酸钾>氯化钾
D.等温度、等质量的硝酸钾和氯化钾饱和溶液,降低相同的温度,析出的晶体质量:硝酸钾>氯化钾
4.[2019·福州二检]古籍《世本》中有“夙沙氏煮海为盐”的记载,开创华夏制盐历史之先河。已知海水在浓
缩过程中析出盐的种类和递增质量如下表(表中为每升海水析出各种盐的质量,单位 g/L)所示:
海水密度
(g/mL)
硫酸钙 氯化钠 氯化镁 硫酸镁 溴化钠
1.20 0.91
1.21 0.05 3.26 0.004 0.008
1.22 0.015 9.65 0.01 0.04
1.26 0.01 2.64 0.02 0.02 0.04
(1)获得食盐晶体宜采用蒸发结晶的方法,原因是 。
(2)往海水样品中加入肥皂水,产生大量浮渣,则海水属于 (填“硬水”或“软水”)。
(3)海水浓缩过程中,最先达到饱和状态的是 溶液。
(4)海水密度从 1.20 g/mL 浓缩到 1.22 g/mL 时,下列说法正确的是 (填序号)。
A. 各种盐的溶解度减小
B.海水中溴化钠的质量分数不变
C.析出粗盐中氯化钠的质量分数增大
(5) 可 将 氯 气 通 入 溴 化 钠 (NaBr) 溶 液 中 , 生 成 溴 (Br2) 和 氯 化 钠 , 该 反 应 所 属 的 基 本 反 应 类 型
为 。
5
【参考答案】
夯实基础
1.A [解析]蔗糖易溶于水,放入水中,可形成无色溶液;粉笔灰、面粉放入水中形成悬浊液;花生油不溶于水,
放入水中形成乳浊液。
2.B [解析]碘溶于酒精得到碘酒,故 A 错误;溶液是一种或一种以上的物质分散到另一种物质中,形成的均一
的、稳定的混合物,故 B 正确;洗涤剂去油污的原理是洗涤剂对油脂有乳化作用,C 错误;植物油加入水中不能
得到溶液,只能得到乳浊液。
3.C
4.C [解析]氢氧化钙的溶解度随温度的升高而减小,因此将接近饱和的石灰水变成饱和溶液可采用升温的方
法;或加入溶质氢氧化钙;或加入氧化钙与水反应,使溶质氢氧化钙的质量增加,溶剂水的质量减少。
5.D [解析]甲溶液恒温蒸发 20 g 水后没有晶体析出,则甲溶液一定是不饱和溶液,故 A 正确;丙溶液中有固体
剩余,丁溶液是过滤后所得溶液,所以丙和丁一定都是饱和溶液,故 B 正确;甲溶液恒温蒸发 20 g 水后,乙溶液
中没有晶体析出,溶液中的溶剂减少,所以乙溶液的溶质质量分数一定比甲大,故 C 正确;无法确定甲溶液和丙
溶液中的溶质质量分数大小,故 D 错误。
6.C
7.(1)同种溶质在不同溶剂中的溶解性不同
(2)探究不同溶质在同种溶剂中的溶解性是否相同
[解析]对比实验的重点是控制单一变量。
8.(1)蒸发
(2)玻璃棒 引流
(3)搅拌时有溶液溅出(合理即可)
(4)ab (5)10.0
拓展提升
1.D
2.B [解析]Na2CO3 40 ℃时的溶解度大于 60 ℃时的溶解度,所以 40 ℃的饱和 Na2CO3 溶液升温到 60 ℃会有晶
体析出;NaHCO3 晶体受热易分解生成碳酸钠,所以 60 ℃的 NaHCO3 溶液蒸干并充分灼烧,不能得到 NaHCO3 晶
体;20 ℃时Na2CO3饱和溶液的溶质质量分数为 21.5g
100g + 21.5g×100%≈17.7%<25%,所以30 ℃的溶质质量分数为25%
的 Na2CO3 溶液降温到 20 ℃,会有晶体析出;根据 Na2CO3+CO2+H2O 2NaHCO3 可知反应生成碳酸氢钠的质量大于
反应的碳酸钠质量,因为 20 ℃时碳酸钠的溶解度大于碳酸氢钠的溶解度,所以 20 ℃的饱和 Na2CO3溶液中通入
足量的二氧化碳后,生成的 NaHCO3 会部分析出。
6
3.(1)t1℃时,硝酸钾和氯化钾的溶解度相等
(2)小于 t1℃
(3)氯化钾(或 KCl) 28.6%
(4)降低温度
(5)C
[解析](1)根据溶解度曲线的意义可知,P 点的含义为 t1℃时,硝酸钾和氯化钾的溶解度相等。(2)由溶解度曲
线可知,当温度小于 t1℃时,氯化钾的溶解度大于硝酸钾的溶解度。(3)t2℃时,硝酸钾的溶解度是 63.9 g,氯化
钾的溶解度是 40.0 g,分别将 30 g 硝酸钾和氯化钾加入到 50 g 水中,由溶解度的含义可知,充分溶解后一定形
成饱和溶液的是氯化钾,其溶液的溶质质量分数为 40g
40g + 100g≈28.6%。(4)图乙是有关硝酸钾溶液的实验操作及
变化情况。由于硝酸钾的溶解度随温度的升高而增大,若保持溶液的质量不变,操作Ⅰ为降低温度。(5)若溶液
的质量不变,①与②的溶质质量可能相等;由图可知,②与③都是同一温度下的饱和溶液,溶质质量分数一定相
等;不同温度时硝酸钾和氯化钾的溶解度大小情况不同,由于没有指明温度,所以等温度、等质量的硝酸钾和氯
化钾饱和溶液,恒温蒸发等质量的水,析出的晶体质量的多少无法判断;根据溶解度曲线可知,硝酸钾的溶解度
受温度变化影响较大,氯化钾的溶解度受温度变化影响较小,所以等温度、等质量的硝酸钾和氯化钾饱和溶液,
降低相同的温度,析出的晶体质量:硝酸钾>氯化钾。
4.(1)氯化钠的溶解度受温度变化的影响较小
(2)硬水 (3)硫酸钙
(4)C (5)置换反应