- 707.73 KB
- 2021-11-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
11
课时
物质的变化和性质
化学
|
第一部分 考点过关
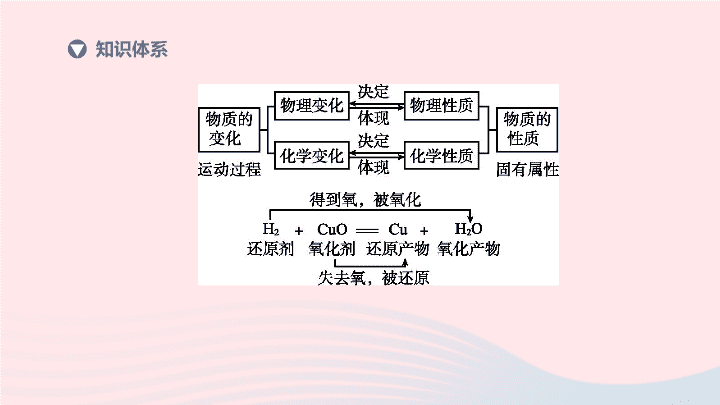
知识体系
物理变化
化学变化
概念
的变化
生成
的变化
现象
通常在外形、状态等方面发生改变
常伴随发光、放热、颜色变化、生成气体、产生沉淀等现象
1.
物质的物理变化和化学变化
(1)
描述物理变化和化学变化
重点梳理
没有生成新物质
有新物质
(
续表
)
物理变化
化学变化
本质
区别
宏观上:物质种类没有变化
微观上:构成物质的微粒本身没有改变,改变的是微粒的间隔
宏观上:物质种类发生变化
微观上:构成物质的微粒的组成或结构发生了改变
联系
化学变化和物理变化往往同时发生
.
化学变化过程中
(
填
“
一定
”
或
“
不一定
”)
同时发生物理变化;物理变化过程中不一定同时发生化学变化
一定
(2)
列举和区别常见物质的物理变化和化学变化
物理变化
化学变化
举例
水的三态变化、铁丝弯曲
镁条燃烧、铁钉生锈
判断依据
没有生成新物质
生成新物质
2.
物质主要的物理性质和化学性质
(1)
描述物质主要的物理性质和化学性质
①物理性质:物质
发生化学变化就表现出来的性质
.
如颜色、状态、气味、密度、熔点、沸点、比热容、硬度、溶解性、挥发性、延展性、吸附性、导电性、导热性、铁磁性等
.
②化学性质:物质在
中表现出来的性质
.
如助燃性、可燃性、稳定性、氧化性、还原性、酸碱性、毒性等
.
不需要
化学变化
(2)
辨认物理性质和化学性质
①物理性质和化学性质的根本区别在于物质的性质是否需要通过
表现出来
.
②物质的性质和变化的联系和区别
a.
性质和变化是两个不同的概念,性质是物质具有的特征,变化是物质的某种运动过程
.
b.
性质和变化是密切相关的
.
性质是物质发生变化的内因,性质决定变化;而变化是性质的具体表现,在化学变化中才能体现出化学性质
.
c.
区分某一叙述是指物质的性质还是变化,需注意抓住关键字,如
“
能
”
“
会
”“
可以
”
等,则指的是物质的某种性质
.
化学变化
(3)
举例说明外界条件
(
如温度、压强等
)
能影响物质的性质
外界条件能影响物质的性质,如温度改变,物质的溶解度会发生变化,如压强改变,物质的沸点会发生变化
.
3.
氧气的氧化性以及氢气、一氧化碳的还原性和可燃性
(1)
能举例说出氧化反应和说明氧气具有氧化性
①物质与氧
(
包括氧气和含氧化合物
)
发生的反应,属于
反应
.
②在氧化反应中,氧气是氧化剂,具有
性
.
(2)
能举例说出还原反应和说明氢气和一氧化碳具有还原性
①含氧化合物里的氧被夺去的反应,属于
反应
.
②在还原反应中,得到氧的物质叫还原剂,具有
性;常见的还原剂有
、
和
等
.
如炼铁的原理:
Fe
2
O
3
+3CO 2Fe+3CO
2
.
其中
Fe
2
O
3
是
剂,具有
性;
CO
是
剂,具有
性
.
氧化
氧化
还原
还原
碳
一氧化碳
氢气
氧化
氧化
还原
还原
③常见的还原剂还原氧化铜实验
(续表)
(3)
说出氢气和一氧化碳的可燃性,能根据它们的燃烧产物来鉴别氢气和一氧化碳
①氢气和一氧化碳具有可燃性,点燃它们之前,需要进行
.
②根据燃烧产物来鉴别氢气和一氧化碳
③可以利用氢气和一氧化碳还原金属氧化物,然后通过氧化产物对它们进行鉴别
.
物质
操作
现象
氢气
原来干冷的烧杯内壁出现水珠,倒置烧杯,注入澄清石灰水,振荡后石灰水不变浑浊
一氧化碳
烧杯内壁保持干燥,倒置烧杯,注入澄清石灰水,振荡后石灰水变浑浊
验纯
对点练习
考点
1
物质的物理变化和化学变化
1.
人们通过化学变化改造物质世界,并实现物质与能量的相互转化
.
化学变化中生成的新物质是指
(
)
A.
分子分成原子,生成新的元素
B.
原子重新组合,生成新的原子
C.
生成了组成或结构与原物质不同的物质
D.
生成了组成和结构与原物质相同的物质
C
2.
[2019·
通辽
]
日常生活中的下列做法,一定会有化学变化的是
(
)
A.
用汽油除油污
B.
用食醋除水垢
C.
用西瓜榨汁
D.
用玻璃刀切割玻璃
B
考点
2
物质主要的物理性质和化学性质
A
3.
[2019·
无锡
]
下列物质的用途仅与其物理性质有关的是
(
)
A.
活性炭作吸附剂
B.
稀盐酸作除锈剂
C.
铁粉作脱氧剂
D.
生石灰作干燥剂
4.
下面几种物质的具体应用,分别利用的性质是:
(1)
干冰用于人工降雨:
.
(2)“
金粉
”(
黄铜粉
)
用于装帧烫金:
.
(3)
紫甘蓝汁液用作酸碱指示剂:
.
(4)
浓硫酸用作干燥剂:
.
易升华
具有特殊的颜色和金属光泽
遇酸、碱发生特定的颜色变化
具有吸水性
考点
3
氧气的氧化性以及氢气、一氧化碳的还原性和可燃性
5.
[2019·
巴中
]
化学实验小组利用以下装置测定某赤铁矿中氧化铁的纯度,向赤铁矿中通入纯净的一氧化碳气体,假设赤铁矿中杂质不参与反应
.
请回答下列问题
.
图
H11-1
(1)
实验开始时,先进行的操作是
(
填序号
).
①通入一氧化碳
②加热
(2)
实验过程中观察到装置
A
中玻璃管内发生的现象
:
.
①
红色固体逐渐变为黑色
5.
[2019·
巴中
]
化学实验小组利用以下装置测定某赤铁矿中氧化铁的纯度,向赤铁矿中通入纯净的一氧化碳气体,假设赤铁矿中杂质不参与反应
.
请回答下列问题
.
图
H11-1
(3)
写出
B
装置发生的化学反应方程式:
;
装置
C
的作用是
___________________________________________________________
.
(4)
从环境保护的角度看,现实验存在的缺陷是
.
CO
2
+2NaOH Na
2
CO
3
+H
2
O
防止空气中的二氧化碳进入装置
B
中,影响赤铁矿中氧化铁纯度的测定
没有尾气处理装置
5.
[2019·
巴中
]
化学实验小组利用以下装置测定某赤铁矿中氧化铁的纯度,向赤铁矿中通入纯净的一氧化碳气体,假设赤铁矿中杂质不参与反应
.
请回答下列问题
.
图
H11-1
(5)
实验前称量赤铁矿的质量为
20 g
,通入足量的一氧化碳完全反应后
B
装置总质量增加了
13.2 g.
则赤铁矿中氧化铁的纯度为
.
80%
6.
某化学兴趣小组利用如图
H11-2
所示装置进行实验,探究工业炼铁的化学原理,试按要求回答下列问题
.
图
H11-2
(1)
硬质玻璃管中观察到的现象是
,写出一氧化碳和氧化铁反应的化学方程式:
.
(2)
实验时首先通入一氧化碳的目的是
______________________________________
.
红色固体变为黑色
3CO+Fe
2
O
3
2Fe+3CO
2
排尽玻璃管内的空气,防止加热时发生
爆炸
6.
某化学兴趣小组利用如图
H11-2
所示装置进行实验,探究工业炼铁的化学原理,试按要求回答下列问题
.
图
H11-2
(3)
装置中导管末端加一点燃的酒精灯的目的是
_____________________________
.
除去多余的
CO
,防止污染
空气
例
1
充有钠蒸气的高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明
.
钠的化学性质活泼,常温下可以与氧气、水反应,在实验室里,金属钠保存在煤油中,用镊子从煤油中取出金属钠,放在滤纸上,用小刀切下一小块,投入盛有水
(
滴有酚酞试液
)
的烧杯中,发现钠块浮在水面上,很快熔化成银白色小球,四处游动,发出嘶嘶的响声,偶有火星出现,溶液变成红色
.
依据提供的信息,回答下列问题
.
(1)“
钠保存在煤油中
”
说明钠具有的化学性质是
.
(2)“
钠块浮在水面上
”
说明钠具有的物理性质是
.
重点一 区别和辨认物理变化和化学变化、物理性质和化学性质
常温下可以与氧气、水反应
图
H11-3
钠的密度比水的密度小
例
1
充有钠蒸气的高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明
.
钠的化学性质活泼,常温下可以与氧气、水反应,在实验室里,金属钠保存在煤油中,用镊子从煤油中取出金属钠,放在滤纸上,用小刀切下一小块,投入盛有水
(
滴有酚酞试液
)
的烧杯中,发现钠块浮在
水面上,很快熔化成银白色小球,四处游动,发出嘶嘶的
响声,偶有火星出现,溶液变成红色
.
依据提供的信息,
回答下列问题
.
(3)“
溶液变成红色
”
说明钠与水反应的生成物中含有
性的物质
.
(4)
根据所学知识解释钠
“
熔化成银白色小球
”
的原因是
.
碱
图
H11-3
钠的熔点低
重点二 能说明氧气的氧化性和氢气、一氧化碳具有还原性
例
2
[2017·
杭州
]
小金利用图
H11-4
所示装置进行甲、乙对比实验,探究温度对
CO
和
Fe
2
O
3
反应的影响
(
固定装置略
).
图
H11-4
(1)
从实验安全角度考虑,图示装置还应采取的改进措施是
__________________
.
步骤
操作
甲组现象
乙组现象
1
称量黑色粉末质量
/g
m
1
m
2
2
取黑色粉末,用
磁铁吸引
能被吸引
能被吸引
3
取黑色粉末,
加入稀盐酸
全部溶解
,有
大量气泡
无
明显现象
4
取黑色粉末,
加入足
量
CuSO
4
溶液
有红色
物质生成
无
明显现象
在装置末端尖嘴导管处,放置一盏燃着的酒精灯
例
2
[2017·
杭州
]
小金利用图
H11-4
所示装置进行甲、乙对比实验,探究温度对
CO
和
Fe
2
O
3
反应的影响
(
固定装置略
).
图
H11-4
步骤
操作
甲组现象
乙组现象
1
称量黑色粉末质量
/g
m
1
m
2
2
取黑色粉末,用
磁铁吸引
能被吸引
能被吸引
3
取黑色粉末,
加入稀盐酸
全部溶解
,有
大量气泡
无
明显现象
4
取黑色粉末,
加入足
量
CuSO
4
溶液
有红色
物质生成
无
明显现象
(2)
完全反应后,两组的生成物均为黑色粉末
(
纯净物
)
,分别用两组生成物进行以下实验:
①甲组的黑色粉末与稀盐酸反应的化学方程式是
.
②小金查阅资料后发现
Fe
3
O
4
在常温下不与稀盐酸、
CuSO
4
溶液反应,故猜想乙组的生成物为
Fe
3
O
4
.
他又发现
m
2
恰好为
g
,这可成为支持上述猜想的新证据
.
(3)
甲、乙两组实验说明温度对
CO
和
Fe
2
O
3
反应有影响,且均体现出
CO
的
(
填写化学性质
).
Fe+2HCl FeCl
2
+H
2
↑
4.64
还原性和可燃性
重点三 氢气、一氧化碳等气体的鉴别
例
2
某混合气体可能含有
CO
、
H
2
、
CO
2
、
H
2
O(
气
)
中的一种或几种
.
为验证其组成,同学们进行实验的装置和现象如图
H11-5(
夹持仪器已省略,假设气体均吸收完全
)
:
图
H11-
5
结论
甲
乙
丙
含有
CO
、
H
2
、
H
2
O(
气
)
含有
CO
、
H
2
、
CO
2
含有
CO
、
H
2
、
CO
2
、
H
2
O(
气
)
(1)
仪器
a
的名称是
.
(2)
装置
D
中溶液变浑浊的化学方程式是
.
点燃尾气,火焰呈
色
.
图
H11-
5
锥形瓶
CO
2
+Ca(OH)
2
CaCO
3
↓
+H
2
O
蓝
例
2
某混合气体可能含有
CO
、
H
2
、
CO
2
、
H
2
O(
气
)
中的一种或几种
.
为验证其组成,同学们进行实验的装置和现象如图
H11-5(
夹持仪器已省略,假设气体均吸收完全
)
:
图
H11-
5
(3)
丁认为,由于他们对装置
(
填序号
)
中的实验现象分析不同而导致结论有差异
.
根据碳酸盐可转化为
CO
2
的性质,丁利用上述实验结束后装置内药品和某种常见试剂进行实验,证明了甲的结论是正确的
.
请写出丁的实验操作过程与现象:
A
将
A
中固体取出,加入烧杯
(
或试管
)
中,加入过量稀盐酸,无明显现象
1.
下列质量增加的变化有一种与其他三种存在本质的区别,这种变化是
(
)
A.
长期放置在空气中的氢氧化钠质量增加
B.
长期敞口放置的浓硫酸质量增加
C.
久置的生石灰质量增加
D.
久置的铁钉生锈质量增加
B
2.
[2018·
仙桃
]
亚硝酸钠
(NaNO
2
)
是一种工业用盐,人若误食会中毒
.
下列选项中给出了亚硝酸钠的性质,则有关亚硝酸钠性质归类的判断错误的是
(
)
A.NaNO
2
有咸味
——
物理性质
B.NaNO
2
的水溶液呈碱性
——
物理性质
C.NaNO
2
为白色固体
——
物理性质
D.NaNO
2
有毒
——
化学性质
B
3.
关于木炭、一氧化碳、氢气分别与氧化铜的反应,下列说法错误的是
(
)
A.
都有红色物质生成
B.
都有还原剂参加反应
C.
都是置换反应
D.
反应都需要加热或高温
C
4.
[2018·
杭州
]
图
H11-6
为氢气还原氧化铜的实验装置图
.
下列有关分析正确的是
(
)
A.
装置中试管口需略向下倾斜,主要是为了利于通入氢气
B.
在给试管内药品加热前,需先通氢气排尽试管内的空气
C.
待药品完全反应后,需同时撤去酒精灯和通氢气的导管
D.
该实验装置也可直接用于一氧化碳还原氧化铜的实验
B
图
H11-6
5.
图
H11-7
中甲是氢气和氧化铜反应的实验,图乙是木炭和氧化铁反应的实验
.
图
H11-7
(1)
在上述两个实验中,氢气和木炭表现出相同的化学性质是
性
.
(2)
实验步骤的先后次序非常重要,比如甲实验中,反应前必须先通氢气后点燃酒精灯,否则易发生爆炸;反应结束后必须先
,后
,否则生成的红色的铜会变成黑色
.
还原
移走酒精灯
停止通氢气
5.
图
H11-7
中甲是氢气和氧化铜反应的实验,图乙是木炭和氧化铁反应的实验
.
图
H11-7
(3)
某同学正确操作做完乙实验后,发现澄清石灰水变浑浊,试管中粉末全部变为黑色,取少量黑色粉末,加入足量稀硫酸充分振荡,但她惊讶地发现黑色粉末没有溶解,试管中也未产生预期的气泡,这说明该反应并没有生成
.
铁
(
或
Fe)
(4)
查阅资料,得到关于铁的氧化物的如下信息:
根据以上信息,试写出乙实验试管中反应的化学方程式
.
经分析后,该同学试着提高反应温度后,实验出现了预期的现象
.
图
H11-7
铁的氧化物化学式
Fe
2
O
3
Fe
3
O
4
FeO
颜色
红
黑
黑
化学性质
可溶于酸
常温下
不溶
于稀酸
可溶于酸
C+6Fe
2
O
3
4Fe
3
O
4
+CO
2
↑