- 290.21 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
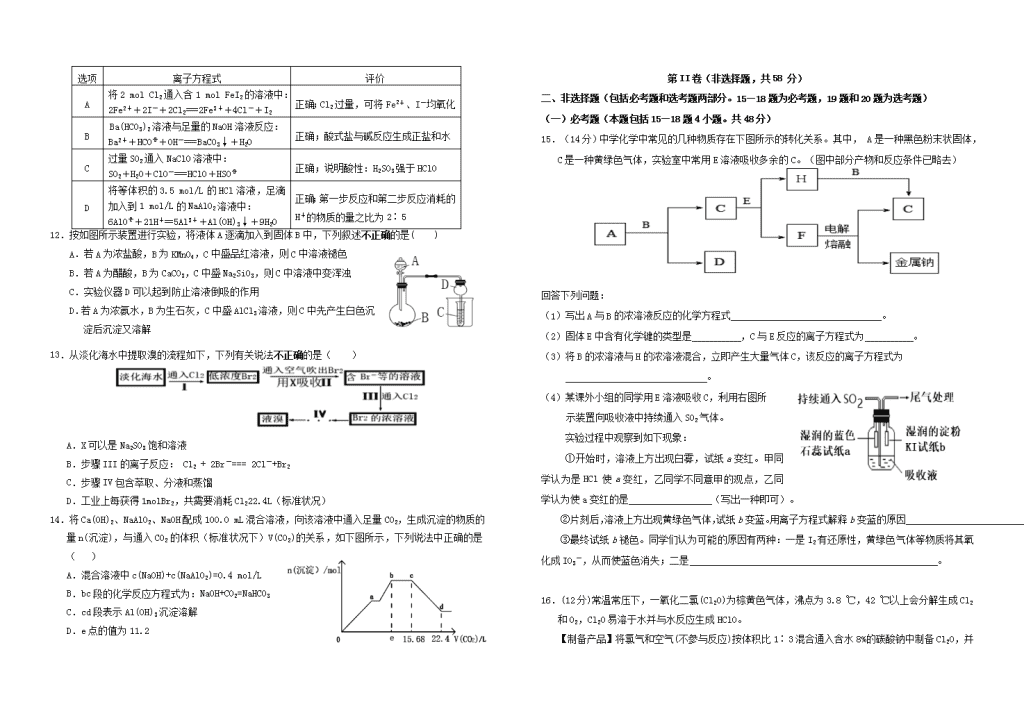
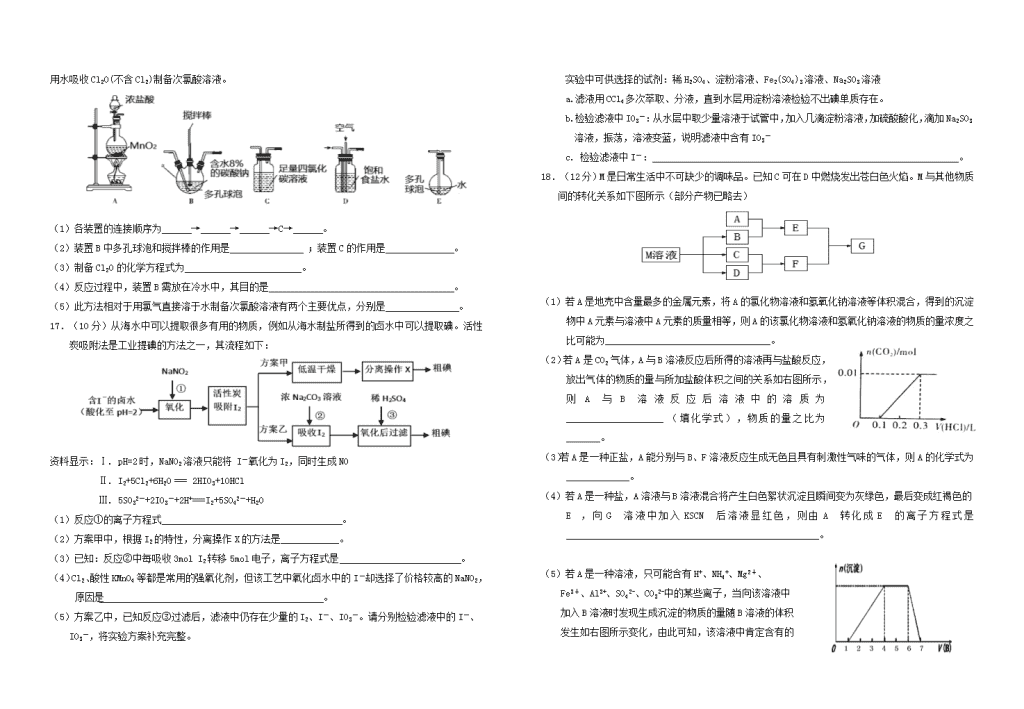
2019届“荆、荆、襄、宜四地七校考试联盟”高三10月联考化学试题本试卷分I卷(选择题)和II卷(非选择题)两部分,满分100分。考试用时90分钟可能用到的相对原子质量:H:1C:12N:14O:16Na:23Al:27Ca:40第I卷(选择题,共42分)一、选择题(本大题共14小题,每小题3分,共42分。每小题只有一个选项符合要求)1.化学与生活密切相关,下列有关说法不正确是()A.高纯度的二氧化硅可制作光导纤维,光导纤维可用作通讯材料是因为其有导电性B.《本草衍义》中的精制砒霜过程:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如针,尖长者为胜,平短者次之”,文中涉及的操作方法是升华C.CO2和氟氯烃等物质的大量排放会造成温室效应的加剧D.明矾能用于净水是因为铝离子水解生成的氢氧化铝胶体具有吸附性2.NA为阿伏加德罗常数的值,下列叙述中正确的是()A.标准状况下,11.2LSO3中含有的分子数目为0.5NAB.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NAC.标准状况下,6.72LNO2与水充分反应转移的电子数目为0.3NAD.200g46%的乙醇水溶液中,含H-O键的数目为2NA3.下列反应中,水只作氧化剂的是()①氟气通入水中 ②水蒸气经过灼热的焦炭 ③钠块投入水中 ④铁与水蒸气反应 ⑤氯气通入水中A.只有①④ B.只有①⑤ C.只有②③ D.只有②③④4.由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实能够说明这个结论的()A.已经制得了IBr、ICl等卤素互化物B.已经制得了I2O5等碘的氧化物C.已经制得了I(NO3)3、I(CIO4)3·H2O等含I3+离子的化合物D.碘易溶于KI等碘化物溶液,形成I3-离子。5.下列说法中正确的是()A.刚落下的酸雨随时间增加酸性逐渐增强,是由于雨水所含成分被不断氧化的原因。B.卤素元素从上到下,由于非金属性逐渐减弱,故氢卤酸的酸性依次减弱C.因为氧化性:HClO>稀H2SO4,所以非金属性:Cl>SD.钠原子在反应中失去的电子比铝原子少,故钠的金属性在理论上应弱于铝的金属性6.判断下列实验说法不正确的是()A.向FeCl3溶液中滴加KSCN溶液,溶液显红色,可用于检验Fe3+B.向FeSO4溶液中滴入K3[Fe(CN)6]溶液,生成蓝色沉淀,可用于检验Fe2+C.把饱和的FeCl3溶液煮沸至红褐色,可用于制备氢氧化铁胶体D.配制FeCl3溶液时,可先将FeCl3固体溶于盐酸中7.在前一种分散系中慢慢滴加后一种试剂,能观察到先沉淀后变澄清的是()①向氯化铝溶液中滴加氢氧化钠溶液②向偏铝酸钠溶液中加盐酸③向氢氧化钠溶液中滴加氯化铝溶液④向蛋白质溶液中滴入硫酸铜溶液⑤向氯化铝溶液中滴加氨水⑥向硝酸银溶液中滴加氨水⑦向氢氧化铁胶体中滴加硫酸A.①②⑥⑦B.②③⑤⑦C.①②⑥D.③④⑤⑥8.含硫单质的水可治皮肤病,而硫难溶于水,微溶于酒精,易溶于CS2,要增大硫在水中的分散程度,可将硫先放入溶剂X中,再将所得液体分散在水中,则X可以是( )A.CS2B.氯仿C.CCl4D.酒精9.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲乙丙。下列有关物质的推断不正确的是()A.若甲为NaOH溶液,则丁可能是AlCl3B.若甲为NH3,则丁可能是O2C.若甲为C,则丁可能是SiO2D.若甲为Fe,则丁可能是稀HNO310.某离子反应涉及到H2O、ClO﹣、NH4+、OH﹣、N2、Cl﹣等微粒,其中N2、ClO﹣的物质的量随时间变化的曲线如右图所示,下列说法正确的是()A.该反应中Cl﹣为氧化产物B.消耗1mol还原剂,转移6mol电子C.反应后溶液的碱性增强D.NH4+被ClO﹣氧化成N211.下列离子方程式的书写及评价,均合理的是()n选项离子方程式评价A将2molCl2通入含1molFeI2的溶液中:2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2正确;Cl2过量,可将Fe2+、I-均氧化BBa(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO+OH-===BaCO3↓+H2O正确;酸式盐与碱反应生成正盐和水C过量SO2通入NaClO溶液中:SO2+H2O+ClO-===HClO+HSO正确;说明酸性:H2SO3强于HClOD将等体积的3.5mol/L的HCl溶液,足滴加入到1mol/L的NaAlO2溶液中:6AlO+21H+==5Al3++Al(OH)3↓+9H2O正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶512.按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是( )A.若A为浓盐酸,B为KMnO4,C中盛品红溶液,则C中溶液褪色B.若A为醋酸,B为CaCO3,C中盛Na2SiO3,则C中溶液中变浑浊C.实验仪器D可以起到防止溶液倒吸的作用D.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解13.从淡化海水中提取溴的流程如下,下列有关说法不正确的是()A.X可以是Na2SO3饱和溶液B.步骤III的离子反应:Cl2+2Br-===2Cl-+Br2C.步骤IV包含萃取、分液和蒸馏D.工业上每获得1molBr2,共需要消耗Cl222.4L(标准状况)14.将Ca(OH)2、NaAlO2、NaOH配成100.0mL混合溶液,向该溶液中通入足量CO2,生成沉淀的物质的量n(沉淀),与通入CO2的体积(标准状况下)V(CO2)的关系,如下图所示,下列说法中正确的是()A.混合溶液中c(NaOH)+c(NaAlO2)=0.4mol/LB.bc段的化学反应方程式为:NaOH+CO2=NaHCO3C.cd段表示Al(OH)3沉淀溶解D.e点的值为11.2第II卷(非选择题,共58分)二、非选择题(包括必考题和选考题两部分。15—18题为必考题,19题和20题为选考题)(一)必考题(本题包括15—18题4小题。共48分)15.(14分)中学化学中常见的几种物质存在下图所示的转化关系。其中,A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C。(图中部分产物和反应条件已略去)回答下列问题:(1)写出A与B的浓溶液反应的化学方程式_______________________________。(2)固体E中含有化学键的类型是,C与E反应的离子方程式为。(3)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为。(4)某课外小组的同学用E溶液吸收C,利用右图所示装置向吸收液中持续通入SO2气体。实验过程中观察到如下现象:①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学认为使a变红的是(写出一种即可)。②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因。③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成IO3-,从而使蓝色消失;二是。16.(12分)常温常压下,一氧化二氯(Cl2O)为棕黄色气体,沸点为3.8℃,42℃以上会分解生成Cl2和O2,Cl2O易溶于水并与水反应生成HClO。【制备产品】将氯气和空气(不参与反应)按体积比1∶3混合通入含水8%的碳酸钠中制备Cl2O,n并用水吸收Cl2O(不含Cl2)制备次氯酸溶液。(1)各装置的连接顺序为→→→C→。(2)装置B中多孔球泡和搅拌棒的作用是;装置C的作用是。(3)制备Cl2O的化学方程式为。(4)反应过程中,装置B需放在冷水中,其目的是。(5)此方法相对于用氯气直接溶于水制备次氯酸溶液有两个主要优点,分别是。17.(10分)从海水中可以提取很多有用的物质,例如从海水制盐所得到的卤水中可以提取碘。活性炭吸附法是工业提碘的方法之一,其流程如下:资料显示:Ⅰ.pH=2时,NaNO2溶液只能将I-氧化为I2,同时生成NOⅡ.I2+5Cl2+6H2O===2HIO3+10HClⅢ.5SO32-+2IO3-+2H+===I2+5SO42-+H2O(1)反应①的离子方程式。(2)方案甲中,根据I2的特性,分离操作X的方法是____________。(3)已知:反应②中每吸收3molI2转移5mol电子,离子方程式是。(4)Cl2、酸性KMnO4等都是常用的强氧化剂,但该工艺中氧化卤水中的I-却选择了价格较高的NaNO2,原因是。(5)方案乙中,已知反应③过滤后,滤液中仍存在少量的I2、I-、IO3-。请分别检验滤液中的I-、IO3-,将实验方案补充完整。实验中可供选择的试剂:稀H2SO4、淀粉溶液、Fe2(SO4)3溶液、Na2SO3溶液a.滤液用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在。b.检验滤液中IO3-:从水层中取少量溶液于试管中,加入几滴淀粉溶液,加硫酸酸化,滴加Na2SO3溶液,振荡,溶液变蓝,说明滤液中含有IO3-c.检验滤液中I-:。18.(12分)M是日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质间的转化关系如下图所示(部分产物已略去)(1)若A是地売中含量最多的金属元素,将A的氯化物溶液和氢氧化钠溶液等体积混合,得到的沉淀物中A元素与溶液中A元素的质量相等,则A的该氯化物溶液和氢氧化钠溶液的物质的量浓度之比可能为__________________________________。(2)若A是CO2气体,A与B溶液反应后所得的溶液再与盐酸反应,放出气体的物质的量与所加盐酸体积之间的关系如右图所示,则A与B溶液反应后溶液中的溶质为____________________(填化学式),物质的量之比为_______。(3)若A是一种正盐,A能分别与B、F溶液反应生成无色且具有刺激性气味的气体,则A的化学式为_____________。(4)若A是一种盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入KSCN后溶液显红色,则由A转化成E的离子方程式是____________________________________________________。(5)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生如右图所示变化,由此可知,该溶液中肯定含有的离子为_______________________________。n(二)选考题(10分)(请考生从2道题中任选一题作答,并用2B铅笔在答题卡上把所选题目对应题号涂黑。注意所做题号与所涂题号一致,在答题卡区域指定位置作答,如果多做,按第一题计分)19.【化学—选修3:物质结构与性质】(10分)我国是世界上少数几个掌握研发制造大型客机能力的国家。(1)飞机的外壳通常采用镁、铝、钛合金材料,钛原子核外电子有种空间运动状态,第一电离能:镁铝(填“大于”或“小于”)。(2)Fe与CO能形成配合物羰基铁[Fe(CO)5],该分子中σ键与π键个数比为。(3)SCl2分子中的中心原子杂化轨道类型是,该分子构型为 。(4)已知MgO与NiO的晶体结构相同(如下图),其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgONiO(填“>”、“<”或“=”)。(5)如下图所示,NiO晶胞中离子坐标参数A为(0,0,0),B为(1,0,1),则C离子坐标参数为。20.[化学一选修5:有机化学基础](10分)喹啉醛H是一种可用于制备治疗肿瘤药物的中间体。由烃A制备H的合成路线如下巳知:i.ii.反应④中,吡啶作稳定剂iii.RCCl3RCOOK;回答下列问题:(1)A的化学名称是__________________________。(2)①、⑥的反应类型分别为_______________、________________。(3)D为链状结构,分子中不含“—O—”结构,且不能发生银镜反应,其核磁共振氢谱为3组峰,峰面积比为3:2:1,D的结构简式为________________________。(4)下列有关G的说法正确的是________________(填标号)。a.经质谱仪测定,G只含有羧基、碳碳双键两种官能团b.属于萘的衍生物c.一定条件下可发生加聚反应d.可与少量Na2CO3溶液反应生成NaHCO3(5)X是H的同分异构体,两者环状结构相同,X环上的取代基与H的相同但位置不同,则X可能的结构有_____________种。2019届“荆、荆、襄、宜四地七校考试联盟”高三十月联考化学试题参考答案1-14题每题3分,共42分1-5ABDCA6-10CADCD11-14DDDDn△15.(14分)(1)MnO2+4HCl(浓)===MnCl2+Cl2↑+2H2O(2分)(2)离子键、极性键(或者共价键)(2分,答对一种给1分)Cl2+2OH-===Cl-+ClO-+H2O(2分)(3)ClO-+Cl-+2H+===Cl2↑+H2O(2分)(4)①SO2(或H2SO3)(2分)②Cl2+2I-===2Cl-+I2(2分)(注:多写制氯气的方程式不扣分)③I2有氧化性,SO2能将I2还原成I-,从而使蓝色消失(2分)16.(12分)(1)A→D→B→C→E(2分)(2)增大反应物接触面积,使反应充分进行,加快反应速率;(2分)除去Cl2O中的Cl2。(2分)(3)2Cl2+Na2CO3=Cl2O+2NaCl+CO2(或者2Cl2+Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3)(2分)(4)防止反应放热后温度过高导致Cl2O分解。(2分)(5)制得的次氯酸溶液纯度较高,浓度较大。(2分,答对一个给一分)17.(10分)(1)2NO2-+2I-+4H+===I2+2NO↑+2H2O(2分)(2)升华或加热、冷凝结晶(无冷凝结晶不扣分)(2分)(3)3I2+3CO32-===5I-+IO3-+3CO2↑或3I2+6CO32-+3H2O===5I-+IO3-+6HCO3-(2分)(4)氯气、酸性高锰酸钾等都是常用的强氧化剂,会继续氧化I2(或亚硝酸钠仅能把碘离子氧化成碘单质,意思对即可)(2分)(5)另从水层中取少量溶液于试管中,加入几滴淀粉溶液,再滴加Fe2(SO4)3溶液,振荡,溶液变蓝,说明滤液中含有I-(2分)(必须强调从水层中取夜才能得分)18.(12分)(1)2:3或者2:7(2分)(答对1个给一分)(2)Na2CO3和NaHCO3(2分)1:1(2分)(3)(NH4)2SO3(2分)(4)4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓(或者分步写Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3)(2分)(5)H+、NH4+、Al3+、SO42-(2分)(注:离子顺序可以颠倒,漏写或者多写均为0分)19.(10分)(1)22(2分)大于(2分)(2)1∶1(1分)(3)sp3(1分)V形或角形或折线形(1分)(4)>(1分)(5)(1,,)或(1,0.5,0.5)(2分)20.(10分)(1)苯(2分)(2)取代反应、(1分)氧化反应(1分)(3)CH3COCH=CH2(2分)(4)c(2分)(5)6(2分)2019届“荆、荆、襄、宜四地七校考试联盟”高三十月联考化学试题参考答案1-14题每题3分,共42分1-5ABDCA6-10CADCD11-14DDDD△15.(14分)(1)MnO2+4HCl(浓)===MnCl2+Cl2↑+2H2O(2分)(2)离子键、极性键(或者共价键)(2分,答对一种给1分)Cl2+2OH-===Cl-+ClO-+H2O(2分)(3)ClO-+Cl-+2H+===Cl2↑+H2O(2分)n(4)①SO2(或H2SO3)(2分)②Cl2+2I-===2Cl-+I2(2分)(注:多写制氯气的方程式不扣分)③I2有氧化性,SO2能将I2还原成I-,从而使蓝色消失(2分)16.(12分)(1)A→D→B→C→E(2分)(2)增大反应物接触面积,使反应充分进行,加快反应速率;(2分)除去Cl2O中的Cl2。(2分)(3)2Cl2+Na2CO3=Cl2O+2NaCl+CO2(或者2Cl2+Na2CO3+H2O=Cl2O+2NaCl+2NaHCO3)(2分)(4)防止反应放热后温度过高导致Cl2O分解。(2分)(5)制得的次氯酸溶液纯度较高,浓度较大。(2分,答对一个给一分)17.(10分)(1)2NO2-+2I-+4H+===I2+2NO↑+2H2O(2分)(2)升华或加热、冷凝结晶(无冷凝结晶不扣分)(2分)(3)3I2+3CO32-===5I-+IO3-+3CO2↑或3I2+6CO32-+3H2O===5I-+IO3-+6HCO3-(2分)(4)氯气、酸性高锰酸钾等都是常用的强氧化剂,会继续氧化I2(或亚硝酸钠仅能把碘离子氧化成碘单质,意思对即可)(2分)(5)另从水层中取少量溶液于试管中,加入几滴淀粉溶液,再滴加Fe2(SO4)3溶液,振荡,溶液变蓝,说明滤液中含有I-(2分)(必须强调从水层中取夜才能得分)18.(12分)(1)2:3或者2:7(2分)(答对1个给一分)(2)Na2CO3和NaHCO3(2分)1:1(2分)(3)(NH4)2SO3(2分)(4)4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓(或者分步写Fe2++2OH-=Fe(OH)2↓,4Fe(OH)2+O2+2H2O=4Fe(OH)3)(2分)(5)H+、NH4+、Al3+、SO42-(2分)(注:离子顺序可以颠倒,漏写或者多写均为0分)19.(10分)(1)22(2分)大于(2分)(2)1∶1(1分)(3)sp3(1分)V形或角形或折线形(1分)(4)>(1分)(5)(1,,)或(1,0.5,0.5)(2分)20.(10分)(1)苯(2分)(2)取代反应、(1分)氧化反应(1分)(3)CH3COCH=CH2(2分)(4)c(2分)(5)6(2分)