- 249.82 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
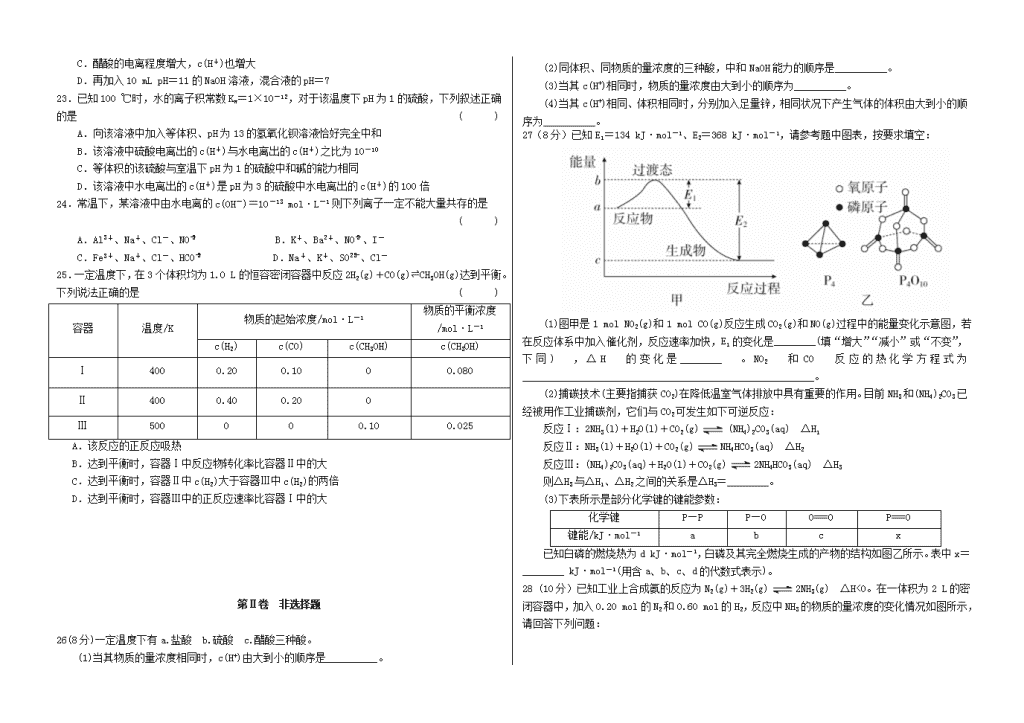
吉林省东辽五中2018-2019学年高二化学上学期期中试题本试卷分客观卷和主观卷两部分共30题,共100分,共4页。考试时间为90分钟。考试结束后,只交答题卡。可能用到的相对原子质量H1O16第Ⅰ卷客观卷一、选择题(25小题,每题2分,共50分)1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生,下列属于未来新能源标准的是()①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能A.①②③④B.⑤⑥⑦⑧C.③⑤⑥⑦⑧D.③④⑤⑥⑦⑧2.下列说法正确的是()A.同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同B.需要加热才能发生的反应一定是吸热反应C.加入催化剂,可以改变化学反应的反应热D.物质发生化学变化一定伴随着能量变化3.下列表述中正确的是()A.任何能使熵值增大的过程都能自发进行B.由C(石墨)→C(金刚石)ΔH=+119kJ·mol-1可知金刚石比石墨稳定C.化学平衡发生移动,平衡常数一定发生变化D.1molNaOH分别和1molCH3COOH、1molHNO3反应,后者比前者放出的热量多4.已知:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6kJ·mol-12CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-1452kJ·mol-1H+(aq)+OH-(aq)===H2O(l)ΔH=-57.3kJ·mol-1下列说法正确的是()A.H2(g)的燃烧热为571.6kJ·mol-1B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多C.H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+H2O(l) ΔH=-57.3kJ·mol-1D.在500℃、30MPa条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应后生成NH3(g)时放出19.3kJ热量,该热化学方程式为:N2(g)+3H2(g)⇌2NH3(g) ΔH=-38.6kJ·mol-15.下列物质的分类组合全部正确的是()选项强电解质弱电解质非电解质ANaClHClCO2BNaHCO3NH3·H2OCCl4CBa(OH)2BaCO3CuDH2SO4NaOHC2H5OH6.已知丙烷的燃烧热ΔH=-2215kJ·mol-1。若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为()A.55kJB.220kJC.550kJD.1108kJ7.下列说法正确的是()A.增大反应物浓度,可增大活化分子百分数,从而使有效碰撞次数增多B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大C.升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数D.催化剂能成千成万倍地增大化学反应速率,所以也能改变化学平衡8.反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为①v(A)=0.45mol/(L·min),②v(B)=0.6mol/(L·s),③v(C)=0.4mol/(L·s),④v(D)=0.45mol/(L·s)。该反应进行的快慢顺序为()A.④>③=②>①B.④<③=②<①C.①>②>③>④D.④>③>②>①9在密闭容器中进行如下反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,Z的浓度有可能是()A.0.2mol/LB.0.4mol/LC.0D.0.5mol/L10.下列图中的实验方案,能达到实验目的的是()选项ABCD实验方案实验目的验证FeCl3对H2O2分解反应有催化作用探究温度对平衡2NO2N2O4的影响除去CO2气体中混有的HCl比较HCl、H2CO3和H2SiO3的酸性强弱11.下列叙述中,不能用勒夏特列原理解释的是()A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率B.合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率C.过氧化氢分解加催化剂二氧化锰,使单位时间内产生的氧气的量增多nD.久置的氯水的pH变小12.一定温度下,向aL的密闭容器中加入2molNO2(g),发生如下反应:2NO22NO+O2,此反应达到平衡的标志是()A.单位时间内生成2nmolNO同时生成2nmolNO2B.混合气体中NO2、NO和O2的物质的量之比为2:2:1C.单位时间内生成2nmolNO同时生成nmolO2D.混合气体的颜色变浅13.据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g)CH3CH2OH(g)+3H2O(g)下列叙述不正确的是()A.使用CuZnFe催化剂可大大提高生产效率B.恒容时,充入大量CO2气体可提高H2的转化率C.反应需在300℃时进行,可推测该反应是吸热反应D.从平衡混合气体中及时分离出CH3CH2OH和H2O,可提高CO2和H2的利用率14.在一个密闭容器中发生如下反应:mA(g)+nB(g)pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来1.9倍,则下列说法中错误的是()A.m+n<pB.平衡向逆反应方向移动C.A的转化率降低D.C的体积分数增加15.对于可逆反应:2A(g)+B(g)⇌2C(g) ΔH<0,下列各图中正确的是()16.将V1mL1.00mol/LHCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50)。下列叙述正确的是()A.做该实验时环境温度为22℃B.该实验表明化学能可以转化为热能C.NaOH溶液的浓度约为1.00mol/LD.该实验表明有水生成的反应都是放热反应17.将一定量的CO2和H2充入一恒容密闭容器中,发生如下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),分别在350℃和450℃下,测得甲醇的物质的量随时间变化的关系曲线如图所示。下列叙述正确的是()A.该反应正向进行时,体系熵值增加B.T1代表450℃C.处于A点的反应体系从T1变到T2,达到平衡时增大D.该反应在T1时的平衡常数比T2时的小18.将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)⇌2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示。下列说法不正确的是()A.该反应的ΔH>0B.NH3的体积分数不变时,该反应一定达到平衡状态C.A点对应状态的平衡常数K(A)=10-2.294D.30℃时,B点对应状态的v正”或“<”)。(2)若在500℃时进行,且CO、H2O(g)的起始浓度均为0.020mol·L-1,该条件下,CO的最大转化率为________。(3)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的函数关系式为________。(4)有人提出可以设计反应2CO===2C+O2(ΔH>0)来消除CO的污染。请判断上述反应能否自发进行:________(填“可能”或“不可能”),理由是____________________________________。30(12分)Ⅰ.HA、H2B、H3C三种弱酸,根据“较强酸+较弱酸盐===较强酸盐+较弱酸”的反应规律,它们之间能发生下列反应:A.HA+HC2-(少量)===A-+H2C-B.H2B(少量)+2A-===B2-+2HAC.H2B(少量)+H2C-===HB-+H3C回答下列问题:(1)相同条件下,HA、H2B、H3C三种酸中,酸性最强的是________。(2)A-、B2-、C3-、HB-、H2C-、HC2-六种离子中,最易结合质子(H+)的是________,最难结合质子的是________。(3)写出下列反应的离子方程式。HA(过量)+C3-:______________________________________。Ⅱ.在25℃下,将amol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,当溶液中c(NH)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性;用含a的代数式表示NH3·H2O的电离常数Kb=________。化学答案1B2D3D4B5B6A7C8A9A10B11C12A13C14D15Dn16B17C18B19B20D21A22D23C24C25D26(1)b>a>c (2)b>a=c(3)c>a>b (4)c>a=b27(1)减小 不变 NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234kJ·mol-1(2)2ΔH2-ΔH1 (3)(d+6a+5c-12b)28(1)0.025mol·L-1·min-1(2)向正反应方向 体积缩小一半,相当于增大体系的压强,平衡向气体分子数减小的方向即正反应方向移动 (3)减小 不变(4)29(1)K= <(2)75% (3)y=x(4)不能 ΔH>0且ΔS<0,不能自发进行30Ⅰ.(1)H2B(2)C3- HB-(3)2HA(过量)+C3-===H2C-+2A-Ⅱ.中