- 236.62 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
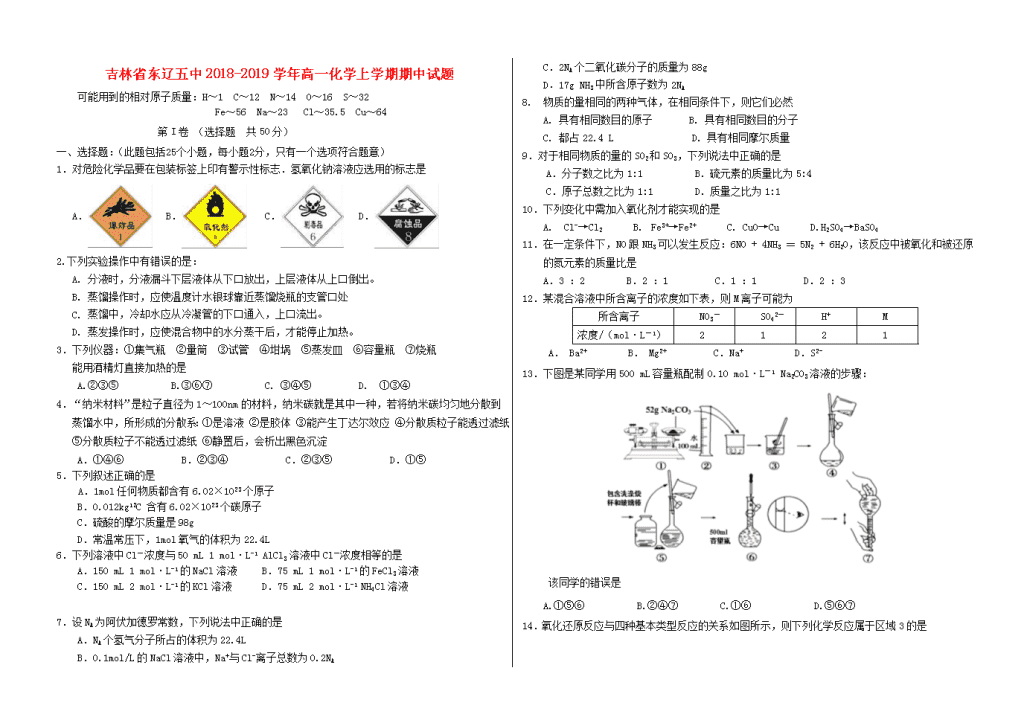
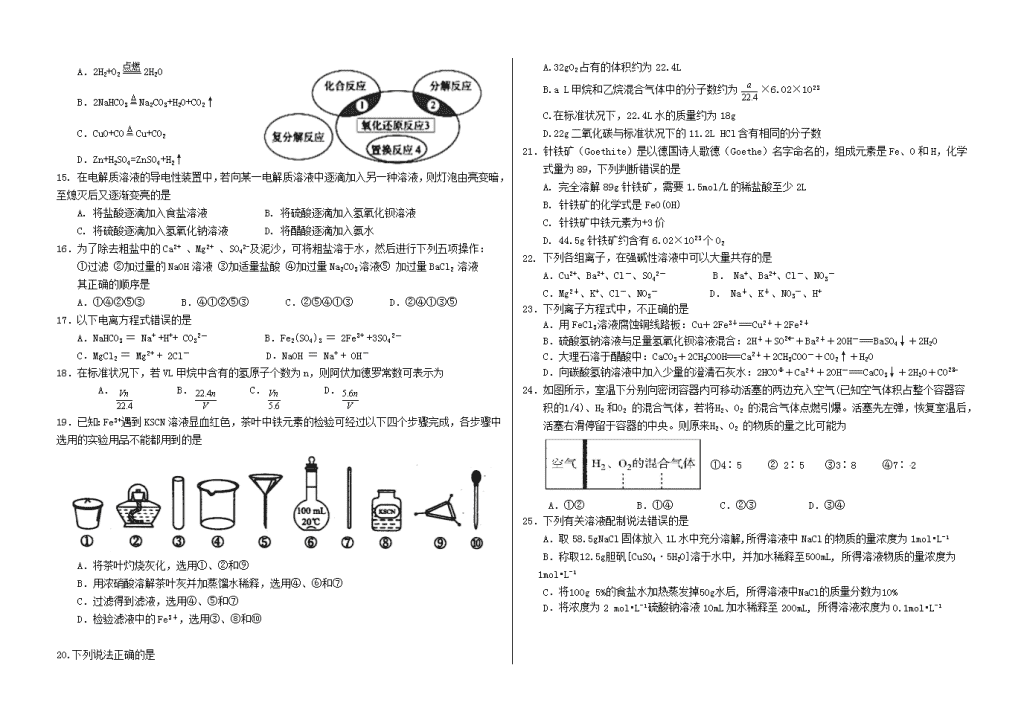
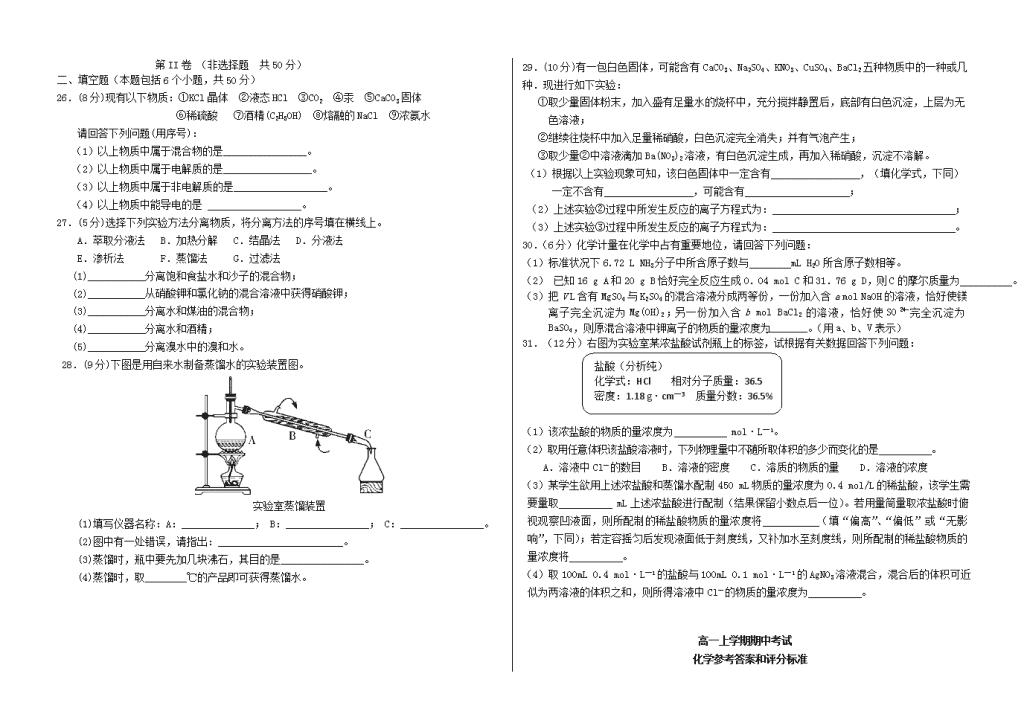
吉林省东辽五中2018-2019学年高一化学上学期期中试题可能用到的相对原子质量:H~1 C~12 N~14 O~16S~32 Fe~56Na~23Cl~35.5Cu~64第I卷(选择题共50分)一、选择题:(此题包括25个小题,每小题2分,只有一个选项符合题意)1.对危险化学品要在包装标签上印有警示性标志.氢氧化钠溶液应选用的标志是A.B.C.D.2.下列实验操作中有错误的是:A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出。B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处C.蒸馏中,冷却水应从冷凝管的下口通入,上口流出。D.蒸发操作时,应使混合物中的水分蒸干后,才能停止加热。3.下列仪器:①集气瓶②量筒③试管④坩埚⑤蒸发皿⑥容量瓶⑦烧瓶能用酒精灯直接加热的是A.②③⑤B.③⑥⑦C.③④⑤D.①③④4.“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的分散系:①是溶液②是胶体③能产生丁达尔效应④分散质粒子能透过滤纸⑤分散质粒子不能透过滤纸⑥静置后,会析出黑色沉淀A.①④⑥B.②③④C.②③⑤D.①⑤5.下列叙述正确的是A.1mol任何物质都含有6.02×1023个原子B.0.012kg12C含有6.02×1023个碳原子C.硫酸的摩尔质量是98gD.常温常压下,1mol氧气的体积为22.4L6.下列溶液中Cl-浓度与50mL1mol·L-1AlCl3溶液中Cl-浓度相等的是A.150mL1mol·L-1的NaCl溶液B.75mL1mol·L-1的FeCl3溶液C.150mL2mol·L-1的KCl溶液D.75mL2mol·L-1NH4Cl溶液7.设NA为阿伏加德罗常数,下列说法中正确的是A.NA个氢气分子所占的体积为22.4LB.0.1mol/L的NaCl溶液中,Na+与Cl-离子总数为0.2NAC.2NA个二氧化碳分子的质量为88gD.17gNH3中所含原子数为2NA8.物质的量相同的两种气体,在相同条件下,则它们必然A.具有相同数目的原子B.具有相同数目的分子C.都占22.4LD.具有相同摩尔质量9.对于相同物质的量的SO2和SO3,下列说法中正确的是A.分子数之比为1:1B.硫元素的质量比为5:4C.原子总数之比为1:1D.质量之比为1:110.下列变化中需加入氧化剂才能实现的是A.Cl-→Cl2B.Fe3+→Fe2+C.CuO→CuD.H2SO4→BaSO411.在一定条件下,NO跟NH3可以发生反应:6NO+4NH3==5N2+6H2O,该反应中被氧化和被还原的氮元素的质量比是A.3:2B.2:1C.1:1D.2:312.某混合溶液中所含离子的浓度如下表,则M离子可能为所含离子NO3-SO42-H+M浓度/(mol·L-1)2121A.Ba2+B.Mg2+C.Na+D.S2-13.下图是某同学用500mL容量瓶配制0.10mol·L-1Na2CO3溶液的步骤:该同学的错误是A.①⑤⑥B.②④⑦C.①⑥D.⑤⑥⑦ 14.氧化还原反应与四种基本类型反应的关系如图所示,则下列化学反应属于区域3的是nA.2H2+O22H2OB.2NaHCO3Na2CO3+H2O+CO2↑C.CuO+COCu+CO2D.Zn+H2SO4=ZnSO4+H2↑15.在电解质溶液的导电性装置中,若向某一电解质溶液中逐滴加入另一种溶液,则灯泡由亮变暗,至熄灭后又逐渐变亮的是A.将盐酸逐滴加入食盐溶液B.将硫酸逐滴加入氢氧化钡溶液C.将硫酸逐滴加入氢氧化钠溶液D.将醋酸逐滴加入氨水16.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液其正确的顺序是A.①④②⑤③B.④①②⑤③C.②⑤④①③D.②④①③⑤17.以下电离方程式错误的是A.NaHCO3=Na++H++CO32-B.Fe2(SO4)3=2Fe3++3SO42-C.MgCl2=Mg2++2Cl-D.NaOH=Na++OH-18.在标准状况下,若VL甲烷中含有的氢原子个数为n,则阿伏加德罗常数可表示为 A. B. C. D.19.已知:Fe3+遇到KSCN溶液显血红色,茶叶中铁元素的检验可经过以下四个步骤完成,各步骤中选用的实验用品不能都用到的是A.将茶叶灼烧灰化,选用①、②和⑨B.用浓硝酸溶解茶叶灰并加蒸馏水稀释,选用④、⑥和⑦C.过滤得到滤液,选用④、⑤和⑦D.检验滤液中的Fe3+,选用③、⑧和⑩20.下列说法正确的是A.32gO2占有的体积约为22.4LB.aL甲烷和乙烷混合气体中的分子数约为×6.02×1023C.在标准状况下,22.4L水的质量约为18gD.22g二氧化碳与标准状况下的11.2LHCl含有相同的分子数21.针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,下列判断错误的是A.完全溶解89g针铁矿,需要1.5mol/L的稀盐酸至少2LB.针铁矿的化学式是FeO(OH)C.针铁矿中铁元素为+3价D.44.5g针铁矿约含有6.02×1023个O222.下列各组离子,在强碱性溶液中可以大量共存的是 A.Cu2+、Ba2+、Cl-、SO42- B.Na+、Ba2+、Cl-、NO3-C.Mg2+、K+、Cl-、NO3- D.Na+、K+、NO3-、H+23.下列离子方程式中,不正确的是A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+===Cu2++2Fe2+B.硫酸氢钠溶液与足量氢氧化钡溶液混合:2H++SO+Ba2++2OH-===BaSO4↓+2H2OC.大理石溶于醋酸中:CaCO3+2CH3COOH===Ca2++2CH3COO-+CO2↑+H2OD.向碳酸氢钠溶液中加入少量的澄清石灰水:2HCO+Ca2++2OH-===CaCO3↓+2H2O+CO24.如图所示,室温下分别向密闭容器内可移动活塞的两边充入空气(已知空气体积占整个容器容积的1/4)、H2和O2的混合气体,若将H2、O2的混合气体点燃引爆。活塞先左弹,恢复室温后,活塞右滑停留于容器的中央。则原来H2、O2的物质的量之比可能为①4∶5②2∶5③3∶8④7∶2A.①②B.①④C.②③D.③④25.下列有关溶液配制说法错误的是A.取58.5gNaCl固体放入1L水中充分溶解,所得溶液中NaCl的物质的量浓度为1mol•L-1B.称取12.5g胆矾[CuSO4·5H2O]溶于水中,并加水稀释至500mL,所得溶液物质的量浓度为1mol•L-1C.将100g5%的食盐水加热蒸发掉50g水后,所得溶液中NaCl的质量分数为10%D.将浓度为2mol•L-1硫酸钠溶液10mL加水稀释至200mL,所得溶液浓度为0.1mol•L-1n第II卷(非选择题共50分)二、填空题(本题包括6个小题,共50分)26.(8分)现有以下物质:①KCl晶体②液态HCl③CO2④汞⑤CaCO3固体⑥稀硫酸⑦酒精(C2H5OH)⑧熔融的NaCl⑨浓氨水请回答下列问题(用序号):(1)以上物质中属于混合物的是________________。(2)以上物质中属于电解质的是_________________。(3)以上物质中属于非电解质的是__________________。(4)以上物质中能导电的是。27.(5分)选择下列实验方法分离物质,将分离方法的序号填在横线上。A.萃取分液法B.加热分解C.结晶法D.分液法E.渗析法F.蒸馏法G.过滤法(1)___________分离饱和食盐水和沙子的混合物;(2)___________从硝酸钾和氯化钠的混合溶液中获得硝酸钾;(3)___________分离水和煤油的混合物;(4)___________分离水和酒精;(5)___________分离溴水中的溴和水。28.(9分)下图是用自来水制备蒸馏水的实验装置图。实验室蒸馏装置(1)填写仪器名称:A:______________;B:________________;C:________________。(2)图中有一处错误,请指出:________________________。(3)蒸馏时,瓶中要先加几块沸石,其目的是________________。(4)蒸馏时,取________℃的产品即可获得蒸馏水。29.(10分)有一包白色固体,可能含有CaCO3、Na2SO4、KNO3、CuSO4、BaCl2五种物质中的一种或几种.现进行如下实验:①取少量固体粉末,加入盛有足量水的烧杯中,充分搅拌静置后,底部有白色沉淀,上层为无色溶液;②继续往烧杯中加入足量稀硝酸,白色沉淀完全消失;并有气泡产生;③取少量②中溶液滴加Ba(NO3)2溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。(1)根据以上实验现象可知,该白色固体中一定含有 ,(填化学式,下同)一定不含有 ,可能含有 ;(2)上述实验②过程中所发生反应的离子方程式为: ;(3)上述实验③过程中所发生反应的离子方程式为: 。30.(6分)化学计量在化学中占有重要地位,请回答下列问题:(1)标准状况下6.72LNH3分子中所含原子数与mLH2O所含原子数相等。(2)已知16gA和20gB恰好完全反应生成0.04molC和31.76gD,则C的摩尔质量为。(3)把VL含有MgSO4与K2SO4的混合溶液分成两等份,一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为Mg(OH)2;另一份加入含bmolBaCl2的溶液,恰好使SO完全沉淀为BaSO4,则原混合溶液中钾离子的物质的量浓度为________。(用a、b、V表示)31.(12分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:盐酸(分析纯)化学式:HCl相对分子质量:36.5密度:1.18g·cm—3质量分数:36.5%(1)该浓盐酸的物质的量浓度为mol·L—1。(2)取用任意体积该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是。A.溶液中Cl-的数目B.溶液的密度C.溶质的物质的量D.溶液的浓度(3)某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为0.4mol/L的稀盐酸,该学生需要量取mL上述浓盐酸进行配制(结果保留小数点后一位)。若用量筒量取浓盐酸时俯视观察凹液面,则所配制的稀盐酸物质的量浓度将(填“偏高”、“偏低”或“无影响”,下同);若定容摇匀后发现液面低于刻度线,又补加水至刻度线,则所配制的稀盐酸物质的量浓度将。(4)取100mL0.4mol·L—1的盐酸与100mL0.1mol·L—1的AgNO3溶液混合,混合后的体积可近似为两溶液的体积之和,则所得溶液中Cl-的物质的量浓度为。高一上学期期中考试化学参考答案和评分标准n1.D2.D3.C4.B5.B6.B7.C8.B9.A10.A11.D12.B13.C14.C15.B16.C17.A18.D19.B20.D21.D22.B23.B24.B25.A26.(8分,每空2分)(1)⑥⑨(2)①②⑤⑧(3)③⑦(4)④⑥⑧⑨27.(每空1分,共5分)(1)G(2)C(3)D(4)F(5)A28.(9分)(1)A:蒸馏烧瓶 B:(直型)冷凝管C:尾接管(牛角管)(各1分)(2)温度计的位置不对 (3)防止暴沸 (4)100(各2分)29.(10分,每空2分)(1)CaCO3、Na2SO4;CuSO4、BaCl2;KNO3(2)CaCO3+2H+=Ca2++CO2↑+H2O(3)Ba2++SO42-=BaSO430.(6分,每空2分)(1)7.2(2)106g/moL(3)(4b-2a)/VmoL/L(不写单位扣一分)31.(12分,每空2分)