- 201.65 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
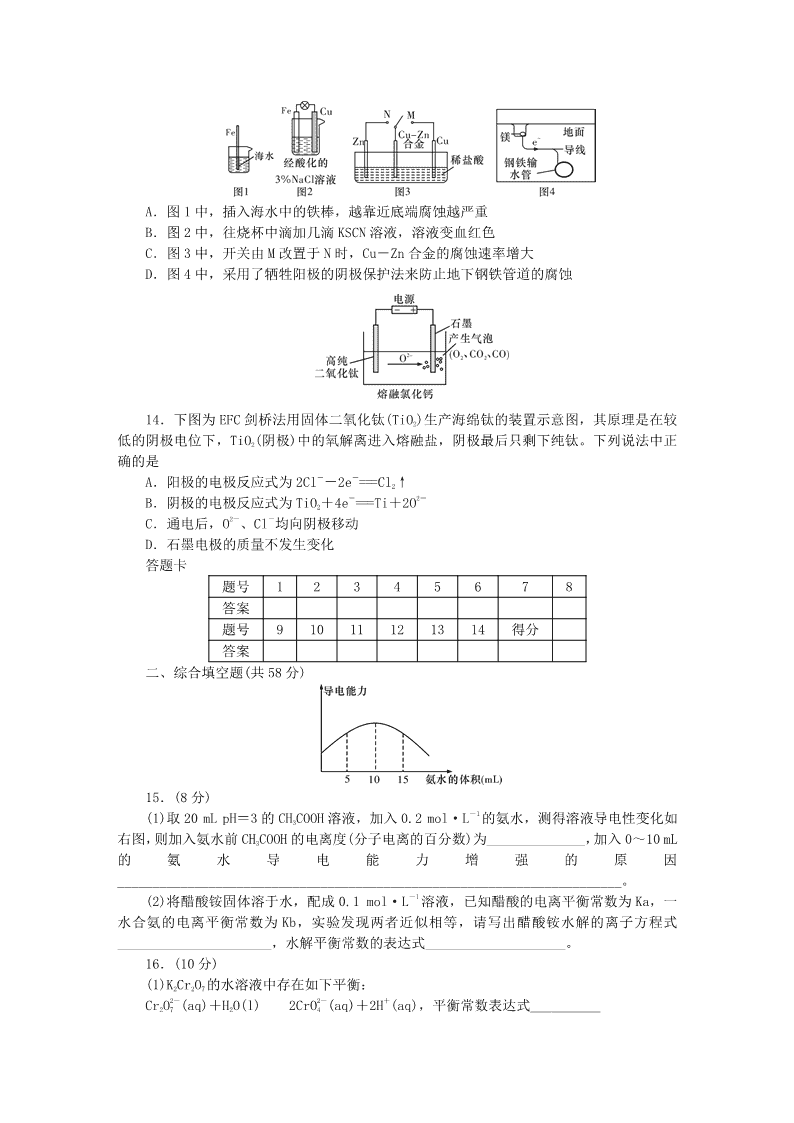
湖南师大附中2018-2019学年度高二第一学期期中考试化学(理科)时量:90分钟满分:150分得分:________可能用到的相对原子质量:H~1C~12O~16Na~23Ag~108第Ⅰ卷基础部分(共100分)一、选择题(本题共14小题,每小题3分。四个选项中,只有一项是符合题目要求的)1.下列溶液导电能力最强的是A.1L0.1mol/L的醋酸溶液B.1L0.1mol/L的亚硫酸溶液C.1L0.1mol/L的硫酸溶液D.1L0.1mol/L的盐酸溶液2.向蒸馏水中滴入少量盐酸后,下列说法中正确的是+-A.c(H)·c(OH)不变B.pH增大了C.水的电离程度增大了+D.水电离出的c(H)增加了-1-+3.已知0.1mol·L的醋酸溶液中存在电离平衡:CH3COOHCH3COO+H,要使溶液+中c(H)/c(CH3COOH)值减小,可以采取的措施是A.通入少量HCl气体B.升高温度C.加少量醋酸钠晶体D.加水4.相同温度下,根据三种酸的电离常数,下列判断正确的是酸HXHYHZ-1-7-6-2电离常数K/(mol·L)9×109×101×10A.相同温度下,HX的电离常数会随浓度变化而改变--B.反应HZ+Y===HY+Z能发生C.HZ属于强酸,HX和HY属于弱酸D.三种酸的强弱关系:HX>HY>HZ5.pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示,下列说法正确的是A.稀释前,A、B两酸溶液的物质的量浓度一定相等B.稀释后,A酸溶液的酸性比B酸溶液强C.a=5时,A是强酸,B是弱酸nD.稀释导致B酸的电离程度减小6.25℃时,pH=3的硝酸和pH=10的氢氧化钾溶液按照体积比为1∶9混合,混合溶液的pH为A.5B.6C.7D.87.准确移取20.00mL某待测浓度的盐酸于锥形瓶中,用0.1000mol/L的氢氧化钠标准溶液滴定。下列说法正确的是A.滴定管用蒸馏水洗涤后,装入氢氧化钠溶液进行滴定B.随着氢氧化钠溶液的滴入,锥形瓶中溶液的pH由小变大C.使用酚酞为指示剂,当锥形瓶中的溶液由红色变为无色时停止滴定D.滴定达到终点时,发现滴定管的尖嘴部分有悬滴,测定结果偏小--48.常温下,某碱性溶液中,由水电离出来的c(OH)=10mol/L,则该溶液中的溶质可能是A.Al2(SO4)3B.KHSO4C.NaOHD.CH3COONa-19.下列关于0.10mol·LNaHCO3溶液的说法正确的是++2-A.溶质的电离方程式为NaHCO3===Na+H+CO3+-B.25℃时,加水稀释后,n(H)与n(OH)的乘积变大++--2-C.离子浓度关系:c(Na)+c(H)=c(OH)+c(HCO3)+c(CO3)-D.25~45℃小范围内温度升高,c(HCO3)增大10.向10mLNaCl溶液中滴加硝酸银溶液1滴,出现白色沉淀,继续滴加碘化钾溶液1滴,沉淀转化为黄色,再滴入硫化钠溶液1滴,沉淀又转化为黑色,已知溶液均为0.1mol/L,分析沉淀的溶解度关系A.AgCl>AgI>Ag2SB.AgCl>Ag2S>AgIC.Ag2S>AgI>AgClD.无法判断11.用锌片和稀硫酸反应制取氢气时,为加快生成氢气的速率,下列措施不适宜的是A.对该反应体系加热B.加入硝酸铜固体C.改用粗锌D.不用锌片,改用锌粉12.如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入M的浓溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)A.当M为盐酸、杠杆为导体时,A端高,B端低B.当M为AgNO3、杠杆为导体时,A端高,B端低C.当M为CuSO4、杠杆为导体时,A端低,B端高D.当M为CuSO4、杠杆为绝缘体时,A端低,B端高13.下列与金属腐蚀有关的说法,正确的是nA.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重B.图2中,往烧杯中滴加几滴KSCN溶液,溶液变血红色C.图3中,开关由M改置于N时,Cu-Zn合金的腐蚀速率增大D.图4中,采用了牺牲阳极的阴极保护法来防止地下钢铁管道的腐蚀14.下图为EFC剑桥法用固体二氧化钛(TiO2)生产海绵钛的装置示意图,其原理是在较低的阴极电位下,TiO2(阴极)中的氧解离进入熔融盐,阴极最后只剩下纯钛。下列说法中正确的是--A.阳极的电极反应式为2Cl-2e===Cl2↑-2-B.阴极的电极反应式为TiO2+4e===Ti+2O2--C.通电后,O、Cl均向阴极移动D.石墨电极的质量不发生变化答题卡题号12345678答案题号91011121314得分答案二、综合填空题(共58分)15.(8分)-1(1)取20mLpH=3的CH3COOH溶液,加入0.2mol·L的氨水,测得溶液导电性变化如右图,则加入氨水前CH3COOH的电离度(分子电离的百分数)为______________,加入0~10mL的氨水导电能力增强的原因________________________________________________________________________。-1(2)将醋酸铵固体溶于水,配成0.1mol·L溶液,已知醋酸的电离平衡常数为Ka,一水合氨的电离平衡常数为Kb,实验发现两者近似相等,请写出醋酸铵水解的离子方程式______________________,水解平衡常数的表达式____________________。16.(10分)(1)K2Cr2O7的水溶液中存在如下平衡:2-2-+Cr2O7(aq)+H2O(l)2CrO4(aq)+2H(aq),平衡常数表达式__________n已知:(在水溶液中K2Cr2O7为橙红色,K2CrO4为黄色)往上述溶液中加入足量氢氧化钠,溶液呈________色;向已加入氢氧化钠的溶液中,再加入过量硫酸,溶液呈__________色。(2)在KMnO4与H2C2O4反应中,可通过测定________________来测定该反应的速率;写出2+酸性条件下KMnO4与H2C2O4(弱酸)反应,产生二氧化碳气体、水和Mn的离子反应方程式:__________________;此反应开始反应缓慢,随后反应迅速加快,其原因是______(填字母)。+A.KMnO4溶液中的H起催化作用B.生成的CO2逸出,使生成物浓度降低2+C.反应中,生成的Mn起催化作用D.在酸性条件下KMnO4的氧化性增强17.(8分)设计的实验方案如下表。2-2--(已知I2+2S2O3===S4O6+2I,其中Na2S2O3溶液均足量)实验序号体积V/mLNa2S2O3溶液淀粉溶液碘水水时间/s①10.02.04.00.0t1②8.02.04.02.0t2③6.02.04.0Vxt3(1)该实验进行的目的是____________,该实验是根据__________现象记录时间。(2)表中Vx=______mL,比较t1、t2、t3大小____________。18.(14分)用中和滴定法测定某烧碱样品(含有氯化钠的杂质)的纯度,试根据实验回答下列问题:(1)准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液。称量时,样品可放在________称量。配制溶液选用________(填编号字母)A.小烧杯中B.洁净纸片上C.500mL容量瓶D.500mL试剂瓶(2)为了避免测定过程中样品部分与空气中二氧化碳反应导致结果偏差,滴定时,用0.2000mol/L的盐酸标准液来滴定待测溶液,可选用________(填编号字母)作指示剂。A.甲基橙B.石蕊C.酚酞(3)滴定过程中,眼睛应注视________________________________,若用酚酞做指示剂,滴定终点的标志是__________________________________________________,滴定结果是________(偏大,偏小,不变),理由________________________________________________________________________。(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol/L,烧碱样品的纯度是____________。待测溶液体积滴定次数(mL)标准酸体积滴定前的刻度(mL)滴定后的刻度(mL)第一次10.000.4020.50第二次10.004.1024.00n19.(8分)某课外活动小组用如图装置进行实验,试回答下列问题。(1)若开始时开关K与a连接,则A极的电极反应式为________________________________________________________________________。(2)若开始时开关K与b连接,则B极的电极反应式为________________________________________________________________________。(3)若用铝条和镁条分别代替图中石墨和铁电极,电解质溶液为氢氧化钠溶液,请写出原电池负极的电极反应式________________________________________________________________________。(4)若用二氧化铅和铅作电极,硫酸溶液为电解质溶液构成铅蓄电池,则充电时阳极的电极反应式________________________________________________________________________。三、计算题20.(10分)通直流电用惰性电极电解,3个电解槽串联。(1)第一个电解槽中盛放500mL1mol/LAgNO3溶液,一段时间后溶液pH由6变为1,忽略电解前后溶液体积变化,试计算阴极上析出单质的质量。(2)另外2个电解槽盛放KCl,Al2O3的熔融态,计算该电解时间段阴阳极产物的物质的量。第Ⅱ卷提高部分(共50分)四、选择题(每题只有一个选项符合要求,每小题4分,共20分)21.下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以B.氢硫酸的导电能力低于相同浓度的亚硫酸-1C.0.10mol·L的氢硫酸和亚硫酸的pH分别为4.5和2.1D.氢硫酸的还原性强于亚硫酸-7-11-222.碳酸:H2CO3,Ki1=4.3×10,Ki2=5.6×10,草酸:H2C2O4,Ki1=5.9×10,Ki2-5=6.4×10将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是+--2-A.[H]>[HC2O4]>[HCO3]>[C2O4]n--2-2-B.[HCO3]>[HC2O4]>[C2O4]>[CO3]+-2--C.[H]>[HC2O4]>[C2O4]>[HCO3]--2-D.[H2CO3]>[HCO3]>[HC2O4]>[CO3]23.一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是-2-A.电极B上发生的电极反应为:O2+2CO2+4e===2CO3--B.电极A上H2参与的电极反应为:H2+2OH-2e===2H2O2-C.电池工作时,CO3向电极A移动,电子由A极经电解质流向B极催化剂D.反应CH4+H2O==△===3H2+CO,每消耗1molCH4转移12mol电子24.下列有关电解质溶液中粒子浓度关系正确的是+2--A.pH=1的NaHSO4溶液:c(H)=c(SO4)+c(OH)+--B.含有AgCl和AgI固体的悬浊液:c(Ag)>c(C1)=c(I)+-2-C.CO2的水溶液:c(H)>c(HCO3)=2c(CO3)D.含等物质的量的NaHC2O4和Na2C2O4的溶液:+-2-3c(Na)=2[c(HC2O4)+c(C2O4)+c(H2C2O4)]-通电2-25.电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH=====FeO4+3H2↑,工作原理如图所示。下列说法不正确的是(已知:Na2FeO4只在强碱性条件下稳定,易被H2还原)2-A.装置通电后,铁电极附近生成紫红色的FeO4B.M点表示氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质C.氢氧根离子从镍极区通过交换膜到达铁极区域D.电解过程中,须将阴极产生的气体及时排出答题卡题号2122232425得分答案五、填空题(共30分)26.(每空3分,共18分)CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:(1)CO2可以被NaOH溶液捕获。常温下,若所得溶液pH=13,CO2主要转化为________(写n-2-离子符号);若所得溶液c(HCO3)∶c(CO3)=2∶1,溶液pH=__________。(室温下,H2CO3-7-11的K1=4×10;K2=5×10)-5-2-8(2)已知25℃,NH3·H2O的Kb=1.8×10,H2SO3的Ka1=1.3×10,Ka2=6.2×10。若-1--1氨水的浓度为2.0mol·L,溶液中的c(OH)=________________mol·L。将SO2通入该--7-12--氨水中,当c(OH)降至1.0×10mol·L时,溶液中的c(SO3)/c(HSO3)=__________________。-+(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag与2---CrO4生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105-1+-12-mol·L)时,溶液中c(Ag)为________mol·L,此时溶液中c(CrO4)等于__________mol·L-1-12-10。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10和2.0×10)。27.(每空3分,共12分)(1)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:________________________。(2)制备焦亚硫酸钠Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。-(3)利用离子交换膜控制电解液中OH的浓度而制备纳米Cu2O,装置如图所示,该电池的-阳极反应式为____________________。(离子交换膜只允许OH通过)湖南师大附中2018-2019学年度高二第一学期期中考试化学(理科)参考答案-(这是边文,请据需要手工删加)湖南师大附中2018-2019学年度高二第一学期期中考试化学(理科)参考答案第Ⅰ卷基础部分(共100分)一、选择题(本题共14小题,每小题只有一个最佳答案,每小题3分,共42分)n题1234567891011121314号答CACBCABDBABCDB案二、综合填空题(共58分)15.(1)1%随着中和反应进行,溶液中离子(铵根离子,醋酸根离子)浓度显著增大,当达到化学计量点时离子浓度达最大值。+-(2)NH4+CH3COO+H2ONH3·H2O+CH3COOHK=KW/KaKb2-2-22+16.(1)K=C(CrO4)C(H)/C(Cr2O7),黄,橙红(颜色各1分)(2)高锰酸钾溶液紫色褪去的时间-+2+2MnO4+5H2C2O4+6H===2Mn+10CO2+8H2OC17.(1)探究浓度对化学反应速率的影响蓝色消失的时间(2)4.0t3>t2>t118.(1)AD(2)A(3)锥形瓶中液体颜色变化溶液由红色变为浅红色,且半分钟内不褪色偏小滴定终点时,溶液中碳酸离子被滴定为碳酸氢根离子,消耗盐酸较少。(各1分)(4)0.400097.56%--19.(1)O2+4e+2H2O===4OH--(2)2H2O+2e===2OH+H2---(3)Al-3e+4OH===AlO2+2H2O2--+(4)PbSO4+2H2O-2e===PbO2+4H+SO4三、计算题20.(1)5.4g银(2)电解氯化钾熔融态,阳极为氯气,0.025mol,阴极为钾,0.05mol;电解氧化铝的熔融态,阳极为氧气,0.0125mol,阴极为铝,0.0167mol。第Ⅱ卷提高部分(共50分)四、选择题(每题只有一个选项符合要求,每小题4分,共20分)题号2122232425答案DCAAB2-26.(1)CO310-3(2)6.0×100.62-5-3(3)2.0×105×10--+27.(1)HNO2-2e+H2O===3H+NO3-+(2)2H2O-4e===4H+O2↑a--(3)2Cu-2e+2OH===Cu2O+H2O