- 548.18 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
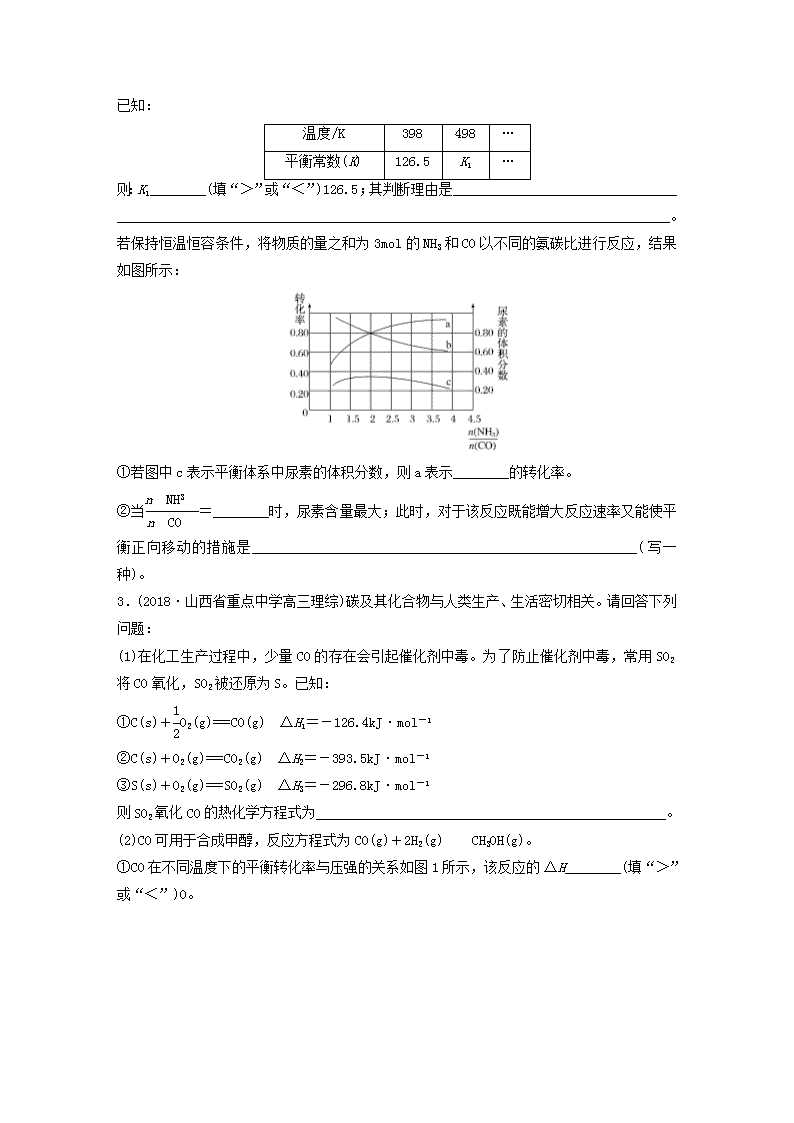
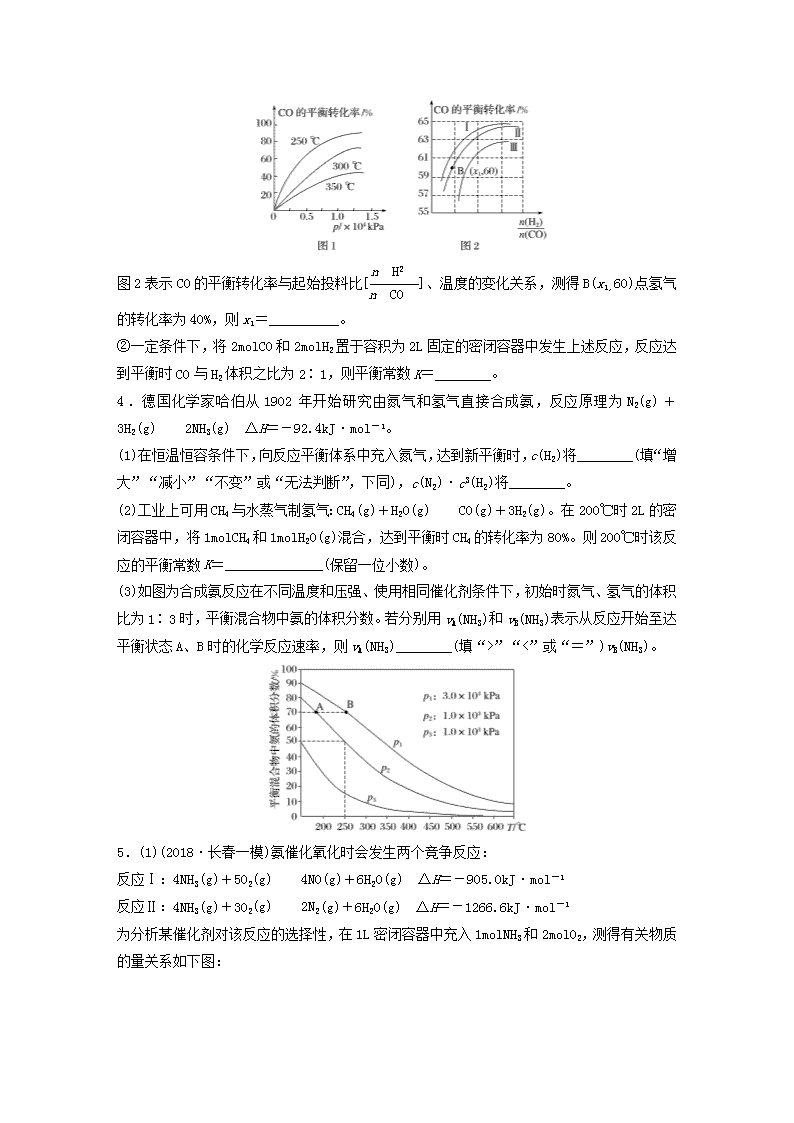
微题型571.(2018·大连模拟)甲醇是一种重要的试剂,氢气和二氧化碳在一定条件下可合成甲醇:3H2(g)+CO2(g)CH3OH(g)+H2O(g),在某密闭容器中充入3mol氢气和1mol二氧化碳,测得混合气体中甲醇的体积分数与温度的关系如图A所示:试回答下列问题:(1)该反应是______(填“放热”或“吸热”)反应。该反应平衡常数的表达式为____________,为了降低合成甲醇的成本可以采用的措施是_________________(任意写出一条合理的建议)。(2)解释O~T0内,甲醇的体积分数变化趋势:_________________________________________________________________________________________________________________________。(3)氢气在Q点的转化率________(填“大于”“小于”或“等于”,下同)氢气在W点的转化率;其他条件相同,甲醇在Q点的正反应速率________甲醇在M点的正反应速率。(4)图B表示氢气转化率α(H2)与投料比的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa。(其他条件相同)2.CO是合成尿素、甲酸的原料。(1)在100kPa和TK下,由稳定单质生成1mol化合物的焓变称为该物质在TK时的标准摩尔生成焓,用符号ΔHθ表示。已知石墨和一氧化碳的燃烧热分别为393.5kJ·mol-1和283.0kJ·mol-1,则CO(g)的ΔHθ=______。(2)合成尿素的反应:2NH3(g)+CO(g)CO(NH2)2(g)+H2(g) ΔH=-81.0kJ·mol-1;T℃时,在体积为2L的恒容密闭容器中,将2mol的NH3和1molCO混合反应,5min时,NH3的转化率为80%。则0~5min平均反应速率为v(CO)=__________________________________。n已知:温度/K398498…平衡常数(K)126.5K1…则:K1________(填“>”或“<”)126.5;其判断理由是_______________________________________________________________________________________________________________。若保持恒温恒容条件,将物质的量之和为3mol的NH3和CO以不同的氨碳比进行反应,结果如图所示:①若图中c表示平衡体系中尿素的体积分数,则a表示________的转化率。②当=________时,尿素含量最大;此时,对于该反应既能增大反应速率又能使平衡正向移动的措施是_______________________________________________________(写一种)。3.(2018·山西省重点中学高三理综)碳及其化合物与人类生产、生活密切相关。请回答下列问题:(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化,SO2被还原为S。已知:①C(s)+O2(g)===CO(g) ΔH1=-126.4kJ·mol-1②C(s)+O2(g)===CO2(g) ΔH2=-393.5kJ·mol-1③S(s)+O2(g)===SO2(g) ΔH3=-296.8kJ·mol-1则SO2氧化CO的热化学方程式为__________________________________________________。(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应的ΔH________(填“>”或“<”)0。n图2表示CO的平衡转化率与起始投料比[]、温度的变化关系,测得B(x1,60)点氢气的转化率为40%,则x1=__________。②一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K=________。4.德国化学家哈伯从1902年开始研究由氮气和氢气直接合成氨,反应原理为N2(g)+3H2(g)2NH3(g) ΔH=-92.4kJ·mol-1。(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将________(填“增大”“减小”“不变”或“无法判断”,下同),c(N2)·c3(H2)将________。(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g)CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1molH2O(g)混合,达到平衡时CH4的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1∶3时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(NH3)________(填“>”“<”或“=”)vB(NH3)。5.(1)(2018·长春一模)氨催化氧化时会发生两个竞争反应:反应Ⅰ:4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH=-905.0kJ·mol-1反应Ⅱ:4NH3(g)+3O2(g)2N2(g)+6H2O(g) ΔH=-1266.6kJ·mol-1为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,测得有关物质的量关系如下图:n①该催化剂在低温时选择反应______(填“Ⅰ”或“Ⅱ”)。②520℃时,4NH3+3O22N2+6H2O平衡常数K=_______________(不要求得出计算结果,只需列出数字计算式)。③C点比B点所产生的NO的物质的量少的主要原因是________________________________________________________________________________________________________________。(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以AgZSM5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为_______________________________________________________________________________________________________________________________________________________________,在n(NO)/n(CO)=1的条件下,为更好地除去NOx物质,应控制在最佳温度在_______K左右。n答案精析1.(1)放热 K= 增加CO2的充入量(合理即可)(2)温度低于T0时,反应未达到平衡,反应正向进行,使甲醇的体积分数逐渐增大(3)小于 小于(4)如图所示解析 (1)W点表示在T0时反应达到平衡状态,达到平衡之后,升高温度,甲醇的体积分数减小,说明平衡向逆反应方向移动,则正反应是放热反应。该反应平衡常数的表达式K=,为了降低合成甲醇的成本可以采用的措施是:增加CO2的充入量。(3)Q点时反应未达到平衡状态,反应正向进行,甲醇的体积分数增大,氢气的转化率增大,所以Q点氢气的转化率小于W点的。Q点和M点对应体系中各物质的浓度相同,M点对应的温度较高,反应速率较大。(4)其他条件不变,随着氢气与二氧化碳体积比增大,氢气的转化率减小;该反应的正反应是气体分子数减小的反应,增大压强,氢气转化率增大。2.(1)-110.5kJ·mol-1(2)0.08mol·L-1·min-1 < 合成尿素的反应为放热反应,温度升高,平衡逆向移动,K减小 ①CO②2 按物质的量之比为2∶1加入NH3和CO3.(1)SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=-237.4kJ·mol-1(2)①< 3 ②4.5解析 (1)由盖斯定律可知,2×②-2×①-③即可得所求热化学方程式。(2)①由于温度越高CO的平衡转化率越低,则可推出温度升高平衡向逆反应方向移动,则正反应放热,即ΔH<0。令CO起始物质的量为1mol,H2的起始物质的量为x1mol,当CO变化0.6mol时,H2变化1.2mol,则有×100%=40%,解得x1=3。②列出三段式,先根据两种气体体积比为2∶1,可列式求出平衡浓度c(CH3OH)=mol·L-1,c(CO)=mol·L-1,c(H2)=mol·L-1,然后列式计算K==4.5。n4.(1)减小 增大 (2)69.1 (3)<解析 (1)恒温恒容条件下,向反应平衡体系中充入氮气,平衡将向正反应方向移动,故达到新平衡时,c(H2)减小。温度不变,平衡常数K=不变,达到新平衡后,c(NH3)增大,K不变,故c(N2)·c3(H2)也会增大。(2)根据三段式法进行计算: CH4(g)+H2O(g)CO(g)+3H2(g)起始/mol·L-10.5 0.50 0转化/mol·L-10.5×0.5×0.5×0.5×80%80% 80% 80% ×3平衡/mol·L-10.1 0.10.4 1.2则平衡常数K==≈69.1。(3)由题图可知,B所处的温度和压强均大于A,故vA(NH3)