- 485.30 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
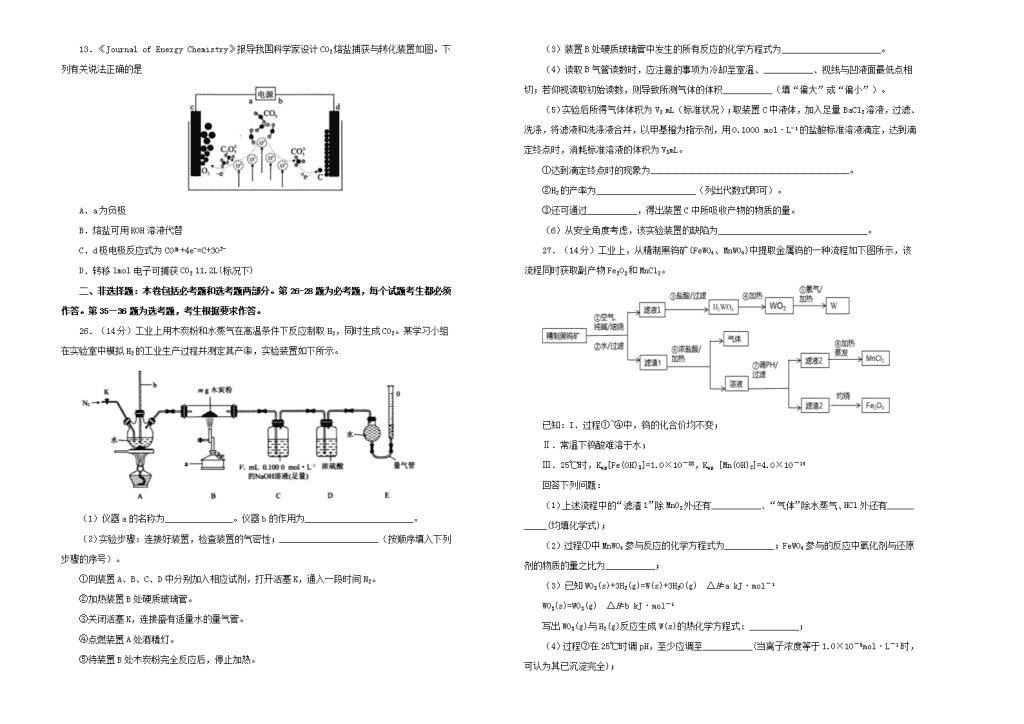
2019年高考高三最新信息卷化学(六)注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答题前,考生务必将自己的姓名、考生号填写在答题卡上。2.回答第Ⅰ卷时,选出每小题的答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。写在试卷上无效。3.回答第Ⅱ卷时,将答案填写在答题卡上,写在试卷上无效。4.考试结束,将本试卷和答题卡一并交回。可能用到的相对原子质量:H1C12N14O16Na23S32Cl35.5K39一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。7.《新修本草》中关于“青矾”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂,栽木不茂”,下列相关叙述不正确的是A.赤色固体可能是Fe2O3B.青矾宜密闭保存,防止氧化变质C.青矾燃烧过程中发生了电子转移D.“青矾厂气”可能是CO和CO28.设阿伏加德罗常数的值为NA,下列叙述正确的是A.等质量的N2O和CO2中,分子数均为NAB.3.1g31P与3.2g32S中,中子数均为1.6NAC.0.4molBaCl2与0.4molNa2O2中,阴离子数均为0.8NAD.1mol正丁烷与1mol异丁烷中,化学键数均为14NA9.下图所示为工业合成氨的流程图。有关说法错误的是A.步骤①中“净化”可以防止催化剂中毒B.步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率C.步骤③、④、⑤均有利于提高原料的转化率D.产品液氨除可生产化肥外,还可用作制冷剂10.山道年蒿中提取出一种具有明显抗癌活性的有机物X,其结构简式如下图所示。下列有关说法错误的是A.该物质的分子式为C10H16O2B.该物质不可能所有的碳原子共平面C.该物质的一氯代物共有7种D.该物质能发生加成、取代、氧化、消去、还原等反应11.短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,Y的氧化物是一种比较好的耐火材料,也是工业上冶炼Y的原料,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是A.X、Z的最高价氧化物相互化合,生成的产物可用作防火剂B.电解X、Q元素组成的化合物的饱和溶液常被用于工业上制备X单质C.W、X、Q三种元素都能形成多种氧化物D.Y、Q形成的化合物是强电解质12.298K时,用0.1000mol/LNaOH溶液滴定20.00mL同浓度的甲酸溶液过程中溶液pH与NaOH溶液体积的关系如图所示(已知:HCOOH溶液的Ka=l.0×10-4.0)下列有关叙述正确的是A.该滴定过程应该选择甲基橙作为指示剂B.图中a、b两点氷的电离程度:b>aC.当加入10.00mLNaOH溶液时,溶液中:c(HCOO−)>c(H+)>c(Na+)>c(OH−)D.当加入20.00mLNaOH溶液时,溶液pH>8.0n13.《JournalofEnergyChemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是A.a为负极B.熔盐可用KOH溶液代替C.d极电极反应式为CO+4e−=C+3O2−D.转移lmol电子可捕获CO211.2L(标况下)二、非选择题:本卷包括必考题和选考题两部分。第26-28题为必考题,每个试题考生都必须作答。第35—36题为选考题,考生根据要求作答。26.(14分)工业上用木炭粉和水蒸气在高温条件下反应制取H2,同时生成CO2。某学习小组在实验室中模拟H2的工业生产过程并测定其产率,实验装置如下所示。(1)仪器a的名称为_______________。仪器b的作用为________________________。(2)实验步骤:连接好装置,检查装置的气密性;______________________(按顺序填入下列步骤的序号)。①向装置A、B、C、D中分别加入相应试剂,打开活塞K,通入一段时间N2。②加热装置B处硬质玻璃管。③关闭活塞K,连接盛有适量水的量气管。④点燃装置A处酒精灯。⑤待装置B处木炭粉完全反应后,停止加热。(3)装置B处硬质玻璃管中发生的所有反应的化学方程式为______________________。(4)读取B气管读数时,应注意的事项为冷却至室温、___________、视线与凹液面最低点相切;若仰视读取初始读数,则导致所测气体的体积___________(填“偏大”或“偏小”)。(5)实验后所得气体体积为V2mL(标准状况);取装置C中液体,加入足量BaCl2溶液,过滤、洗涤,将滤液和洗涤液合并,以甲基橙为指示剂,用0.1000mol·L−1的盐酸标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为V3mL。①达到滴定终点时的现象为____________________________________________。②H2的产率为______________________(列出代数式即可)。③还可通过___________,得出装置C中所吸收产物的物质的量。(6)从安全角度考虑,该实验装置的缺陷为_________________________________。27.(14分)工业上,从精制黑钨矿(FeWO4、MnWO4)中提取金属钨的一种流程如下图所示,该流程同时获取副产物Fe2O3和MnCl2。已知:I.过程①~④中,钨的化合价均不变;Ⅱ.常温下钨酸难溶于水;Ⅲ.25℃时,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mn(OH)2]=4.0×10-14回答下列问题:(1)上述流程中的“滤渣1”除MnO2外还有___________、“气体”除水蒸气、HCl外还有___________(均填化学式);(2)过程①中MnWO4参与反应的化学方程式为___________;FeWO4参与的反应中氧化剂与还原剂的物质的量之比为___________;(3)已知WO3(s)+3H2(g)=W(s)+3H2O(g)ΔH=akJ·mol-1WO3(s)=WO3(g)ΔH=bkJ·mol-1写出WO3(g)与H2(g)反应生成W(s)的热化学方程式:___________;(4)过程⑦在25℃时调pH,至少应调至___________(当离子浓度等于1.0×10-5mol·L-1时,可认为其已沉淀完全);n(5)过程⑧要获得MnCl2固体,在加热时必须同时采取的一项措施是___________;(6)钠钨青铜是一类特殊的非化学计量比化合物,其通式为NaxWO3,其中0b,B错误;C.当加入10.00mLNaOH溶液时,溶液为等浓度的HCOONa、HCOOH的混合溶液,根据图示可知此时溶液的pH<7,说明HCOOH的电离作用大于HCOO−的水解作用,所以c(H+)>c(OH−),c(HCOO−)>c(Na+),盐电离产生的离子浓度大于弱电解质电离产生的离子浓度,因此c(Na+)>c(H+),所以离子浓度大小关系为:c(HCOO−)>c(Na+)>c(H+)>c(OH−),C错误;D.当加入20.00mLNaOH溶液时,二者恰好反应产生HCOONa,该盐是强酸弱碱盐,HCOO−水解,使溶液显碱性,HCOO−+H2OHCOOH+OH−,c(HCOO−)==0.0500mol/L,Kh==10−10,Kh=,所以c(OH−)=,所以溶液的pH>8,D正确;故合理选项是D。13.【答案】C【解析】A.由图所示,c电极上氧离子失电子被氧化,故c作阳极,则a为正极,故A错误;B.若用KOH溶液做电解质,则该装置成为电解水的装置,阴极上是氢离子得电子生成氢气,当电解质溶液吸收足量的二氧化碳后变为碳酸氢钠溶液,不能再吸收二氧化碳,故该装置不能连续长时间吸收二氧化碳,故B错误;C.由图所示,d极电极得电子,反应式为CO+4e−=C+3O2−,故C正确;D.碳元素化合价由+4变为0,则转移lmol电子可捕获CO25.6L(标况下),故D错误,故合理答案为C。26.【答案】(1)酒精喷灯平衡压强、检查装置是否存在堵塞n(2)①③②④⑤(3)C+H2O(g)CO+H2、C+2H2O(g)CO2+2H2(4)调整量气管至左右液面相平偏大(5)当滴入最后一滴盐酸时,溶液由黄色变为橙色,且半分钟内不变色测定洗净后干燥的BaCO3的质量(6)缺少防倒吸装置【解析】(1)由装置图知仪器a的名称为酒精喷灯。玻璃导管b与内外气压相通,可平衡压强,并检查装置是否存在堵塞。答案为酒精喷灯;平衡压强、检查装置是否存在堵塞;(2)根据实验目的和实验原理,连接好装置,检查装置的气密性后,应进行的操作为向装置A、B、C、D中分别加入相应的试剂,打开活塞K,通入一段时间N2以排尽装置中的空气;再关闭活塞K,连接盛有适量水的量气管;点燃装置B处酒精喷灯预热木炭粉,以防止水蒸气进入硬质玻璃管后冷凝,使木炭粉潮湿不易与水蒸气反应;然后点燃装置A处酒精灯,提供水蒸气;待装置B处木炭粉完全反应后,停止加热,故正确的实验步骤为①③②④⑤。答案为①③②④⑤;(3)装置B处硬质玻璃管中可能发生C与水蒸气在高温条件下生成CO、H2的反应和C与水蒸气在高温条件下生成CO2、H2的反应,其化学方程式分别为C+H2O(g)CO+H2、C+2H2O(g)CO2+2H2。答案为C+H2O(g)CO+H2、C+2H2O(g)CO2+2H2;(4)读取量气管读数时,应注意的事项为冷却至室温、调整量气管至左右液面相平、平视读数。若仰视读取初始读数,则读数偏大,导致所测气体的体积偏大。答案为调整量气管至左右液面相平;偏大;(5)①甲基橙的变色范围为3.1〜4.4,故达到滴定终点时的现象为当滴入最后一滴盐酸时,溶液由黄色变为橙色,且半分钟内不变色。答案为当滴入最后一滴盐酸时,溶液由黄色变为橙色,且半分钟内不变色;②根据信息知,反应生成的n(CO2)=(V1×l0−3L×0.1000mol·L−1-V3×10−3L×0.1000mol·L−1)/2=mol;mg木炭粉中所含n(C)=mol;由碳原子守恒知,所测混合气体中n(CO)=[]mol=mol;由化学方程式C+2H2O(g)CO2+2H2,计算得H2的理论产量为(×2)mol=mol,则H2的产率为;③通过测定洗净后干燥的BaCO3的质量,可得出生成的CO2的质量,进一步计算出H2的产率。答案为测定洗净后干燥的BaCO3的质量;(6)装置受热不均匀或装置内气体压强减小时,容易引起倒吸。答案为缺少防倒吸装置。27.【答案】(1)Fe2O3Cl2(2)2MnWO4+2Na2CO3+O22Na2WO4+2MnO2+2CO21∶4(3)WO3(g)+3H2(g)=W(s)+3H2O(g)ΔH=(a-b)kJ·mol−1(4)3.0(5)通入HCl气体,在HCl气氛中加热(6)WO+xe−=WO3x−+O2−【解析】(1)据“已知I”和化学式H2WO4、WO3知,黑钨矿(FeWO4、MnWO4)中Fe、Mn元素均为+2价,在步骤①中分别被空气氧化为Fe2O3、MnO2,即“滤渣1”有MnO2和Fe2O3。“滤渣1”与浓盐酸共热时,MnO2与HCl反应生成Cl2,另有浓盐酸挥发出HCl和水蒸气。(2)从步骤③看,“滤液1”中含有Na2WO4。步骤①MnWO4中Mn被O2氧化为MnO2、WO与Na2CO3生成Na2WO4并放出CO2,由此写出方程式为2MnWO4+2Na2CO3+O22Na2WO4+2MnO2+2CO2。FeWO4被O2氧化为Fe2O3,据化合价升降数相等,得氧化剂(O2)与还原剂(FeWO4)的物质的量之比为1∶4。(3)据盖斯定律,将两个已知热化学方程式相减,消去WO3(s)可得目标热化学方程式WO3(g)+3H2(g)=W(s)+3H2O(g)ΔH=(a-b)kJ·mol−1。(4)步骤⑥所得溶液中溶质有MnCl2、FeCl3,步骤⑦调节pH使Fe3+完全沉淀而Mn2+不沉淀。当c(Fe3+)=1.0×10−5mol·L−1时,由Ksp[Fe(OH)3]=1.0×10−38得c(OH-)=1.0×10-11mol·L-1,进而c(H+)=1.0×10-3mol·L-1,pH=3。(5)步骤⑧要从MnCl2溶液中获得MnCl2固体,为抑制Mn2+水解,必须通入HCl气体、并在HCl气氛中加热。(6)NaxWO3中阴离子为WO3x−,熔融的Na2WO4和WO2混合物中有Na+、WO、W4+、O2−。WO在电解池阴极得电子生成WO3x−,电极反应为WO+xe−=WO3x−+O2−。28.【答案】(1)N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-562.5kJ·mol-1(2)c>b>a逆向66.7%600/p0(3)10大于(4)质子N2+6e−+6H+=2NH3【解析】(1)由盖斯定律知(①+②+③+④)/2即可得到N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-562.5kJ·mol-1,故答案为:N2H4(g)+O2(g)=N2(g)+2H2O(g)ΔH=-562.5kJ·mol-1;(2)①由图知,a点到c点的过程中,N2O4n的体积分数不断增大,故逆反应速率不断增大。一定温度下,保持压强不变,加入稀有气体,相当于降低压强,故平衡向左移动;②a点时,设消耗了xmolNO2,则生成0.5xmolN2O4,剩余(1-x)molNO2,1-x=0.5x,x=2/3mol,此时NO2的转化率为66.7%,平衡时p(N2O4)=0.96p0,p(NO2)=0.04p0,由此可求出Kp=600/p0;故答案为:c>b>a;逆向;66.7%;600/p0;(3)当反应达到平衡时,v正=v逆,即k正∙c(N2O4)=k逆∙c2(NO2)。k正=k逆∙c2(NO2)/c(N2O4)=k逆∙K=10k逆;该反应是吸热反应,升高温度,平衡向正方向移动,k正增大的倍数大于k逆增大的倍数,故答案为:10;大于;(4)由图知,正极上N2转化为NH3时需要结合氢离子,故负极上生成的H+应移向正极,X膜为质子交换膜或阳离子交换膜,N2在正极上得到电子后转化为NH3,故答案为:质子;N2+6e-+6H+=2NH3。35.【答案】(1)第四周期、第VIII族;;(2)sp2;;(3)因为分解后生成的FeO和CoO中,FeO的晶格能更大;(4)6;(5)12;;【解析】(1)Co在元素周期表中位于第4周期第VIII族。根据构造原理,其基态原子价电子排布图为。(2)CO中C的孤电子对数为×(4+2-3×2)=0,σ键电子对数为3,价层电子对数为3,C为sp2杂化。CO中参与形成大π键的原子数是4个,电子数是6个,则CO中大π键可表示为。(3)在隔绝空气条件下分别加热FeCO3和CoCO3,实验测得FeCO3受热分解温度低于CoCO3,原因是:Fe2+半径为61pm,Co2+半径为65pm,Fe2+的离子半径小于Co2+的离子半径,FeO的晶格能大于CoO的晶格能。(4)向含0.01mol该配合物的溶液中加入足量AgNO3溶液,生成白色沉淀2.87g,n(AgCl)=2.87g÷143.5g/mol=0.02mol,即配合物中2个Cl-在外界,1个Cl−在内界,则该配合物可表示为[Co(NH3)5Cl]Cl2,该配合物的配位数为6。(5)根据晶胞结构知,该晶体中与铁原子距离最近的铁原子数目为12个。用均摊法晶胞中含Fe:8×+6×=4,C:12×+1=4,该晶体的化学式为FeC,该晶体的密度为g÷(a×10-10cm)3=g/cm3。36.【答案】(1)取代反应(2)浓硫酸、浓硝酸(3)(4)(5)碳碳双键、酯基(6)(7)(8)【解析】(1)类似于生成溴苯,苯在氯化铁做催化剂的作用下,与氯气反应生成氯苯,为取代反应,答案为取代反应;(2)B→C是硝化反应,硝化反应的条件为浓硫酸、浓硝酸,加热,试剂a为浓硝酸和浓硫酸,答案为浓硝酸、浓硫酸;(3)C→D为取代反应,结合产物没有氯原子,则—NH2取代-Cl,答案为;(4)A为苯,和Cl2生成氯苯。B生成C是硝化反应,在苯环上引入硝基。C→D为取代反应,—NH2取代-Cl,接下来为-NO2还原成-NH2。结合产物,E为邻苯二胺,可写出其结构式,答案为;(5)F能够生成高分子化合物,结合PVA的结构简式,F中有碳碳双键。结合产物PVA和X,G能够发生水解反应,有酯基,则F的官能团中也有酯基,答案为碳碳双键、酯基;(6)G→X为酯的水解,X为乙酸,G水解得到PVA和乙酸,方程式为;(7)X为乙酸。乙酸中甲基中的H被Cl取代,再被—NH2取代。W中有氨基和羧基,可以发生缩聚反应,发生反应时,—NH2断开N-H键,—COOH断开C-O单键,脱去—OH,则W的结构简式为;(8)E和W第一步反应失去1分子水,E中只有氨基,W中有羧基和氨基,只能是羧基和氨基形成肽键。第一个中间体为n;从第一个中间体的结构可知,有羰基,根据已知氨基可以与羰基反应,第二个中间体利用已知反应可知,为,再脱水可以得到产物,答案为。