- 620.95 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
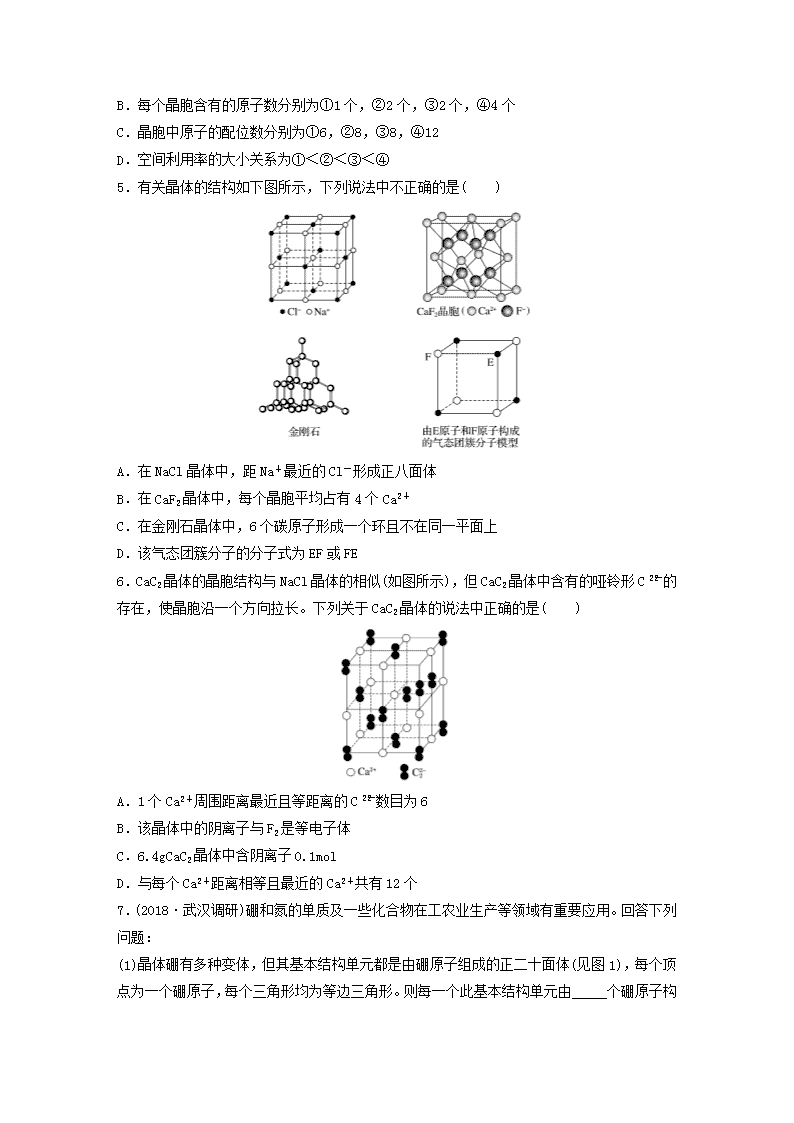
微考点381.(2019·广州质检)下面有关晶体的叙述中,不正确的是( )A.金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子B.氯化钠晶体中,每个Na+周围距离相等且紧邻的Na+共有6个C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子2.晶体硼的结构如右图所示。已知晶体硼的结构单元是由硼原子组成的正二十面体,其中有20个等边三角形的面和一定数目的顶点,每个顶点上各有1个B原子。下列有关说法不正确的是( )A.每个硼分子含有12个硼原子B.晶体硼是空间网状结构C.晶体硼中键角是60°D.每个硼分子含有30个硼硼单键3.(2018·银川模拟)钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。钛酸钡晶体的晶胞结构示意图如图所示,它的化学式是( )A.BaTi8O12B.BaTi4O5C.BaTi2O4D.BaTiO34.(2018·宁夏石嘴山三中月考)有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )A.①为简单立方堆积,②为镁型,③为钾型,④为铜型nB.每个晶胞含有的原子数分别为①1个,②2个,③2个,④4个C.晶胞中原子的配位数分别为①6,②8,③8,④12D.空间利用率的大小关系为①<②<③<④5.有关晶体的结构如下图所示,下列说法中不正确的是( )A.在NaCl晶体中,距Na+最近的Cl-形成正八面体B.在CaF2晶体中,每个晶胞平均占有4个Ca2+C.在金刚石晶体中,6个碳原子形成一个环且不在同一平面上D.该气态团簇分子的分子式为EF或FE6.CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的哑铃形C的存在,使晶胞沿一个方向拉长。下列关于CaC2晶体的说法中正确的是( )A.1个Ca2+周围距离最近且等距离的C数目为6B.该晶体中的阴离子与F2是等电子体C.6.4gCaC2晶体中含阴离子0.1molD.与每个Ca2+距离相等且最近的Ca2+共有12个7.(2018·武汉调研)硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:(1)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(见图1),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由_____个硼原子构n成;若该结构单元中有2个原子为10B(其余为11B),那么该结构单元有________种不同类型。(2)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相似,B、N原子相互交替排列(见图2),其晶胞结构如图3所示。设层内B—N核间距为apm,面间距为bpm,则该氮化硼晶体的密度为______________g·cm-3(用含a、b、NA、Mr(BN)的代数式表示)。8.(2018·江西新余四中、鹰潭一中联考)碳及其化合物广泛存在于自然界中,回答下列问题:(1)石墨可用作锂离子电池的负极材料,充电时发生下述反应:Li1-xC6+xLi++xe-―→LiC6。其结果是:Li+嵌入石墨的A、B层间。现有某石墨嵌入化合物每个六元环都对应一个Li+,写出它的化学式:________________________________________________________________。(2)碳有多种同素异形体,其中金刚石的晶胞如图所示。已知金刚石立方晶胞边长为apm,请计算其晶体密度为__________g·cm-3(请用含a和NA的式子表示)。9.按要求回答下列问题:(1)一种铝镍合金的晶胞结构如图所示,与其结构相似的化合物是________(填字母)。A.氟化钙B.金刚石C.二氧化硅D.氯化铯(2)Cr和Ca可以形成一种具有特殊导电性的复合氧化物,晶胞结构如图所示:n①该晶体的化学式为________________。②已知氧离子、钙离子半径分别为140pm、100pm,该晶胞的参数(边长)为________pm。③当该晶体中部分Ca2+被相同数目的La3+替代时,部分铬由+4价转变为+3价。若化合物中La3+和Ca2+的物质的量之比为(a<0.1),三价铬与四价铬的物质的量之比为________。n答案精析1.B [B项,氯化钠晶体中每个Na+周围距离相等且紧邻的Na+共有12个,错误。]2.B [结构中每个硼原子由5个三角形共有,每个三角形含有个硼原子,每个硼分子含有×20=12个硼原子,A正确;晶体硼不是原子晶体,属于分子晶体,因此不是空间网状结构,B错误;晶体硼中每个面都是等边三角形,键角是60°,C正确;硼分子中每个硼硼单键由2个三角形共有,每个三角形含有个硼硼单键,每个硼分子含有×20=30个硼硼单键,D正确。]3.D [仔细观察钛酸钡晶体的晶胞结构示意图可知:Ba2+在立方体的中心,完全属于该晶胞;Ti4+处于立方体的8个顶角,每个Ti4+为8个立方体所共用,即每个Ti4+只有属于该晶胞;O2-处于立方体的12条棱的中点,每条棱为4个立方体共用,即每个O2-只有属于该晶胞;则晶体中Ba2+、Ti4+、O2-的个数比为1∶∶=1∶1∶3。]4.B [②为体心立方堆积,属于钾、钠和铁型;③是六方最密堆积,属于镁、锌、钛型,A项错误;利用均摊法计算原子个数,①中原子个数为8×1/8=1个,②中原子个数为8×1/8+1=2个,③中原子个数为8×1/8+1=2个,④中原子个数为8×1/8+6×1/2=4个,B正确;③为六方最密堆积,配位数为12,C项错误;③、④的空间利用率最高,都是74%,①简单立方堆积空间利用率为52%,②体心立方堆积空间利用率为68%,所以空间利用率大小顺序为①<②<③=④,D错误。]5.D [在NaCl晶体中,距Na+最近的Cl-有6个,距Cl-最近的Na+有6个,这6个离子构成一个正八面体,故A项正确;在CaF2晶胞中含有Ca2+数为8×+6×=4,故B正确;金刚石晶体中碳原子杂化方式为sp3,6个碳原子形成一个环且不在同一平面上,故C项正确;气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,故D项错误。]6.C [依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C有4个,而不是6个,故A项错误;C含电子数为2×6+2=14,F2的电子数为18,二者电子数不同,不是等电子体,故B项错误;6.4gCaC2的物质的量为0.1mol,CaC2晶体中阴离子为C,则含阴离子的物质的量为0.1mol,故C项正确;晶胞的一个平面的长与宽不相等,所以与每个Ca2+距离相等且最近的Ca2+应为4个,故D项错误。]n7.(1)12 3 (2)解析 (1)顶点数为=12(个)(共20个面),每个面均为正三角形,有三个顶点,而每个顶点都同时属于5个面,所以有12个原子;当选定1个顶点后,与它最近的顶点数为5个,其他距离分别是5个和1个,即二取代物有3种,即该结构单元有3种不同类型。(2)根据图3可知一个晶胞中含有N原子数为4×+2×=2,B原子数为8×+1=2,由图2可知,晶胞中相邻4个B原子构成的四边形的面积等于B—N构成的六边形的面积,将一个六边形切成相等的六个三角形,每个底的边长为apm,高为pm,面积为6××a×pm2=pm2=×10-20cm2,晶胞的体积为×10-20cm2×b×10-10cm×2=3a2b×10-30cm3,故密度ρ=g·cm-3。8.(1)LiC2 (2)解析 (1)由于每个六元环上有6个C原子,而每个C原子参与形成3个六元环,所以平均每个六元环上有2个C原子,所以该石墨嵌入化合物的化学式为LiC2。(2)由金刚石的晶胞结构示意图可知,每个晶胞中有8个C原子,则1mol晶胞中有8molC,其质量为96g,其体积为NA(a×10-10cm)3,所以晶体密度为=g·cm-3。9.(1)D (2)①CaCrO3 ②240 ③解析 (1)晶体中Al和Ni的原子个数之比是1∶1,因此与之相似的是氯化铯,所以D正确。(2)①晶胞中O原子数为×6=3,Ca原子数为×8=1,Cr原子数为1,则化学式为CaCrO3。②已知氧离子、钙离子半径分别为140pm、100pm,则晶胞的面对角线是480pm,所以该晶胞的参数(边长)为240pm。③化合物中La3+和Ca2+的物质的量之比为(a<0.1),则若晶胞中含有a个La3+和1-a个Ca2+,设晶胞中+3价Cr与+4价Cr的个数分别为m和n,则m+n=1,由化合价的代数和为零得:3a+2(1-a)+3m+4n=6,解得:n=1-a,m=a,则三价铬与四价铬的物质的量之比为。