- 535.04 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
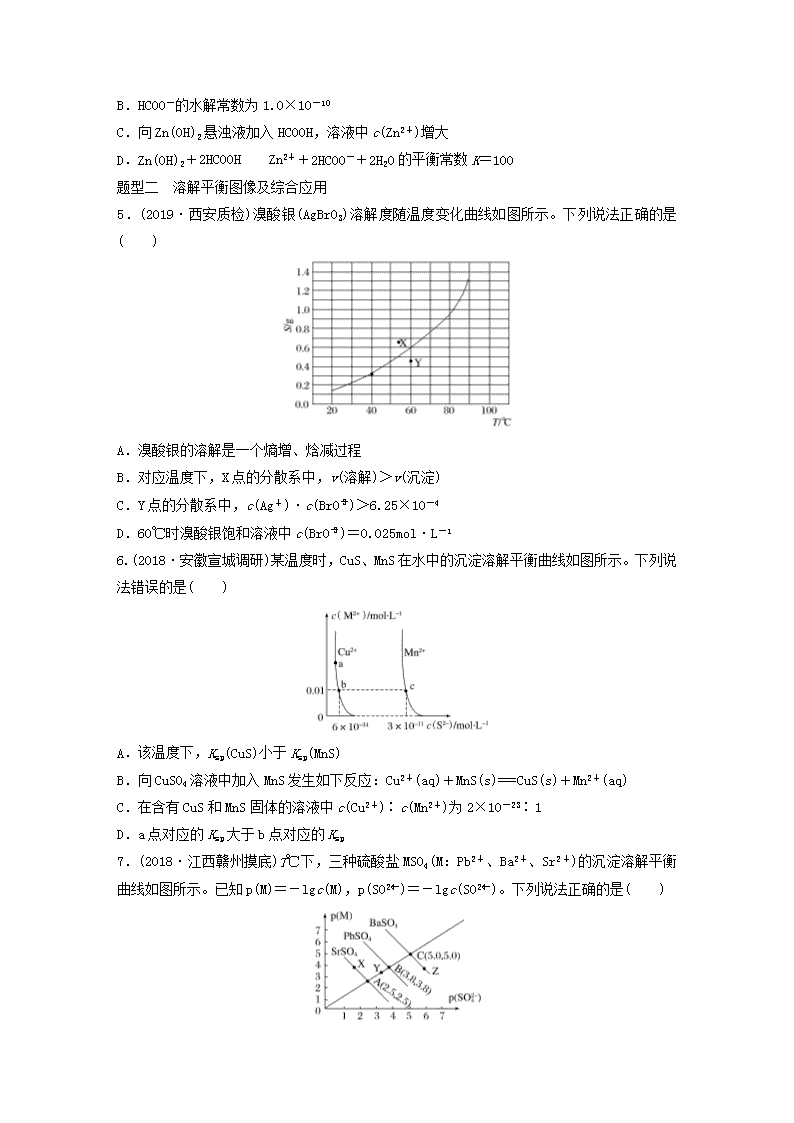
- 网站客服QQ:403074932
微考点62题型一 溶度积常数及其应用1.(2018·山西太原期末)25℃时,Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=9.0×10-12,下列说法正确的是( )A.AgCl和Ag2CrO4共存的悬浊液中,=B.向Ag2CrO4悬浊液中加入NaCl浓溶液,Ag2CrO4不可能转化为AgClC.向AgCl饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Cl-)=c(Ag+)D.向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,AgCl先析出2.(2019·成都高三诊断)25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.6×10-9。该温度下,下列说法不正确的是( )A.同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出B.BaCO3悬浊液中加入少量的新制氯水,c(Ba2+)增大C.BaSO4和BaCO3共存的悬浊液中,=D.BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO33.(2018·滕州二中高三月考)常温下,有关物质的溶度积如下表所示。物质CaCO3MgCO3Ca(OH)2Mg(OH)2Fe(OH)3Ksp4.96×10-96.82×10-64.68×10-65.61×10-122.64×10-39下列有关说法不正确的是( )A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好B.常温下,除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好C.常温下,向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+)∶c(Fe3+)=2.125×1021∶1D.无法利用Ca(OH)2制备NaOH4.(2018·湖南株洲检测)已知:25℃时,Ksp[Zn(OH)2]=1.0×10-18,Ka(HCOOH)=1.0×10-4。该温度下,下列说法错误的是( )A.Zn(OH)2溶于水形成的饱和溶液中c(Zn2+)>1.0×10-6mol·L-1nB.HCOO-的水解常数为1.0×10-10C.向Zn(OH)2悬浊液加入HCOOH,溶液中c(Zn2+)增大D.Zn(OH)2+2HCOOHZn2++2HCOO-+2H2O的平衡常数K=100题型二 溶解平衡图像及综合应用5.(2019·西安质检)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示。下列说法正确的是( )A.溴酸银的溶解是一个熵增、焓减过程B.对应温度下,X点的分散系中,v(溶解)>v(沉淀)C.Y点的分散系中,c(Ag+)·c(BrO)>6.25×10-4D.60℃时溴酸银饱和溶液中c(BrO)=0.025mol·L-16.(2018·安徽宣城调研)某温度时,CuS、MnS在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )A.该温度下,Ksp(CuS)小于Ksp(MnS)B.向CuSO4溶液中加入MnS发生如下反应:Cu2+(aq)+MnS(s)===CuS(s)+Mn2+(aq)C.在含有CuS和MnS固体的溶液中c(Cu2+)∶c(Mn2+)为2×10-23∶1D.a点对应的Ksp大于b点对应的Ksp7.(2018·江西赣州摸底)T℃下,三种硫酸盐MSO4(M:Pb2+、Ba2+、Sr2+)的沉淀溶解平衡曲线如图所示。已知p(M)=-lgc(M),p(SO)=-lgc(SO)。下列说法正确的是( )nA.溶度积:BaSO4>PbSO4>SrSO4B.Y点对应的SrSO4是不饱和溶液,能继续溶解SrSO4C.Z点对应的溶液中c(Ba2+)>c(SO),c(Ba2+)·c(SO)等于1×10-25D.BaSO4不可能转化成PbSO48.(2019·焦作月考)(1)计算调控值:室温下,当溶液中c(Mg2+)=c(Cu2+)=0.1mol·L-1时,Mg2+、Cu2+开始沉淀至沉淀完全的pH范围分别为__________________。已知:Ksp[Mg(OH)2]=10-9、Ksp[Cu(OH)2]=10-15,当c(Mg2+)≤1×10-5mol·L-1时视为沉淀完全。(2)选择调控值铝灰的回收利用方法很多,现用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下:已知步骤③中所得溶液生成氢氧化物沉淀的pH如表所示:Al(OH)3Fe(OH)2Fe(OH)3开始沉淀时的pH3.46.31.5完全沉淀时的pH4.78.32.8在该浓度下除去铁的化合物,调节pH的最大范围为____________。(3)如何调控接问题(2),步骤③中调pH时最佳试剂为____________________________________________。(4)突破应用为分析某铜合金的成分,用酸将其完全溶解后,用NaOH溶液调节pH,当pH=3.4时开始出现沉淀,分别在pH为7.0、8.0时过滤沉淀。结合题图信息推断该合金中除铜外一定含有________。9.(2018·湖北孝感中学模拟)某铬盐厂净化含Cr(Ⅵ)废水并提取Cr2O3的一种工艺流程如图所示。n已知:Ksp[Cr(OH)3]=6.3×10-31Ksp[Fe(OH)3]=2.6×10-39Ksp[Fe(OH)2]=4.9×10-17(1)步骤Ⅰ中,发生的反应为2H++2CrOCr2O+H2O,B中含铬元素的离子有______(填离子符号)。(2)当清液中Cr3+的浓度≤1.5mg·L-1时,可认为已达铬的排放标准。若测得清液的pH=5,则清液尚不符合铬的排放标准,因为此时Cr3+的浓度=______mg·L-1。(3)步骤Ⅱ还可用其他物质代替NaHSO3作还原剂。①若用FeSO4·7H2O作还原剂,步骤Ⅲ中参加反应的阳离子一定有___________(填离子符号)。②若用铁屑作还原剂,当铁的投放量相同时,经计算,C溶液的pH与c(Cr2O)的对应关系如下表所示:pH3456c(Cr2O)/mol·L-17.02×10-217.02×10-71.25×10-32.21×10-34有人认为pH=6时,c(Cr2O)变小的原因是Cr2O基本上都已转化为Cr3+。这种说法是否正确,为什么?_______________________________________________________________________________________________________________________________________________________________。③用铁屑作还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有_______________________________________________________________________________________________________________________________________________________________。10.(2018·山东八校高三第二次联考)已知:TK时,Ca(OH)2、CaWO4都微溶于水。pCa=-lgc(Ca2+),pX=-lgc(WO)或-lgc(OH-)。TK时CaWO4、Ca(OH)2的沉淀溶解平衡曲线如图所示。n(1)①向Na2WO4溶液中加入饱和石灰水,现象为________________________,离子方程式为:_______________________________________________________________________________________________________________________________________________________________。②Na2WO4溶液和石灰乳混合,会产生大量的CaWO4,则该反应的平衡常数K=___________。(2)已知Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8,钼酸钠晶体(Na2MoO4·2H2O)是新型的金属缓蚀剂,不纯的钼酸钠溶液中若含少量可溶性硫酸盐杂质,可加入Ba(OH)2固体除去SO(溶液体积变化忽略),则当BaMoO4开始沉淀时,溶液中的=________(结果保留2位有效数字)。n答案精析1.D [A项,AgCl和Ag2CrO4共存的溶液中,c(Ag+)是相等的,但二者Ksp的表达式不同,因此不等于二者的Ksp之比;B项,根据Ksp的含义,向Ag2CrO4悬浊液中加入NaCl浓溶液,当溶液中c(Cl-)·c(Ag+)>Ksp(AgCl)时,有AgCl沉淀析出;C项,向AgCl饱和溶液中加入NaCl晶体,使溶液中c(Cl-)增大,导致c(Cl-)·c(Ag+)>Ksp(AgCl),从而析出AgCl,析出沉淀后的溶液中c(Cl-)>c(Ag+);D项,向同浓度的Na2CrO4和NaCl混合溶液中滴加AgNO3溶液,根据Ksp计算可得,生成AgCl沉淀需要的c(Ag+)==,生成Ag2CrO4沉淀需要的c(Ag+)==,前者小于后者,即先析出AgCl沉淀。]2.D [Ksp(BaSO4)<Ksp(BaCO3),所以同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出,A正确;BaCO3悬浊液中加入少量的新制氯水,氯水显酸性,消耗溶液中的CO,促进碳酸钡的溶解平衡右移,因此c(Ba2+)增大,B正确;BaSO4和BaCO3共存的悬浊液中,===,C正确;只要溶液中c(CO)·c(Ba2+)>Ksp(BaCO3)就可以形成碳酸钡沉淀,所以BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4有可能转化为BaCO3,D不正确。]3.D 4.A5.D [由溶解度随温度的变化曲线可知:温度升高,该物质的溶解度增大,所以溴酸银(AgBrO3)的溶解是吸热过程(焓增过程),故A项错误;由题图可知:X点的溶液中溶质处于过饱和状态,所以v(溶解)<v(沉淀),故B项错误;60℃时溴酸银的溶解度是0.6g,则c(AgBrO3)=≈0.025mol·L-1,所以60℃时溴酸银饱和溶液中c(BrO)=c(Ag+)=0.025mol·L-1,Ksp(AgBrO3)=c(Ag+)·c(BrO)=6.25×10-4,图中Y点的溶液未达饱和,此时c(Ag+)·c(BrO)<6.25×10-4,故C项错误、D项正确。]6.D [由图像知,当c(M2+)相同时,CuS固体的溶液中c(S2-)较小,说明Ksp(CuS)较小,A正确;因Ksp(CuS)小于Ksp(MnS),则向CuSO4溶液中加入MnS,可发生沉淀的转化,即Cu2+(aq)+MnS(s)===CuS(s)+Mn2+(aq),B正确;由图像知,在此温度下,在含有CuS和MnS固体的溶液中c(Cu2+)∶c(Mn2+)=6×10-34∶3×10-11=2×10-23∶1,C正确;a、b处于同一温度下,Ksp相同,D错误。]7.B [p(M)越大,Pb2+、Ba2+、Sr2+浓度越小;p(SO)越大,c(SO)越小,所以溶度积:BaSO4<PbSO4<SrSO4,A项错误;Y点对应的SrSO4溶液中c(SO)·c(Sr2+)<Ksp(SrSO4),不是饱和溶液,能继续溶解SrSO4,B项正确;Z点对应的溶液中c(Ba2+)>c(SO),c(Ba2n+)·c(SO)=1×10-10,C项错误;增大Pb2+的浓度,BaSO4能转化成PbSO4,D项错误。]8.(1)10~12、7~9解析 由Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-)⇒c(OH-)=开始沉淀时c(OH-)=mol·L-1=10-4mol·L-1⇒c(H+)=mol·L-1⇒pH=10完全沉淀时c(OH-)=mol·L-1=10-2mol·L-1⇒c(H+)=mol·L-1=1×10-12mol·L-1⇒pH=12由Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-)⇒c(OH-)=开始沉淀时c(OH-)=mol·L-1=10-7mol·L-1⇒c(H+)=mol·L-1=10-7mol·L-1⇒pH=7完全沉淀时c(OH-)=mol·L-1=10-5mol·L-1⇒c(H+)=mol·L-1=10-9mol·L-1⇒pH=9所以Mg2+开始沉淀至完全沉淀时pH范围为10~12,Cu2+开始沉淀至完全沉淀时pH范围为7~9。(2)2.8~3.4解析 Fe2+已完全转化为Fe3+,完全沉淀时pH>2.8,而Al3+开始沉淀时pH=3.4,故Fe3+完全沉淀,而Al3+不沉淀pH调控范围为2.8~3.4。(3)Al2O3或Al(OH)3解析 考虑到调节pH时不能引入杂质故选用Al2O3、Al(OH)3最好,而选用其他试剂,则引入杂质离子,对产品的纯度或生产带来影响。(4)Al、Ni解析 能够溶解铜合金的酸应为过量的强氧化性的酸,因此溶解后的混合液中一定不含亚铁离子,根据题图,pH=3.4时开始出现沉淀,则原溶液中一定有铝离子,一定不含铁离子,pH=7.0时过滤沉淀,此时过滤出来的物质为氢氧化铜和氢氧化铝,pH=8.0时再次对溶液进行过滤,说明在此pH区间内又有物质沉淀出来,在此区间内沉淀的物质只可能为Ni2+。故该合金中除含铜外,还含Al、Ni。9.(1)CrO、Cr2O (2)32.76(3)①Cr3+、Fe3+、H+ ②不正确,c(H+)减小,化学平衡2H++2CrOCr2O+H2O向逆反应方向移动,溶液中Cr(Ⅵ)主要以CrOn形式存在 ③铁屑过量;将溶液的pH控制在使Cr3+完全沉淀而Fe2+不沉淀的范围内解析 (1)根据反应可知B中含铬元素的离子有CrO、Cr2O。(2)清液的pH=5,则c(OH-)=10-9mol·L-1,c(Cr3+)==6.3×10-4mol·L-1,质量浓度为6.3×10-4mol·L-1×52×103mg·mol-1=32.76mg·L-1。(3)①若用FeSO4·7H2O作还原剂,则C中的阳离子有Fe2+、Fe3+、Cr3+、H+,Ksp[Fe(OH)2]较大,步骤Ⅲ中参加反应的阳离子一定有Fe3+、Cr3+、H+。②c(H+)减小,化学平衡2H++2CrOCr2O+H2O向逆反应方向移动,溶液中Cr(Ⅵ)主要以CrO形式存在。10.(1)①生成白色沉淀 Ca2++WO===CaWO4↓ ②100(2)3.6×102