- 685.43 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
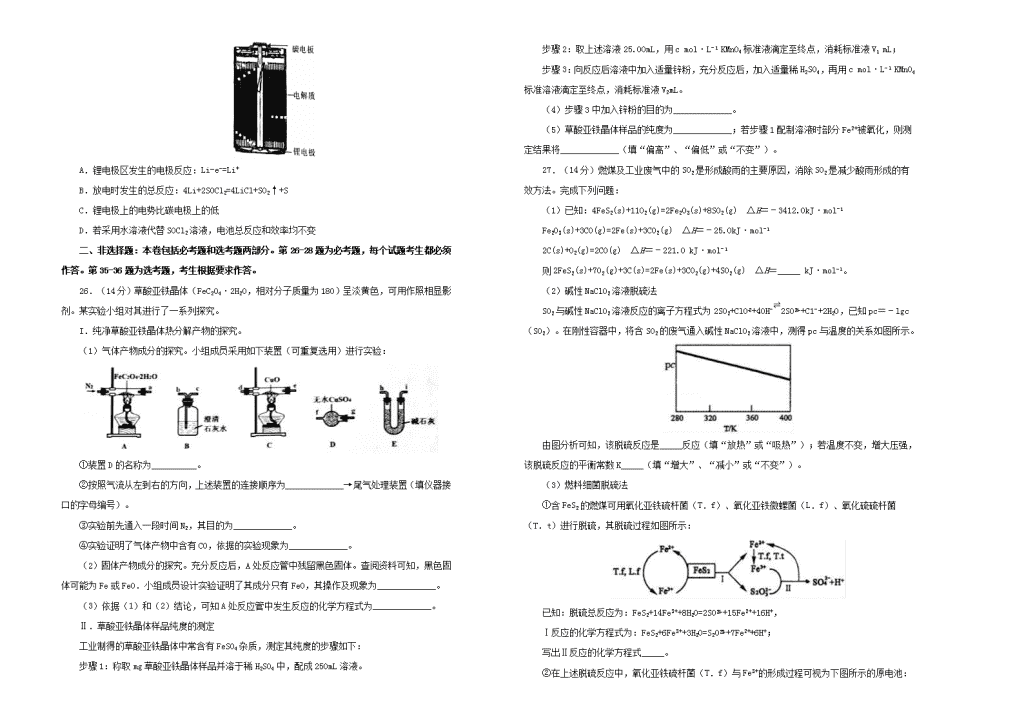
2019年高考高三最新信息卷化学(三)注意事项:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答题前,考生务必将自己的姓名、考生号填写在答题卡上。2.回答第Ⅰ卷时,选出每小题的答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。写在试卷上无效。3.回答第Ⅱ卷时,将答案填写在答题卡上,写在试卷上无效。4.考试结束,将本试卷和答题卡一并交回。可能用到的相对原子质量:H1C12N14O16Na23S32Cl35.5K39一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。7.下列说法正确的是A.高级脂肪酸乙酯是生物柴油中的一种成分,它属于油脂B.天然纤维、聚酯纤维、光导纤维都属于有机高分子材料C.离子交换膜在工业上应用广泛,如在氯碱工业中使用的阴离子交换膜D.国产大客机C919大规模使用先进的材料铝锂合金,该合金密度小,强度高8.从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10−5,Ksp(PbSO4)=1.5×10−8,PbCl2(s)+2Cl−(aq)=PbCl(aq)。下列说法错误的是A.合理处理废铅蓄电池有利于资源再利用和防止重金属污染B.步骤①中可用浓硫酸代替浓盐酸C.步骤①、②、③中均涉及过滤操作D.PbSO4(s)+2Cl−(aq)PbCl2(s)+SO(aq)的平衡常数为7.5×10−49.设NA为阿伏加德罗常数的值。下列叙述正确的是A.标准状况下,22.4LCO和CO2的混合物中,含碳原子的数目为NAB.14g分子式为C5H10的烃中,含有的碳碳双键的数目为0.2NAC.0.1mol/L的CH3COONH4溶液中,含铵根离子数目小于0.1NAD.标准状况下2.24LCl2通入足量水中或NaOH溶液中,转移电子数目为0.1NA10.依据反应2NaIO3+5SO2+4H2O=I2+3H2SO4+2NaHSO4,利用下列装置从含NaIO3的废液中制取单质碘的CCl4溶液并回收NaHSO4。其中装置正确且能达到相应实验目的是A.①②③④B.①②③C.②③④D.②④11.青出于蓝而胜于蓝,“青”指的是靛蓝,是人类使用历史悠久的染料之一,下列为传统制备靛蓝的过程:下列说法不正确的是A.靛蓝的分子式为C16H10N2O2B.浸泡发酵过程发生的反应为取代反应C.吲哚酚的苯环上的二氯代物有4种D.1mol吲哚酚与H2加成时可消耗4molH212.主族元素W、X、Y、Z的原子序数依次增加,且均不大于20,它们可以组成化学式为ZXY3W8的硅酸盐。X3+与W2-具有相同的电子层结构,W、Z与X、Y的质子数之和相等。下列判断正确的是A.化合物ZXW2的水溶液呈碱性B.简单气态氢化物稳定性:Y>WC.最高价氧化物对应水化物酸性:X>YD.简单离子半径:X>Z13.锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e−=4Cl−+S+SO2↑,该电池工作时,下列说法错误的是nA.锂电极区发生的电极反应:Li-e−=Li+B.放电时发生的总反应:4Li+2SOCl2=4LiCl+SO2↑+SC.锂电极上的电势比碳电极上的低D.若采用水溶液代替SOCl2溶液,电池总反应和效率均不变二、非选择题:本卷包括必考题和选考题两部分。第26-28题为必考题,每个试题考生都必须作答。第35-36题为选考题,考生根据要求作答。26.(14分)草酸亚铁晶体(FeC2O4·2H2O,相对分子质量为180)呈淡黄色,可用作照相显影剂。某实验小组对其进行了一系列探究。I.纯净草酸亚铁晶体热分解产物的探究。(1)气体产物成分的探究。小组成员采用如下装置(可重复选用)进行实验:①装置D的名称为__________。②按照气流从左到右的方向,上述装置的连接顺序为_____________→尾气处理装置(填仪器接口的字母编号)。③实验前先通入一段时间N2,其目的为_____________。④实验证明了气体产物中含有CO,依据的实验现象为_____________。(2)固体产物成分的探究。充分反应后,A处反应管中残留黑色固体。查阅资料可知,黑色固体可能为Fe或FeO.小组成员设计实验证明了其成分只有FeO,其操作及现象为_____________。(3)依据(1)和(2)结论,可知A处反应管中发生反应的化学方程式为_____________。Ⅱ.草酸亚铁晶体样品纯度的测定工业制得的草酸亚铁晶体中常含有FeSO4杂质,测定其纯度的步骤如下:步骤1:称取mg草酸亚铁晶体样品并溶于稀H2SO4中,配成250mL溶液。步骤2:取上述溶液25.00mL,用cmol·L−1KMnO4标准液滴定至终点,消耗标准液V1mL;步骤3:向反应后溶液中加入适量锌粉,充分反应后,加入适量稀H2SO4,再用cmol·L−1KMnO4标准溶液滴定至终点,消耗标准液V2mL。(4)步骤3中加入锌粉的目的为_____________。(5)草酸亚铁晶体样品的纯度为_____________;若步骤1配制溶液时部分Fe2+被氧化,则测定结果将_____________(填“偏高”、“偏低”或“不变”)。27.(14分)燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:(1)已知:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g)ΔH=﹣3412.0kJ·mol−1Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)ΔH=﹣25.0kJ·mol−12C(s)+O2(g)=2CO(g)ΔH=﹣221.0kJ·mol−1则2FeS2(s)+7O2(g)+3C(s)=2Fe(s)+3CO2(g)+4SO2(g)ΔH=_____kJ·mol−1。(2)碱性NaClO2溶液脱硫法SO2与碱性NaClO2溶液反应的离子方程式为2SO2+ClO+4OH−⇌2SO+C1−+2H2O,已知pc=﹣lgc(SO2)。在刚性容器中,将含SO2的废气通入碱性NaClO2溶液中,测得pc与温度的关系如图所示。由图分析可知,该脱硫反应是_____反应(填“放热”或“吸热”);若温度不变,增大压强,该脱硫反应的平衡常数K_____(填“增大”、“减小”或“不变”)。(3)燃料细菌脱硫法①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:已知:脱硫总反应为:FeS2+14Fe3++8H2O=2SO+15Fe2++16H+,Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O=S2O+7Fe2++6H+;写出Ⅱ反应的化学方程式_____。②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为下图所示的原电池:n该细胞膜为_____(填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为____________________________。该方法在高温下脱硫效率大大降低,原因是____________________。28.(15分)氯化亚锡用途广泛,在无机工业中用作还原剂,在口腔护理行业中,二水氯化亚锡多用于防龋齿脱敏类牙膏中,以预防龋齿的发生。某研究小组制取二水氯化亚锡工艺流程如下:查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。Ⅱ.SnCl2易水解生成碱式氯化亚锡。(1)四氯化锡暴露于空气中与空气中水分反应生成白烟,有强烈的刺激性气味,生成偏锡酸(H2SnO3),写出该反应的化学方程式______;(2)将金属锡熔融,然后泼入冷水,激成锡花,其目的是______;(3)在制备二水氯化亚锡时,温度对锡转化率的影响如图1所示,则该反应应控制的温度范围为______℃;(4)反应原料中盐酸浓度对结晶率的影响如图2所示,则盐酸浓度应控制的范围为______,原因______。(5)反应釜中发生反应的化学方程式为______;(6)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应)①将该试样溶于盐酸,发生反应为Sn+2HCl=SnCl2+H2↑;②加入过量FeCl3溶液③用已知浓度的K2Cr2O7滴定②中生成的Fe2+,则反应的离子方程式为______;(7)取1.125g锡粉,经上述各步反应后,共用去0.1000mol/LK2Cr2O7溶液30.00mL,锡粉中锡的质量分数为______。35.【化学——选修3:物质结构与性质】(15分)2016年诺贝尔化学奖授予在“分子机器设计和合成”领域有突出成就的三位科学家,其研究对象之一“分子开关”即与大环主体分子苯芳烃、硫或氮杂环杯芳烃等有关。回答下列问题:(1)对叔丁基杯[4]芳烃(如图Ⅰ所示)可用于ⅢB族元素对应离子的萃取,如La3+、Sc2+。写出基态二价钪离子(Sc2+)的核外电子排布式:________,其中电子占据的轨道数为________个。(2)对叔丁基杯[4]芳烃由4个羟基构成杯底,其中羟基氧原子的杂化方式为________,羟基间的相互作用力为________。(3)不同大小的苯芳烃能识别某些离子,如:、SCN−等。一定条件下,SCN−与MnO2反应可得到(SCN)2,试写出(SCN)2的结构式______________________________。(4)NH3分子在独立存在时H-N-H键角为106.7°。如图[Zn(NH3)6]2+离子的部分结构以及H-N-H键角的测量值。解释配合物中H-N-H键角变为109.5°的原因:______。(5)橙红色的八羰基二钴[Co2(CO)8]的熔点为52℃,可溶于乙醇、乙醚、苯等有机溶剂。该晶体属于________晶体,八羰基二钴在液氨中被金属钠还原成四羰基钴酸钠[NaCo(CO)4],四羧基钴酸钠中含有的化学键为_________________。(6)已知C60分子结构和C60晶胞示意图(如图Ⅱ、图Ⅲ所示):则一个C60分子中含有σ键的个数为________,C60晶体密度的计算式为________g·cm−3。(NA为阿伏伽德罗常数的值)36.【化学——选修5:有机化学基础】(15分)芳香族化合物A()是重要的有机化工原料。由A制备有机化合物F的合成路线(部分反应条件略去)如下图所示:n(1)A的分子式是___________,B含有的官能团的名称是______________________。(2)D→E的反应类型是______________________。(3)已知G能与金属钠反应,则G的结构简式为______________________。(4)写出E→F的化学方程式:_________________________________。(5)龙胆酸D的同分异构体有多种,符合下列条件的有_______种。写出其中一种核磁共振氢谱有六组峰的同分异构体的结构简式:______________________。①能发生银镜反应;②与FeCl3溶液发生显色反应;③1mol该物质能与2molNa2CO3反应。(6)已知:。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯()的合成路线(无机试剂任用)。n绝密★启用前2019年高考高三最新信息卷化学答案(三)7.【答案】D【解析】A.油脂是高级脂肪酸和甘油所生成的酯,即高级脂肪酸甘油酯,而高级脂肪酸乙酯属于酯,但不属于油脂,故A错误;B.光导纤维的主要成分是二氧化硅,二氧化硅不属于有机高分子材料,天然纤维、聚酯纤维属于有机高分子材料,故B错误;C.氯碱工业中需要用到阳离子交换膜,钠离子通过阳离子交换膜迁移到阴极,阴极区可得到氢气和氢氧化钠,故C错误;D.铝和锂的密度都较小,故铝锂合金的密度较小;合金的强度通常都高于其成分金属,故铝锂合金的强度较大,适合用于制造客机的材料,故D正确。故选D。8.【答案】B【解析】A.铅会使蛋白质变性,造成人体重金属中毒,所以合理处理废铅蓄电池有利于资源再利用和防止重金属污染,故A正确;B.浓硫酸不与PbO2反应,步骤①中若用浓硫酸代替浓盐酸,则铅无法反应到滤液中,故B错误;C.步骤①、②、③中均需要分离液体与不溶性固体,都涉及过滤操作,故C正确;D.PbSO4(s)+2Cl−(aq)PbCl2(s)+SO(aq)的平衡常数为:7.5×10−4,故D正确;答案选B。9.【答案】A【解析】A.标准状况下,22.4LCO和CO2的混合物中,含碳原子的数目为:,A正确;B.C5H10的烃结构未知,因此无法确定是否含有碳碳双键,B错误;C.溶液体积未知,无法计算氨根离子个数,C错误;D.氯气与水反应为可逆反应,标准状况下2.24LCl2物质的量为0.1mol,氯气与足量水反应,转移电子数小于0.1NA,D错误;故合理选项是A。10.【答案】B【解析】①浓硫酸在加热条件下与铜反应制取SO2,装置正确且能达到相应实验目的;②气体和液体反应,有防倒吸装置,装置正确且能达到相应实验目的;③用四氯化碳从废液中萃取碘,静置后分液,装置正确且能达到相应实验目的;④蒸发溶液时用蒸发皿,而不应用坩埚,装置错误,不能达到实验目的;故B项正确,答案选B。11.【答案】C【解析】A.根据题干中的结构简式,靛蓝的分子式为C16H10N2O2,故A正确;B.浸泡发酵过程发生的反应可以看作是-O-R被羟基取代,故B正确;C.因为该结构不对称,二氯代物一共有6种,故C错误;D.吲哚酚分子中含有一个苯环及一个碳碳双键,所以1mol吲哚酚与H2加成时可消耗4molH2,故D正确,故选C。12.【答案】A【解析】A.KAlO2溶液由于AlO水解显碱性,故符合题意;B.简单气态氢化物的稳定性SiH4