- 175.96 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
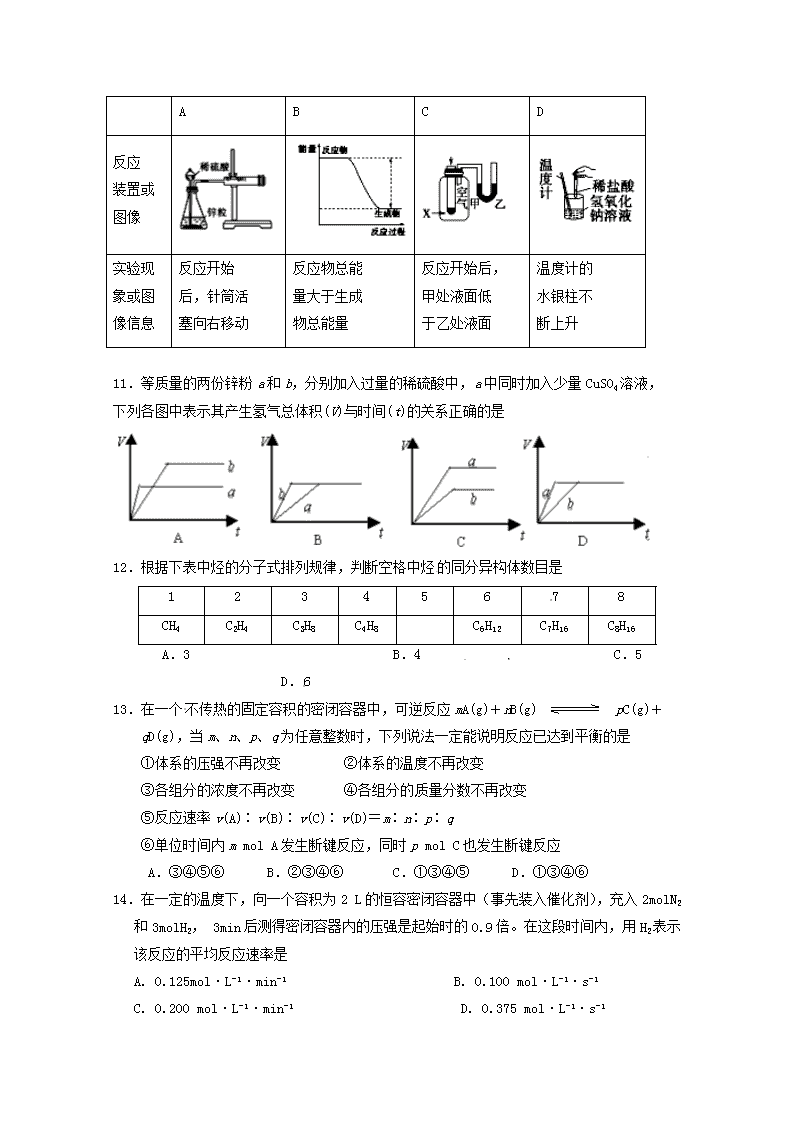
延边第二中学2018~2019学年度第二学期期中考试高一年级化学试卷考试说明:本试卷分第Ⅰ卷(选择题60分)和第Ⅱ卷(非选择题40分)、附加题(15分)三部分,试卷共8页,共三大题,25小题,附加题计入总分。可能用到的相对原子质量:H:1C:12N:14O:16Na:23Mg:24Al:27S:32K:39Fe:56Co:59Cu:64第Ⅰ卷选择题(60分)一、单项选择题(20小题,每小题3分,共60分)1.下列表述正确的是A.H、D、T互为同素异形体B.中子数为20的氯原子:C.四氯化碳的电子式:D.Cl﹣的结构示意图:2.元素的化学性质主要取决于原子的A.原子序数B.核外电子数C.核内中子数D.最外层电子数3.下列说法中正确的是A.镍氢电池、锂离子电池和锌锰干电池都是二次电池B.燃料电池是一种高效但是会污染环境的新型电池C.化学电池的反应基础是氧化还原反应D.铅蓄电池放电时正极是Pb负极是PbO24.下列四种酸溶液,能跟锌片反应生成氢气且最初反应速率最快的是A.20℃20mL2mol/L的硫酸溶液B.20℃30mL2mol/L的盐酸溶液C.10℃20mL3mol/L的盐酸溶液D.50℃10mL8mol/L的硝酸溶液5.下列各组物质中,属于同系物的是(2)C6H6A.⑴⑶B.⑴⑷C.⑵⑶D.⑵⑷n6.下列有关叙述正确的是A.元素性质呈周期性变化的根本原因是元素化合价呈周期性变化B.BF3和CO2分子中所有原子均满足最外层为8电子结构C.已知114号元素的一种核素的质量数为298,则该元素的相对原子质量为298D.[14NH3T]+中,电子数、质子数、中子数之比为10∶11∶97.短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示。常温下,Al能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是XYWQA.Y的最高化合价为+6B.简单氢化物的稳定性:Y>WC.简单离子半径:W>Q>Y>XD.X、Y、W不可能同时存在于一种离子化合物中8.运用元素周期律分析下面的推断,其中不正确的是A.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂B.砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸C.由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>SD.硅、锗都位于金属与非金属的交界处,都可以做半导体材料9.液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示。该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液。下列关于该电池的叙述正确的是A.b极发生氧化反应B.a极的反应式为N2H4+4OH--4e-=N2↑+4H2OC.放电时,电子从a极经过负载流向b极,再经溶液流回a极D.其中的离子交换膜需选用阳离子交换膜10.下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是nABCD反应装置或图像实验现象或图像信息反应开始后,针筒活塞向右移动反应物总能量大于生成物总能量反应开始后,甲处液面低于乙处液面温度计的水银柱不断上升11.等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4溶液,下列各图中表示其产生氢气总体积(V)与时间(t)的关系正确的是12.根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是 12345678CH4C2H4C3H8C4H8C6H12C7H16C8H16A.3 B.4 C.5 D.613.在一个不传热的固定容积的密闭容器中,可逆反应mA(g)+nB(g)pC(g)+qD(g),当m、n、p、q为任意整数时,下列说法一定能说明反应已达到平衡的是①体系的压强不再改变②体系的温度不再改变③各组分的浓度不再改变④各组分的质量分数不再改变⑤反应速率v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q⑥单位时间内mmolA发生断键反应,同时pmolC也发生断键反应A.③④⑤⑥ B.②③④⑥C.①③④⑤D.①③④⑥14.在一定的温度下,向一个容积为2L的恒容密闭容器中(事先装入催化剂),充入2molN2和3molH2,3min后测得密闭容器内的压强是起始时的0.9倍。在这段时间内,用H2表示该反应的平均反应速率是A.0.125mol·L-1·min-1B.0.100mol·L-1·s-1C.0.200mol·L-1·min-1D.0.375mol·L-1·s-1n15.一定量的CH4燃烧后得到的产物是CO、CO2、H2O(g),此混合物的质量为49.6g,当其缓缓通过足量的无水CaCl2时气体质量减少25.2g,则混合气中CO的质量为 A.24.4g B.13.2g C.12.5g D.11.2g16.下列化学式只表示一种纯净物的是A.C2H6 B.C4H10 C.C2H4Cl2 D.C17.少量铁粉与100mL0.01mol•L﹣1的稀盐酸反应,反应速率太慢,为了加快此反应速率而不改变H2的产量,可以使用如下方法中的①加H2O ②加NaOH固体 ③滴入几滴浓盐酸 ④加CuO固体 ⑤加NaCl溶液 ⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10mL0.1mol•L﹣1的盐酸.A.①⑤⑦B.②④⑥C.③⑦⑧D.③⑥⑦⑧18.氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法不正确的是A.该装置将化学能转化为电能B.为了增加灯泡亮度,可以将电极碳棒变得多粗糙多孔C.电子迁移方向:电极a→灯泡→电极b→电解质溶液→电极aD.该电池的总反应:2H2+O2=2H2O19.有机物与氯气发生取代反应,生成的一氯代物有A.3种 B.2种 C.1种 D.4种20.由两种烃组成的混合物,无论以何种比例混合,只要混合物的总质量一定,完全燃烧生成CO2的质量也一定,则此两种烃一定满足A.互为同分异构体 B.最简式相同 n C.为同系物 D.符合同一通式第Ⅱ卷非选择题(共55分)二、填空题(4小题,共40分)21.(10分)某温度时,在一个10L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空:(1)该反应的化学方程式为_______________________________;(2)反应开始至2min,以气体Z表示的平均反应速率为________________;(3)混合气体的平均相对分子质量比起始时___________;(填“大”,“小”或“相等”)平衡时容器内混合气体密度比起始时______(填“大”,“小”或“相等”)(4)将amolX与bmolY的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n(X)=n(Y)=2n(Z),则原混合气体中a:b=___________.22.(10分)下表是元素周期表短周期的一部分①②③④⑤⑥⑦⑧(1)①~⑦元素中金属性最强的元素是___________(用元素符号表示)。(2)④与⑤形成的化合物的电子式为____________。(3)表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是______(填化学式)。(4)第116号元素(元素符号Lv)被中国科学技术名词审定委员会命名为“”,该元素在元素周期表中的位置是_____________。n(5)核内中子数为N的R2+,质量数为A,则ng它的相同价态氧化物中所含的电子的物质的量约为________mol。23、(10分)如图所示,在不同的电解质溶液中可以组成不同的电池.(1)当电解质溶液为稀硫酸时,Fe电极是(填“正”或“负”)极,其电极反应式为.(2)当电解质溶液为NaOH溶液时,Al电极是(填“正”或“负”)极,其电极反应式为.(3)若把铝改为锌,电解质溶液为浓硝酸,则Fe电极的电极反应式为.24、(10分)(一)在容积为5L的密闭容器中,通入5molN2和8molH2,在一定条件下反应生成NH3,当反应进行到2min时,测得容器内有4molNH3。则:(1)2min时,容器内n(N2)==,c(H2)==。(2)2min时,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为。(二)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C及B与D分别是同主族元素;已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又知A、C两元素原子序数之和是B、D两元素原子序数之和的一半。请回答下列问题:(1)写出由A、B、C三元素形成的化合物的电子式,(2)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式________________________。三、附加题(每空3分,共15分)25.(1)用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:nc电极的反应方程式为:。(2)有机物C4H10与氯气发生取代反应,生成的一氯代物有种。(3)已知反应H2(g)+Br2(l)2HBr(g)在25℃、101kPa下进行,放出热量为72kJ,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:H2(g)Br2(g)HBr(g)1mol分子中的化学键断裂时需要吸收的能量/kJ436a369则表中a为()(4)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。n一定条件,在水溶液中1molCl-、ClOX-(x=1,2,3,4)的能量(KJ)相对大小如上图所示。①D是(填离子符号)。②B→A+C反应的离子方程式为;n高一年级化学试卷答案1—5DDCAB6—10DBCBA11-15AABAD16—20ACCAB21.(10分)(1)3X+Y⇌2Z;(2)0.01mol/(L•min);(3)大相等;;(4)7:5.22、(10分)(1)Mg(2)(3)HNO3>H2CO3>H2SiO3(4)第七周期第VIA族(5)23、(10分)正2H++2e﹣═H2↑负Al﹣3e﹣+4OH﹣═AlO2﹣+2H2ONO3+2H+e═NO2↑+H2O24.(10分)3mol0.4mol/L9:13HSO3-+H+====SO2↑+H2O25附加题(1)CH3OH-6e-+H2O===CO2+6H+(2)4(3)200①ClO4-②3ClO-=ClO3-+2Cl-