- 554.01 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
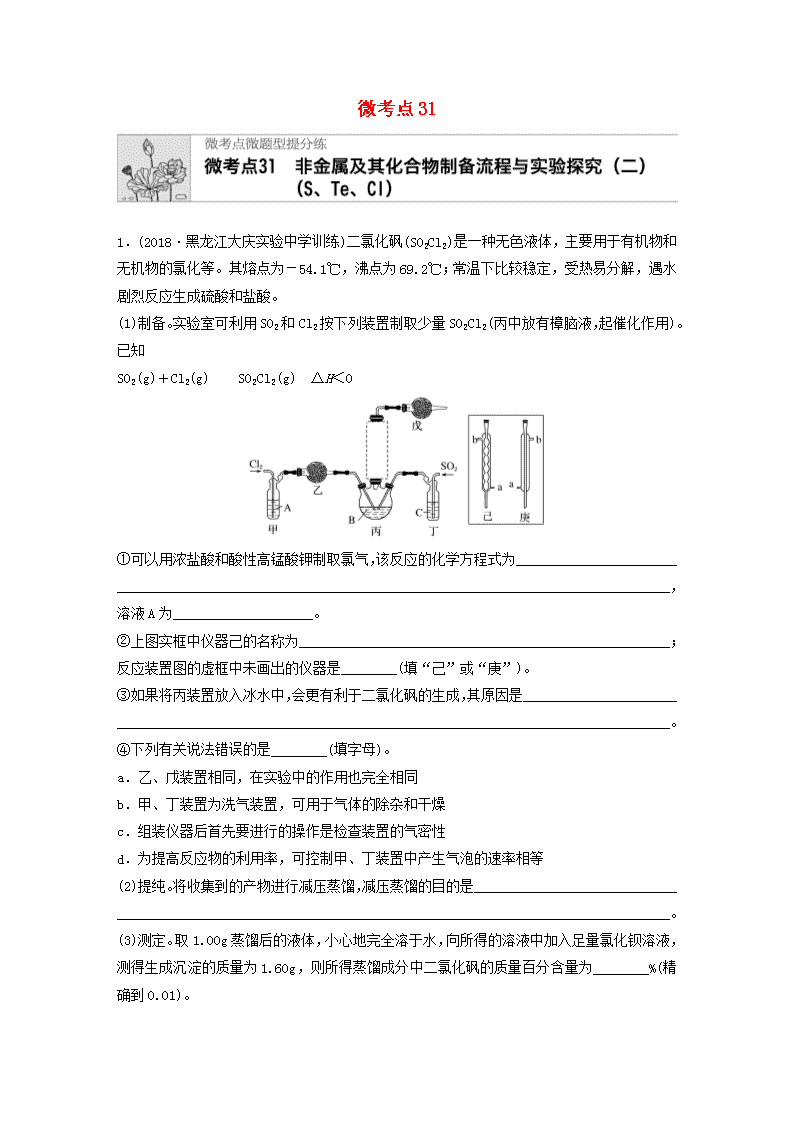
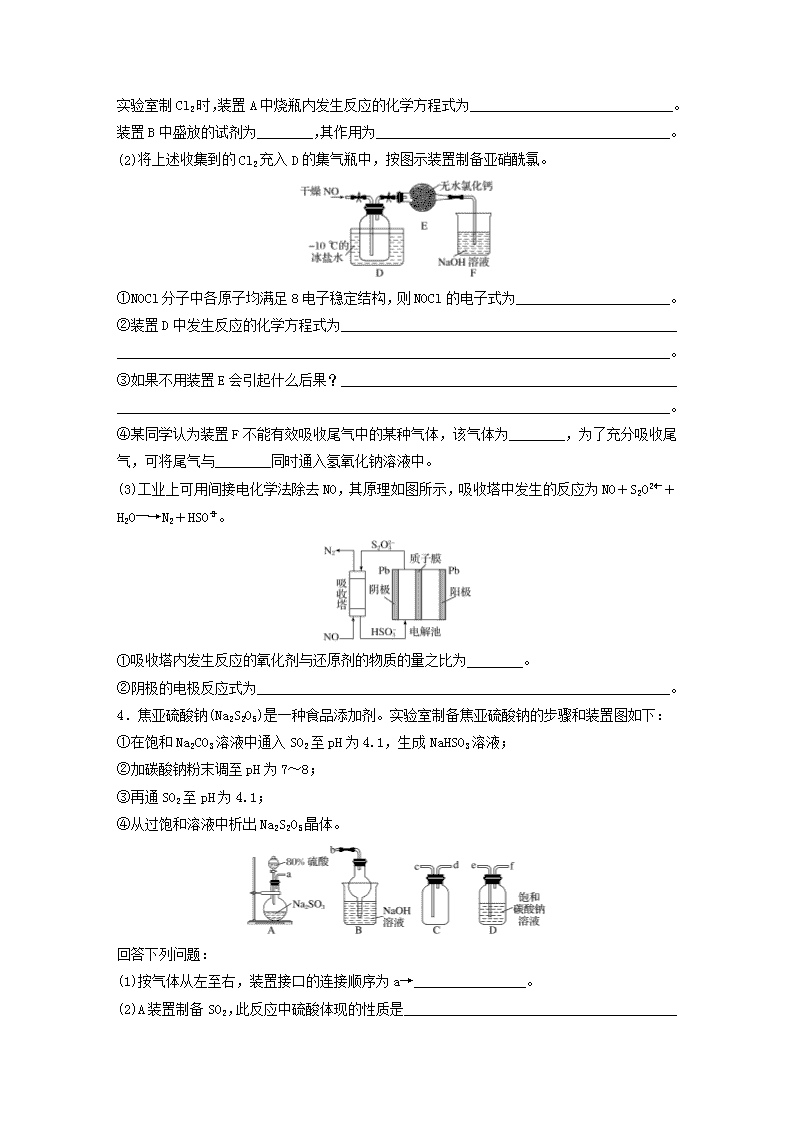
微考点311.(2018·黑龙江大庆实验中学训练)二氯化砜(SO2Cl2)是一种无色液体,主要用于有机物和无机物的氯化等。其熔点为-54.1℃,沸点为69.2℃;常温下比较稳定,受热易分解,遇水剧烈反应生成硫酸和盐酸。(1)制备。实验室可利用SO2和Cl2按下列装置制取少量SO2Cl2(丙中放有樟脑液,起催化作用)。已知SO2(g)+Cl2(g)SO2Cl2(g) ΔH<0①可以用浓盐酸和酸性高锰酸钾制取氯气,该反应的化学方程式为______________________________________________________________________________________________________,溶液A为____________________。②上图实框中仪器己的名称为_____________________________________________________;反应装置图的虚框中未画出的仪器是________(填“己”或“庚”)。③如果将丙装置放入冰水中,会更有利于二氯化砜的生成,其原因是_____________________________________________________________________________________________________。④下列有关说法错误的是________(填字母)。a.乙、戊装置相同,在实验中的作用也完全相同b.甲、丁装置为洗气装置,可用于气体的除杂和干燥c.组装仪器后首先要进行的操作是检查装置的气密性d.为提高反应物的利用率,可控制甲、丁装置中产生气泡的速率相等(2)提纯。将收集到的产物进行减压蒸馏,减压蒸馏的目的是____________________________________________________________________________________________________________。(3)测定。取1.00g蒸馏后的液体,小心地完全溶于水,向所得的溶液中加入足量氯化钡溶液,测得生成沉淀的质量为1.60g,则所得蒸馏成分中二氯化砜的质量百分含量为________%(精确到0.01)。n(4)贮存。二氯化砜应储存于阴凉、干燥、通风良好的库房。但久置后微显黄色,其原因是_____________________________________________________________________________________。2.碲单质和化合物在化工生产等方面具有广泛应用。工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:已知:TeO2微溶于水,易溶于较浓的强酸和强碱。在元素周期表中碲与硫同主族,碲原子比硫原子多2个电子层。(1)在元素周期表中,碲位于_______________________________________________________。(2)Cu2Te中碲元素的化合价为________。(3)“加压酸浸1”过程中控制溶液的pH为5左右,将碲转化成TeO2,其中“加压”的目的是________________,写出“加压酸浸1”过程中发生反应的化学方程式________________________________________________________________________________________________。(4)“还原”反应中氧化产物和还原产物的物质的量之比为________。(5)工业上另一种提取碲的方法是将铜阳极泥在空气中焙烧,使碲转化成TeO2,再碱浸进一步将TeO2转化成Na2TeO3,以石墨为电极电解Na2TeO3溶液获得Te。电解过程中阴极附近电解质溶液的pH将________(填“增大”“减小”或“不变”);阳极产物主要是O2,有少量Na2TeO4,写出阳极上生成Na2TeO4的电极反应式:____________________________________________________________________________________________________________________。(6)以滤液为原料回收铜有如下方案:方案1:向一定量滤液中加入适量的氢氧化钠溶液,调节溶液pH,使其充分反应,过滤、洗涤、灼烧、还原得铜单质。方案2:请你参照上述工艺流程,利用置换反应原理设计流程___________________________。3.(2019·宁夏银川高三教学质量检测)亚硝酰氯(NOCl)是一种红褐色液体或黄色气体,其熔点为-64.5℃,沸点为-5.5℃,遇水易水解。它是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。(1)实验室制备原料气NO和Cl2的装置如图所示。n实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为_____________________________。装置B中盛放的试剂为________,其作用为__________________________________________。(2)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为______________________。②装置D中发生反应的化学方程式为_______________________________________________________________________________________________________________________________。③如果不用装置E会引起什么后果?_______________________________________________________________________________________________________________________________。④某同学认为装置F不能有效吸收尾气中的某种气体,该气体为________,为了充分吸收尾气,可将尾气与________同时通入氢氧化钠溶液中。(3)工业上可用间接电化学法除去NO,其原理如图所示,吸收塔中发生的反应为NO+S2O+H2O―→N2+HSO。①吸收塔内发生反应的氧化剂与还原剂的物质的量之比为________。②阴极的电极反应式为___________________________________________________________。4.焦亚硫酸钠(Na2S2O5)是一种食品添加剂。实验室制备焦亚硫酸钠的步骤和装置图如下:①在饱和Na2CO3溶液中通入SO2至pH为4.1,生成NaHSO3溶液;②加碳酸钠粉末调至pH为7~8;③再通SO2至pH为4.1;④从过饱和溶液中析出Na2S2O5晶体。回答下列问题:(1)按气体从左至右,装置接口的连接顺序为a→________________。(2)A装置制备SO2,此反应中硫酸体现的性质是_______________________________________n(填字母)。收集SO2的方法是____________。a.强氧化性b.吸水性c.脱水性d.强酸性(3)写出制备Na2S2O5的总化学方程式:______________________________________________________________________________________________________________________________。(4)Na2S2O5水溶液呈酸性,其原因是________________________________________________________________________________________________________________________________。(5)步骤①中,测定溶液pH=4.1选用的是__________(填字母)。a.广范pH试纸 b.pH计 c.精密pH试纸pH>4.1时,则产品中会有副产物,其化学式是________________________________________。(6)①饱和溶液中析出焦亚硫酸钠晶体,分离出产品的方法是__________、洗涤和干燥。②已知:Na2S2O5+2HCl===2NaCl+2SO2↑+H2O。检验焦亚硫酸钠产品中是否含有Na2SO4的操作是_______________________________________________________________________________________________________________________________________________________。5.(2019·温州中学质检)高氯酸可用于生产高氯酸盐、人造金刚石提纯、电影胶片制造、医药工业等方面。工业上用以下工艺流程生产高氯酸,同时得到副产物亚氯酸钠(NaClO2)粗品。已知:①NaHSO4的溶解度随温度的升高而增大,适当条件下可结晶析出。②高氯酸是迄今为止已知酸中的最强酸,沸点为90℃。③NaClO2固体受热易分解。请回答下列问题:(1)反应器Ⅰ中发生反应的化学方程式为____________________________________________________________________________________________________________________________,冷却过滤的目的是_______________________________________________________________,能用蒸馏法分离出高氯酸的原因是_________________________________________________。(2)反应器Ⅱ中通入SO2的目的是___________________________________________________。(3)从反应器Ⅱ中获得NaClO2粗品的实验操作依次是________(填字母,下同),进一步提纯的操作为______。a.过滤 b.重结晶 c.蒸馏 d.蒸发浓缩 e.蒸干灼烧 f.冷却结晶 g.萃取分液(4)现提供0.1mol·L-1的NaHSO4溶液,请设计实验方案判断HSO在溶液中是否完全电离:________________________________________________________________________________n_______________________________________________________________________________________________________________________________________________________________。n答案精析1.(1)①16HCl(浓)+2KMnO4===5Cl2↑+2MnCl2+2KCl+8H2O 饱和氯化钠溶液 ②球形冷凝管 己 ③该反应是放热反应,降低温度能使平衡向右移动,有利于二氯化砜的生成 ④a(2)降低二氯化砜的沸点,减少二氯化砜的分解(3)92.70(4)二氯化砜自身分解生成的氯气溶于二氯化砜中解析 (1)①Cl2通过甲除去其中的杂质HCl,溶液A为饱和食盐水。②因为球形冷凝管的冷却效果好,所以反应装置图的虚框中未画出的仪器是己。④乙的作用是除去水蒸气,戊的作用是除去剩余的有毒气体Cl2、SO2,并且防止空气中的水蒸气进入反应装置,二者作用不完全相同;可以控制甲、丁装置中产生气泡的速率相等,Cl2和SO2的配比符合反应比。(3)沉淀是硫酸钡,二氯化砜的质量百分含量为1.60××100%≈92.70%。2.(1)第五周期ⅥA族(2)-2(3)增大O2浓度,提高浸出率 Cu2Te+2O2+2H2SO4===2CuSO4+TeO2+2H2O(4)2∶1(5)增大 TeO-2e-+2OH-===TeO+H2O(6)3.(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O饱和食盐水 除去Cl2中的HCl气体(2)①②2NO+Cl22NOCl ③装置F中的水蒸气进入装置D中,导致产品水解 ④NO O2(3)①1∶1 ②2HSO+2H++2e-===S2O+2H2O解析 (1)实验室利用MnO2和浓盐酸反应制取氯气,化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。由于浓盐酸易挥发,制得的氯气中含有杂质HCl,故装置B中盛放的试剂为饱和食盐水,其作用为除去HCl。(2)①NOCl分子中各原子均满足8电子稳定结构,则NOCl的结构式为O==N—Cl,电子式为。②装置D中NO和Cl2反应生成NOCl,化学方程式为2NO+Cl22NOCl。③根据提供的信息,NOCln遇水易水解,如果不用装置E,装置F中的水蒸气会进入装置D中,导致产品水解。④NO与NaOH溶液不反应,要充分吸收NO,可以将NO和O2同时通入NaOH溶液中。(3)①由NON2、S2O2HSO,可知NO、S2O的物质的量之比为1∶1。②由题图知,阴极上HSO发生还原反应,生成S2O,电极反应式为2HSO+2H++2e-===S2O+2H2O。4.(1)c→d→e→f→b(2)d 向上排空气法(3)Na2CO3+2SO2===Na2S2O5+CO2(4)Na2S2O5与H2O反应生成NaHSO3,HSO的电离程度大于其水解程度(5)bc Na2SO3(6)①过滤 ②取少量产品于试管中,加适量蒸馏水溶解,滴加足量盐酸和氯化钡溶液解析 (1)设计思路:制备SO2的发生装置、安全瓶、反应装置、尾气吸收装置。(2)硫酸为二元强酸,与亚硫酸钠反应生成SO2。用向上排空气法收集SO2。(3)碳酸钠与二氧化硫反应生成焦亚硫酸钠和二氧化碳。(4)焦亚硫酸钠中硫元素为+4价,焦亚硫酸钠与水反应生成亚硫酸氢钠,亚硫酸氢根离子在水中的电离程度大于其水解程度,故溶液呈酸性。(5)广范pH试纸只能粗略地测定pH,读数为整数。如果溶液酸性弱,会生成亚硫酸钠副产品。(6)①产品已析出,直接过滤。②检验产品中是否含有硫酸钠的试剂是盐酸、氯化钡溶液。5.(1)3NaClO3+3H2SO4(浓)===HClO4+2ClO2↑+3NaHSO4+H2O 降低NaHSO4的溶解度并分离出NaHSO4晶体 高氯酸的沸点比较低,与溶剂H2O的沸点相差10℃,容易从溶液中逸出(2)SO2作为还原剂把ClO2还原为NaClO2(3)dfa b(4)用精密pH试纸或pH计测定0.1mol·L-1的NaHSO4溶液的pH,如果pH=1,则HSO在溶液中完全电离;如果pH>1,则HSO在溶液中不完全电离