- 400.38 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
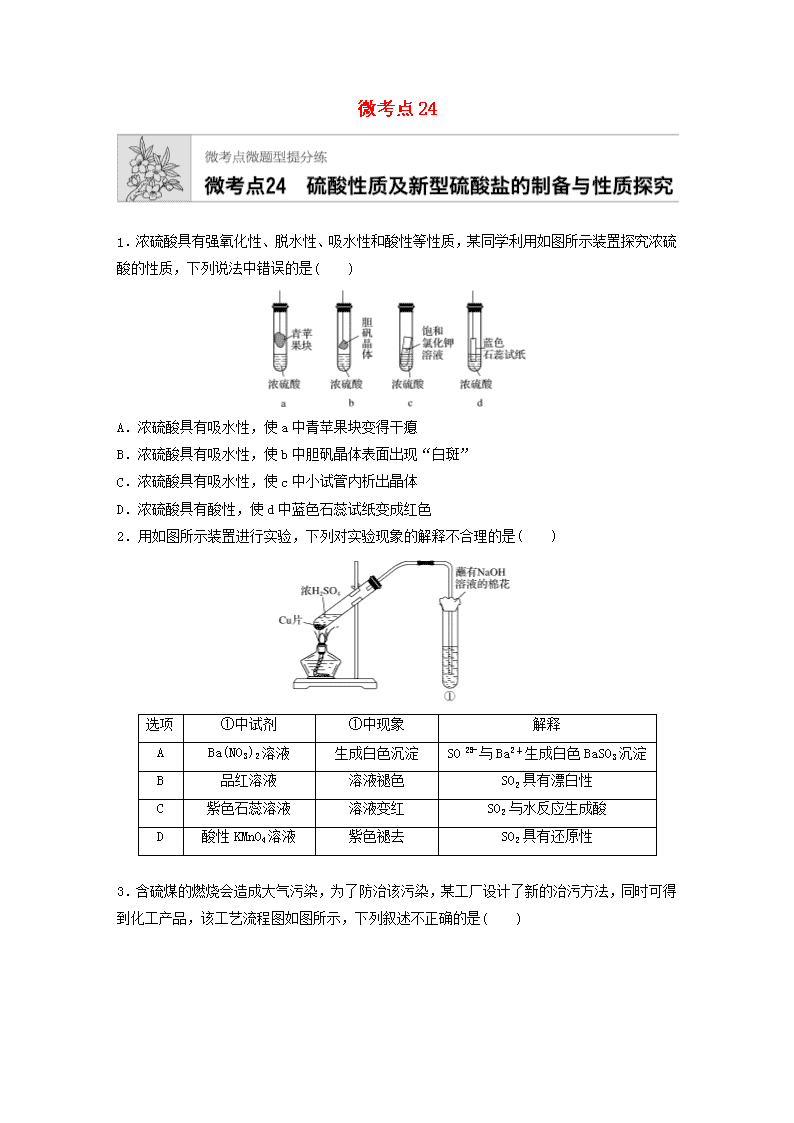
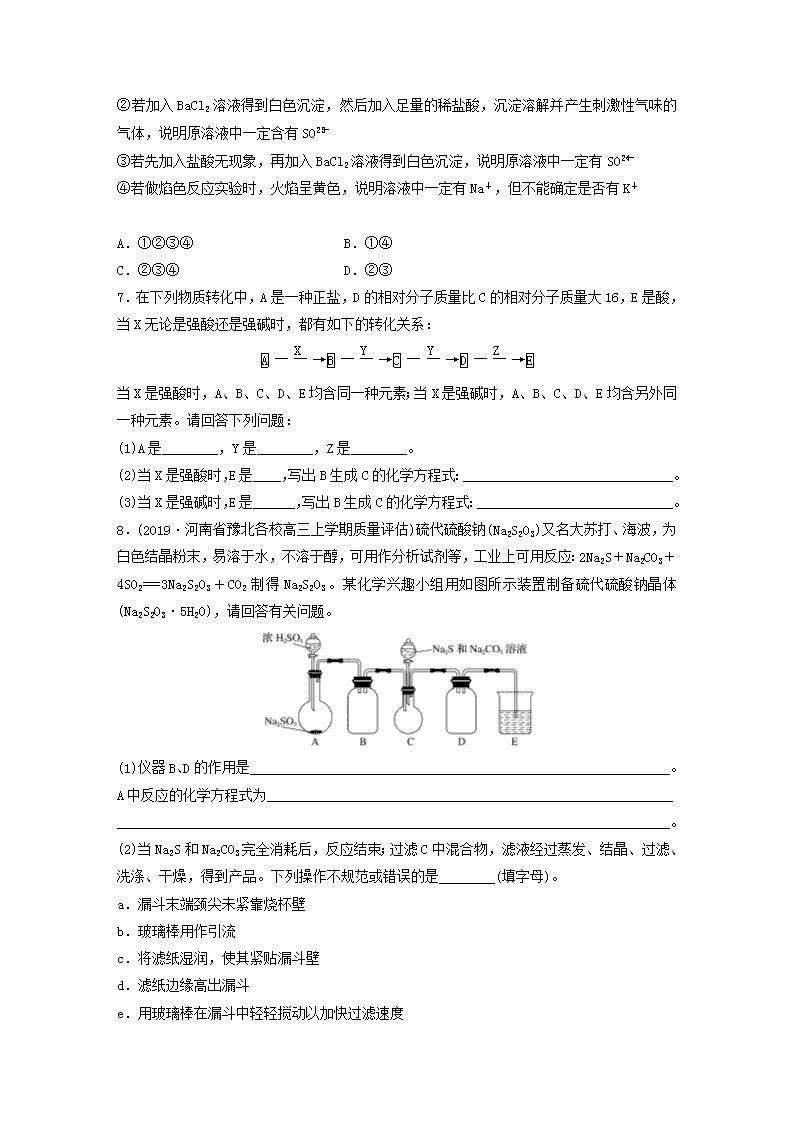
微考点241.浓硫酸具有强氧化性、脱水性、吸水性和酸性等性质,某同学利用如图所示装置探究浓硫酸的性质,下列说法中错误的是( )A.浓硫酸具有吸水性,使a中青苹果块变得干瘪B.浓硫酸具有吸水性,使b中胆矾晶体表面出现“白斑”C.浓硫酸具有吸水性,使c中小试管内析出晶体D.浓硫酸具有酸性,使d中蓝色石蕊试纸变成红色2.用如图所示装置进行实验,下列对实验现象的解释不合理的是( )选项①中试剂①中现象解释ABa(NO3)2溶液生成白色沉淀SO与Ba2+生成白色BaSO3沉淀B品红溶液溶液褪色SO2具有漂白性C紫色石蕊溶液溶液变红SO2与水反应生成酸D酸性KMnO4溶液紫色褪去SO2具有还原性3.含硫煤的燃烧会造成大气污染,为了防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程图如图所示,下列叙述不正确的是( )nA.该过程中可得到化工产品H2SO4B.该工艺流程是除去煤燃烧时产生的SO2C.该过程中化合价发生改变的元素仅有Fe和SD.图中涉及的反应之一为Fe2(SO4)3+SO2+2H2O===2FeSO4+2H2SO44.(2018·湖南五市十校联考)研究性学习小组做铜与浓硫酸反应的实验时,发现试管底部有白色固体并夹杂有少量黑色物质。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液变为蓝色,黑色固体未溶解。过滤、洗涤后,向黑色固体中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液中加BaCl2溶液后有白色沉淀生成。下列所得结论中正确的是( )A.白色固体中夹杂的少量黑色物质中一定含有Cu元素和S元素B.加入BaCl2溶液后所得白色沉淀是BaSO3C.白色固体中夹杂的少量黑色物质可能是CuOD.铜与浓硫酸反应所得白色固体不是CuSO45.(2019·北京密云模拟)Fe和Mg与H2SO4反应的实验如下:实验现象Fe表面产生大量无色气泡Fe表面产生气泡后迅速停止Mg表面迅速产生大量气泡Fe表面有大量气泡,Mg表面有少量气泡关于上述实验的说法中不正确的是( )A.Ⅰ中产生气体的原因是Fe+2H+===Fe2++H2↑B.取出Ⅱ中的铁棒放入CuSO4溶液中,可立即析出亮红色固体C.Ⅲ中现象说明Mg在浓硫酸中没有被钝化D.Ⅳ中现象说明Mg的金属性比Fe的强6.已知某溶液中可能含有SO、SO及其他某些未知离子,某同学取适量试液加入四支试管中,然后分别进行如下实验并得出相应的结论,其中合理的是( )①若加入BaCl2溶液得到白色沉淀,然后加入足量的稀硝酸,沉淀不消失,说明原溶液中一定含有SOn②若加入BaCl2溶液得到白色沉淀,然后加入足量的稀盐酸,沉淀溶解并产生刺激性气味的气体,说明原溶液中一定含有SO③若先加入盐酸无现象,再加入BaCl2溶液得到白色沉淀,说明原溶液中一定有SO④若做焰色反应实验时,火焰呈黄色,说明溶液中一定有Na+,但不能确定是否有K+ A.①②③④B.①④C.②③④D.②③7.在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。请回答下列问题:(1)A是________,Y是________,Z是________。(2)当X是强酸时,E是____,写出B生成C的化学方程式:______________________________。(3)当X是强碱时,E是______,写出B生成C的化学方程式:____________________________。8.(2019·河南省豫北各校高三上学期质量评估)硫代硫酸钠(Na2S2O3)又名大苏打、海波,为白色结晶粉末,易溶于水,不溶于醇,可用作分析试剂等,工业上可用反应:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2制得Na2S2O3。某化学兴趣小组用如图所示装置制备硫代硫酸钠晶体(Na2S2O3·5H2O),请回答有关问题。(1)仪器B、D的作用是____________________________________________________________。A中反应的化学方程式为_________________________________________________________________________________________________________________________________________。(2)当Na2S和Na2CO3完全消耗后,反应结束;过滤C中混合物,滤液经过蒸发、结晶、过滤、洗涤、干燥,得到产品。下列操作不规范或错误的是________(填字母)。a.漏斗末端颈尖未紧靠烧杯壁b.玻璃棒用作引流c.将滤纸湿润,使其紧贴漏斗壁d.滤纸边缘高出漏斗e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度n(3)洗涤晶体的液体最好选用________(填字母)。a.蒸馏水b.乙醇c.稀硫酸d.饱和亚硫酸钠溶液(4)实验中要控制SO2的生成速率,可以采取的措施有________________________________________________________________________________________________________(任写一条)。(5)该法制得的晶体中常混有少量Na2SO3和Na2SO4杂质,其中含有Na2SO4的原因是_______________________________________________________________________________________。利用硫代硫酸钠与I2反应的性质可定量测定硫代硫酸钠样品的纯度。现取Wg硫代硫酸钠晶体样品配制成VmL的溶液,加入指示剂,用含I2为amol·L-1的碘水进行滴定,耗用碘水bmL。(已知:2Na2S2O3+I2===Na2S4O6+2NaI)①滴定过程中指示剂应选用________溶液。②样品中硫代硫酸钠晶体(Na2S2O3·5H2O)的纯度是__________________。n答案精析1.D [浓硫酸具有酸性和脱水性,能使d中蓝色石蕊试纸先变红后变黑,D项错误。]2.A [A项,Cu与浓H2SO4反应生成的SO2通入Ba(NO3)2溶液中,SO2首先与水反应生成H2SO3,H2SO3能被NO氧化成SO,SO与Ba2+生成白色沉淀BaSO4,解释不合理;B项,Cu与浓H2SO4反应生成的SO2具有漂白性,能使品红溶液褪色,解释合理;C项,Cu与浓H2SO4反应生成的SO2与水反应生成亚硫酸,紫色石蕊溶液遇酸变红,解释合理;D项,Cu与浓H2SO4反应生成的SO2具有还原性,能被酸性KMnO4溶液氧化,并使酸性KMnO4溶液褪色,解释合理。]3.C [分析图中工艺流程可知,SO2被Fe2(SO4)3溶液氧化生成H2SO4,Fe2(SO4)3则被还原生成FeSO4;FeSO4、H2SO4在O2作用下又重新生成Fe2(SO4)3,参与下一次SO2的吸收处理。A项,由上述分析可知,该工艺流程中得到的化工产品为H2SO4,正确;B项,该工艺流程中将SO2转化为H2SO4,从而除去煤燃烧时产生的SO2,正确;C项,由图可知,该过程中化合价发生改变的元素除Fe和S外,还有O2中的O,错误;D项,由上述分析可知,Fe2(SO4)3吸收SO2过程中发生反应Fe2(SO4)3+SO2+2H2O===2FeSO4+2H2SO4,正确。]4.A 5.B6.C [①无法排除SO的干扰;②Ba2+BaSO3SO2;③已排除SO、Ag+的干扰;④K+的焰色反应应透过蓝色钴玻璃片观察。]7.(1)(NH4)2S O2 H2O(2)H2SO4 2H2S+3O22SO2+2H2O(3)HNO3 4NH3+5O24NO+6H2O解析 本题考查氮、硫及其化合物的转化关系。由D的相对分子质量比C的相对分子质量大16,容易联想D比C增加1个氧原子,则D可能是氧化物,而E为酸,则应为含氧酸,而Y是能提供“O”的物质,A为正盐,与碱反应放出的物质能连续两次被氧化最后得一种含氧酸,可推知A可能是铵盐:ANH3NONO2HNO3,而A与强酸反应时,生成的物质也会连续被氧化两次,最后生成含氧酸,则A可能为硫化物(含S2-):AH2SSO2SO3H2SO4综上所述可确定A是(NH4)2S。8.(1)作安全瓶,防止液体倒吸Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O(2)ade(3)bn(4)调节浓H2SO4的浓度(或调节浓硫酸的滴加速度)(5)装置内空气中的O2氧化Na2S2O3或Na2SO3①淀粉 ②×100%解析 (1)A中发生反应生成SO2。仪器B和D都是防倒吸装置,作安全瓶。(3)硫代硫酸钠晶体不溶于乙醇,用乙醇洗涤晶体,可减少晶体的溶解,且易于干燥。(4)反应温度、酸的浓度、滴加酸的速度等都会影响化学反应速率。(5)实验过程中,装置内空气中的氧气会将Na2S2O3或Na2SO3氧化为Na2SO4。n(Na2S2O3)=2n(I2)=2ab×10-3mol,样品中硫代硫酸钠晶体(Na2S2O3·5H2O)的纯度为×100%=×100%。