- 521.58 KB
- 2022-04-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
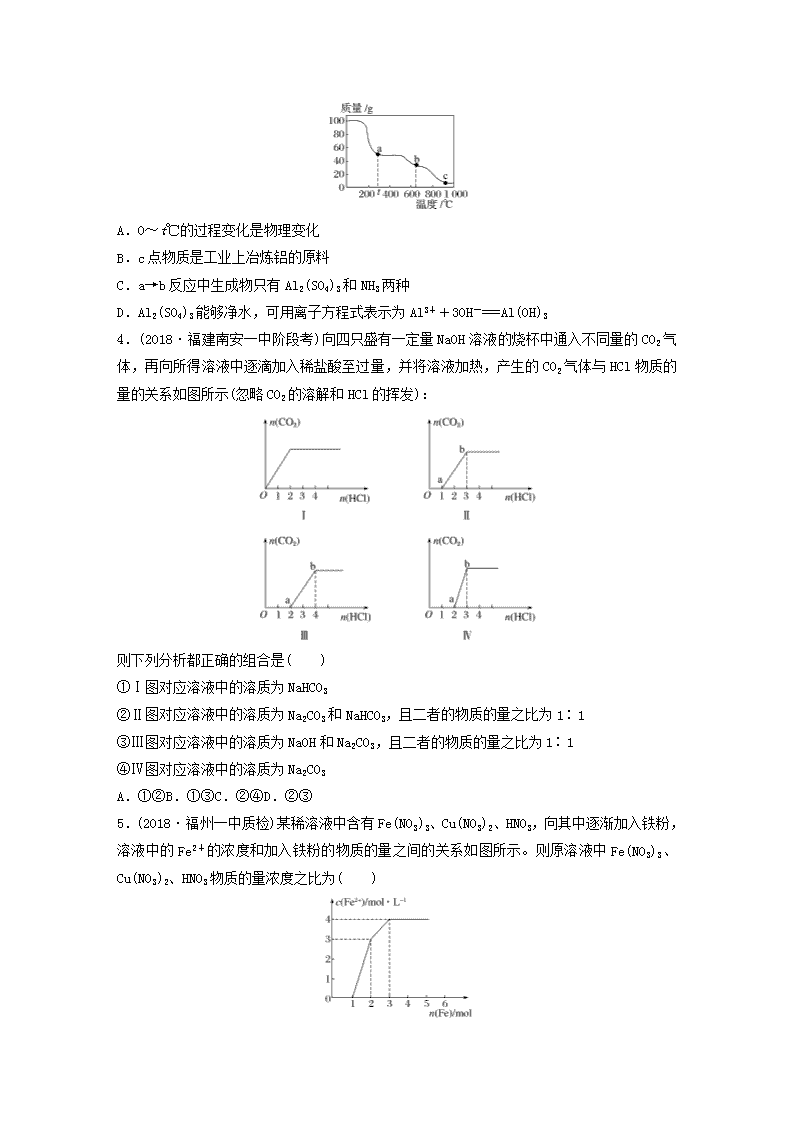
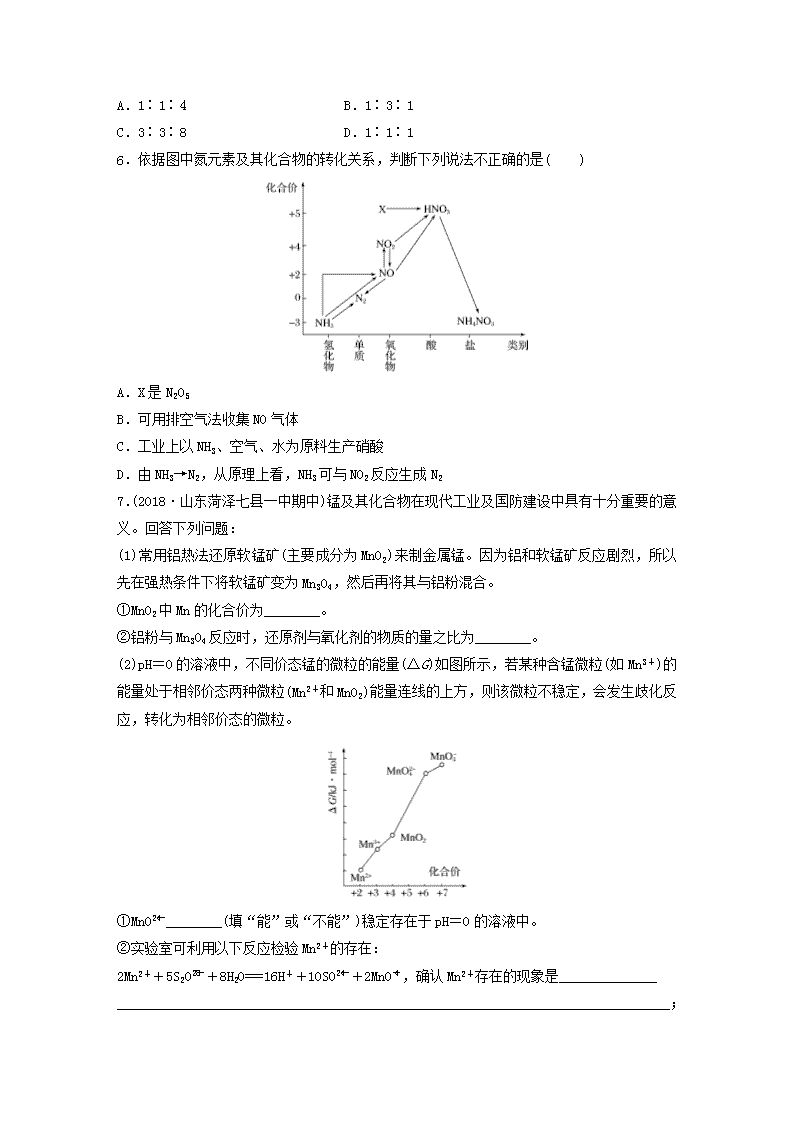
微题型291.(2018·衡阳八中高三上学期月考)下列各项反应对应的图像正确的是( )A.图甲为25℃时,向亚硫酸溶液中通入氯气B.图乙为向NaAlO2溶液中通入HCl气体C.图丙为向少量氯化铁溶液中加入铁粉D.图丁为向BaSO4饱和溶液中加入硫酸钠2.向明矾溶液中逐滴加入Ba(OH)2溶液,生成沉淀的物质的量与消耗Ba(OH)2的物质的量的关系如图所示,下列说法正确的是( )A.O~b上的任意一点a的溶液均呈酸性B.b、c点溶液均呈中性C.b、c两点沉淀的物质的量之比为4∶3D.c点溶液呈碱性,原因是AlO+H++H2O===Al(OH)3↓3.在加热固体NH4Al(SO4)2·12H2O时,固体质量随温度的变化曲线如图所示:已知a点物质为NH4Al(SO4)2,b点物质为Al2(SO4)3,下列判断正确的是( )nA.0~t℃的过程变化是物理变化B.c点物质是工业上冶炼铝的原料C.a→b反应中生成物只有Al2(SO4)3和NH3两种D.Al2(SO4)3能够净水,可用离子方程式表示为Al3++3OH-===Al(OH)34.(2018·福建南安一中阶段考)向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体,再向所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的CO2气体与HCl物质的量的关系如图所示(忽略CO2的溶解和HCl的挥发):则下列分析都正确的组合是( )①Ⅰ图对应溶液中的溶质为NaHCO3②Ⅱ图对应溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比为1∶1③Ⅲ图对应溶液中的溶质为NaOH和Na2CO3,且二者的物质的量之比为1∶1④Ⅳ图对应溶液中的溶质为Na2CO3A.①②B.①③C.②④D.②③5.(2018·福州一中质检)某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中的Fe2+的浓度和加入铁粉的物质的量之间的关系如图所示。则原溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )nA.1∶1∶4B.1∶3∶1C.3∶3∶8D.1∶1∶16.依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是( )A.X是N2O5B.可用排空气法收集NO气体C.工业上以NH3、空气、水为原料生产硝酸D.由NH3→N2,从原理上看,NH3可与NO2反应生成N27.(2018·山东菏泽七县一中期中)锰及其化合物在现代工业及国防建设中具有十分重要的意义。回答下列问题:(1)常用铝热法还原软锰矿(主要成分为MnO2)来制金属锰。因为铝和软锰矿反应剧烈,所以先在强热条件下将软锰矿变为Mn3O4,然后再将其与铝粉混合。①MnO2中Mn的化合价为________。②铝粉与Mn3O4反应时,还原剂与氧化剂的物质的量之比为________。(2)pH=0的溶液中,不同价态锰的微粒的能量(ΔG)如图所示,若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线的上方,则该微粒不稳定,会发生歧化反应,转化为相邻价态的微粒。①MnO________(填“能”或“不能”)稳定存在于pH=0的溶液中。②实验室可利用以下反应检验Mn2+的存在:2Mn2++5S2O+8H2O===16H++10SO+2MnO,确认Mn2+存在的现象是_____________________________________________________________________________________________;n检验时必须控制Mn2+的浓度和用量,否则实验失败。理由是____________________________________________________________________________________________________________。8.(2019·合肥模拟)工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:过量SO2MnO2NH4HCO3溶液软锰矿浆―→―→―→―→―→→…→滤渣Ⅰ滤渣Ⅱ高纯MnCO3(1)浸锰过程中,Fe2O3与SO2反应的化学方程式为Fe2O3+SO2+2H+===2Fe2++SO+H2O,该反应是经历以下两步反应实现的。ⅰ.Fe2O3+6H+===2Fe3++3H2Oⅱ.……写出ⅱ的离子方程式:____________________________________________________________________________________________________________________________________________。(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为______________(填离子符号)。(3)写出氧化过程中MnO2与SO2反应的化学方程式:__________________________________。(4)“浸锰”过程中往往有副产物MnS2O6生成,温度对“浸锰”过程的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是_____________________________________________________________________________________________________________________________________。(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出该反应的离子方程式:_______________________________________________________________________________________________________________________________________________________________。(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_______________________________________________________________________________________________________。n答案精析1.C [亚硫酸为酸性,其pH小于7,与图甲不符,发生反应Cl2+H2SO3+H2O===2Cl-+4H++SO后,随着氯气的通入,pH会降低,直到氯气反应完全,pH不变,A错误;NaAlO2溶液中通入HCl气体,发生反应H++AlO+H2O===Al(OH)3↓、Al(OH)3+3H+===Al3++3H2O,图中上升段与下降段对应的横坐标长度之比应为1∶3,B错误;向少量氯化铁溶液中加入铁粉,发生反应Fe+2FeCl3===3FeCl2,则Fe元素的质量增加,Cl元素的质量不变,所以Cl的质量分数减小,至反应结束不再变化,C正确;BaSO4饱和溶液中,存在溶解平衡,加硫酸钠,硫酸根离子浓度增大,溶解平衡逆向移动,溶解度减小,D错误。]2.A [b点时反应的离子方程式为2Al3++6OH-+3Ba2++3SO===2Al(OH)3↓+3BaSO4↓,此时溶液的溶质是K2SO4,溶液呈中性,KAl(SO4)2溶液由于Al3+水解而显酸性,故O~b之间任意一点溶液都显酸性;b点之后,再加入Ba(OH)2,反应的离子方程式为2Al(OH)3+2OH-+Ba2++SO===2AlO+BaSO4↓+4H2O,c点溶液的溶质为KAlO2,溶液显碱性,故A正确、B错误;假设有1molKAl(SO4)2,b点沉淀的物质的量为2.5mol,c点沉淀的物质的量则为2mol,二者的比为5∶4,故C错误;c点溶液呈碱性的原因是AlO水解,故D错误。]3.B [因为a点物质为NH4Al(SO4)2,则0~t℃的过程变化是失去结晶水生成NH4Al(SO4)2,是化学变化,A项错误;b点物质为硫酸铝,继续加热分解则在c点生成氧化铝,所以c点物质是工业上冶炼铝的原料,B项正确;a→b发生的反应为硫酸铝铵分解生成硫酸铝、氨气和硫酸,C项错误;硫酸铝能够净水,其原理是铝离子水解生成氢氧化铝胶体,氢氧化铝胶体具有吸附性可以吸附水中悬浮的杂质,D项错误。]4.A [图像Ⅰ中从O点即开始产生CO2气体,对应溶液中的溶质为NaHCO3,①正确;图像Ⅱ中Oa段消耗HCl的量小于ab段消耗HCl的量,对应的溶液中的溶质为Na2CO3和NaHCO3,且二者的物质的量之比==,②正确;图像Ⅲ中,Oa段消耗HCl的量等于ab段消耗HCl的量,对应溶液中的溶质为Na2CO3,③不正确;图像Ⅳ中,Oa段消耗HCl的量大于ab段消耗HCl的量,对应溶液中的溶质为Na2CO3、NaOH,且二者的物质的量之比==,④不正确。]5.A [氧化性强弱顺序:HNO3>Fe3+>Cu2+,0~1时发生Fe+4HNO3===Fe(NO3)3+NO↑+2H2O,消耗1molFe的同时消耗4mol硝酸,生成1molFe3+,1~2时发生Fe+2Fe3+===3Fe2+,消耗1molFe的同时消耗2molFe3+,因此原溶液中Fe3+的物质的量为1mol,2~3时发生Fe+Cu2+===Fe2++Cu,消耗1molFe的同时消耗1molCu2+,则原溶液中有1molCu2+,溶液的体积相同,浓度之比等于物质的量之比为1∶1∶4。]6.B [由图可知,X是氧化物,X中N的化合价为+5价,则X是N2O5,A项正确;NO易与空气中的O2反应生成NO2n,故不能用排空气法收集NO,只能用排水法收集,B项错误;工业上生产硝酸时,NH3发生催化氧化反应生成NO,NO被氧化为NO2,再被水吸收生成HNO3,C项正确;NH3中N为-3价,具有还原性,而NO2中N为+4价,具有氧化性,理论上二者可发生氧化还原反应生成N2,D项正确。]7.(1)①+4 ②8∶3(2)①不能 ②溶液由无色变为紫红色 过量的Mn2+能与生成的MnO反应,从而影响实验现象的观察解析 (1)①MnO2中氧为-2价,则Mn的化合价为+4价;②铝粉与Mn3O4反应的化学方程式为3Mn3O4+8Al9Mn+4Al2O3,根据方程式可知,还原剂Al与氧化剂Mn3O4的物质的量之比为8∶3。(2)①根据图像可知,MnO的能量在MnO和MnO2能量连线的上方,则MnO在pH=0的溶液中不能稳定存在;②含MnO的溶液呈紫红色,确认Mn2+存在的现象是溶液由无色变为紫红色。8.(1)2Fe3++SO2+2H2O===2Fe2++SO+4H+(2)Mn2+、Fe2+(3)MnO2+SO2===MnSO4(4)90℃ 防止NH4HCO3受热分解,提高原料利用率(5)Mn2++2HCO===MnCO3↓+CO2↑+H2O(6)取1~2mL最后一次洗涤液于试管中,滴加盐酸酸化的BaCl2溶液,若无白色沉淀产生,则洗涤完全;反之,则未洗涤完全