- 618.11 KB
- 2022-04-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
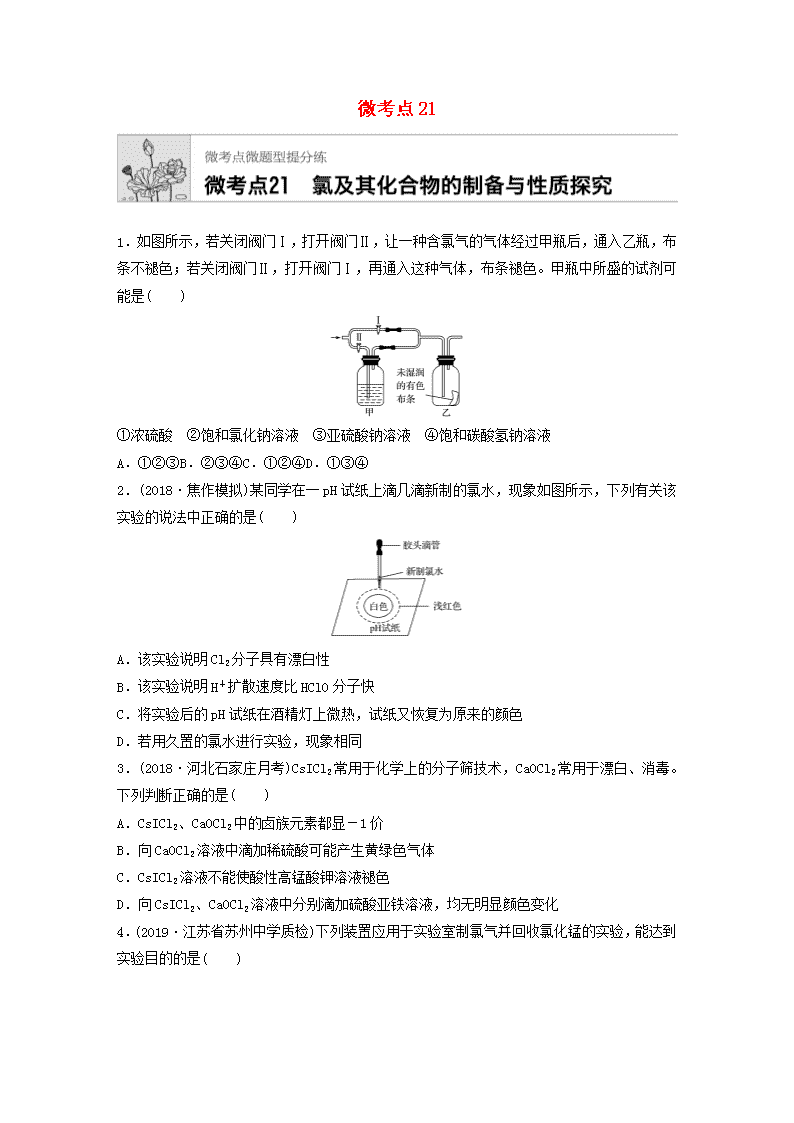
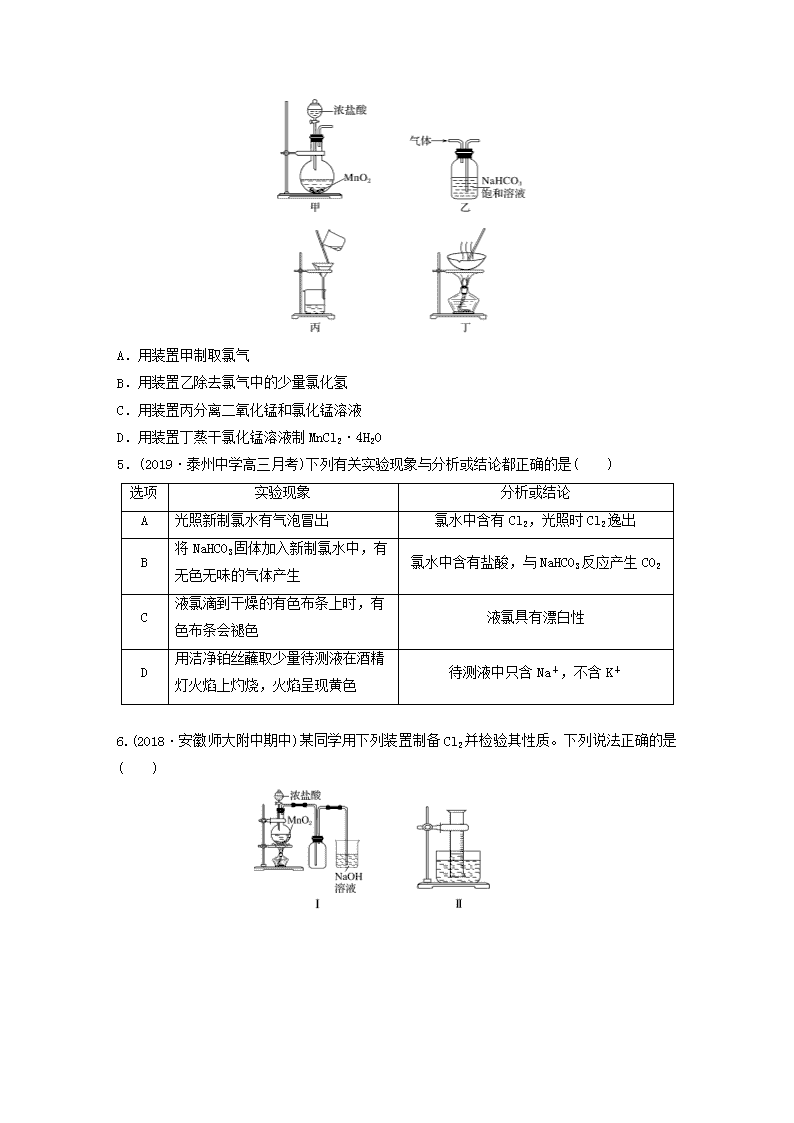
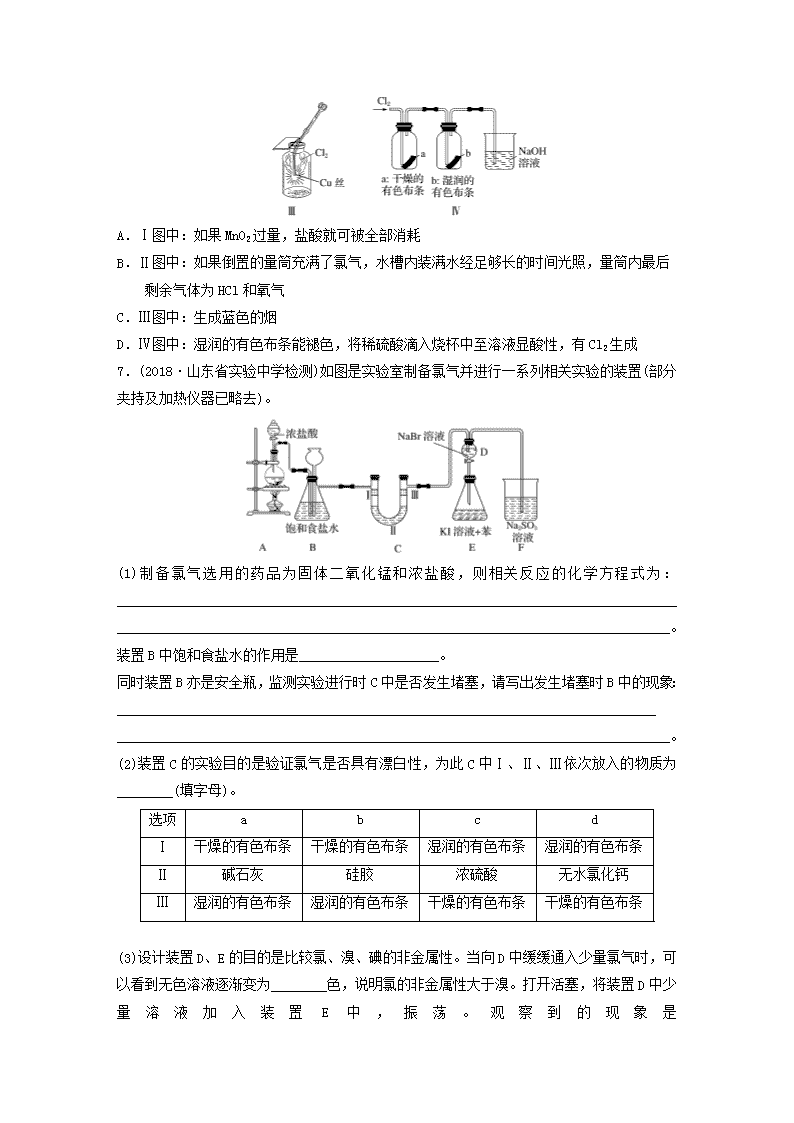
微考点211.如图所示,若关闭阀门Ⅰ,打开阀门Ⅱ,让一种含氯气的气体经过甲瓶后,通入乙瓶,布条不褪色;若关闭阀门Ⅱ,打开阀门Ⅰ,再通入这种气体,布条褪色。甲瓶中所盛的试剂可能是( )①浓硫酸 ②饱和氯化钠溶液 ③亚硫酸钠溶液 ④饱和碳酸氢钠溶液A.①②③B.②③④C.①②④D.①③④2.(2018·焦作模拟)某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是( )A.该实验说明Cl2分子具有漂白性B.该实验说明H+扩散速度比HClO分子快C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色D.若用久置的氯水进行实验,现象相同3.(2018·河北石家庄月考)CsICl2常用于化学上的分子筛技术,CaOCl2常用于漂白、消毒。下列判断正确的是( )A.CsICl2、CaOCl2中的卤族元素都显-1价B.向CaOCl2溶液中滴加稀硫酸可能产生黄绿色气体C.CsICl2溶液不能使酸性高锰酸钾溶液褪色D.向CsICl2、CaOCl2溶液中分别滴加硫酸亚铁溶液,均无明显颜色变化4.(2019·江苏省苏州中学质检)下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )nA.用装置甲制取氯气B.用装置乙除去氯气中的少量氯化氢C.用装置丙分离二氧化锰和氯化锰溶液D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O5.(2019·泰州中学高三月考)下列有关实验现象与分析或结论都正确的是( )选项实验现象分析或结论A光照新制氯水有气泡冒出氯水中含有Cl2,光照时Cl2逸出B将NaHCO3固体加入新制氯水中,有无色无味的气体产生氯水中含有盐酸,与NaHCO3反应产生CO2C液氯滴到干燥的有色布条上时,有色布条会褪色液氯具有漂白性D用洁净铂丝蘸取少量待测液在酒精灯火焰上灼烧,火焰呈现黄色待测液中只含Na+,不含K+6.(2018·安徽师大附中期中)某同学用下列装置制备Cl2并检验其性质。下列说法正确的是( )nA.Ⅰ图中:如果MnO2过量,盐酸就可被全部消耗B.Ⅱ图中:如果倒置的量筒充满了氯气,水槽内装满水经足够长的时间光照,量筒内最后剩余气体为HCl和氧气C.Ⅲ图中:生成蓝色的烟D.Ⅳ图中:湿润的有色布条能褪色,将稀硫酸滴入烧杯中至溶液显酸性,有Cl2生成7.(2018·山东省实验中学检测)如图是实验室制备氯气并进行一系列相关实验的装置(部分夹持及加热仪器已略去)。(1)制备氯气选用的药品为固体二氧化锰和浓盐酸,则相关反应的化学方程式为:_______________________________________________________________________________________________________________________________________________________________。装置B中饱和食盐水的作用是____________________。同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:____________________________________________________________________________________________________________________________________________________________。(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入的物质为________(填字母)。选项abcdⅠ干燥的有色布条干燥的有色布条湿润的有色布条湿润的有色布条Ⅱ碱石灰硅胶浓硫酸无水氯化钙Ⅲ湿润的有色布条湿润的有色布条干燥的有色布条干燥的有色布条n(3)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为________色,说明氯的非金属性大于溴。打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_________________________________________。(4)装置F中用足量的Na2SO3溶液吸收多余氯气,试写出相应反应的离子方程式:_________________________________________________________________________________________。8.二氯化二硫(S2Cl2)在工业上用于橡胶的硫化。为在实验室合成S2Cl2,某化学研究性学习小组查阅了有关资料,得到信息:①将干燥的氯气在110~140℃与硫反应,即可得S2Cl2粗品。②有关物质的部分性质如下表:物质熔点/℃沸点/℃化学性质S112.8444.6略S2Cl2-77137遇水生成HCl、SO2、S;300℃以上完全分解:S2Cl2+Cl22SCl2设计实验装置图如下:(1)上图中气体发生和尾气处理装置不够完善,请你提出改进意见_______________________________________________________________________________________________________,利用改进后的正确装置进行实验,请回答下列问题:(2)B中反应的离子方程式为_______________________________________________________________________________________________________________________________________;E中反应的化学方程式为_________________________________________________________。(3)C、D中的试剂分别是____________、_________。(4)仪器A、B的名称是________、________,F的作用是______________。(5)如果在加热E时温度过高,对实验结果的影响是____________,在F中可能出现的现象是_______________________________________________________________________________。(6)S2Cl2粗品中可能混有的杂质是________、________(填两种),为了提高S2Cl2的纯度,关键的操作是控制好温度和_________________________________________________________。(7)装置H中盛有NaOH溶液,其作用是______________________________________________,发生反应的化学方程式为_________________________________________________________________________________________________________________________________________。n9.(2018·甘肃张掖一诊)某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下。①制备反应原理:C2H5OH+4Cl2―→CCl3CHO+5HCl可能发生的副反应:C2H5OH+HCl―→C2H5Cl+H2OCCl3CHO+HClO―→CCl3COOH(三氯乙酸)+HCl②相关物质的相对分子质量及部分物理性质如表所示:C2H5OHCCl3CHOCCl3COOHC2H5Cl相对分子质量46147.5163.564.5熔点/℃-114.1-57.558-138.7沸点/℃78.397.819812.3溶解性与水互溶可溶于水、乙醇可溶于水、乙醇、三氯乙醛微溶于水,可溶于乙醇(1)仪器A中发生反应的化学方程式为_______________________________________________________________________________。(2)装置B中的试剂是________,若撤去装置B,可能导致装置D中副产物_______(填化学式)的量增加;装置D可采用________加热的方法控制反应温度在70℃左右。(3)装置D中球形冷凝管的作用为__________________________________________________。写出E中所有可能发生的无机反应的离子方程式:_______________________________________________________________________________。(4)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol·L-1碘标准溶液22.00mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为________。(计算结果保留三位有效数字)滴定的反应原理:CCl3CHO+OH-===CHCl3+HCOO-;HCOO-+I2===H++2I-+CO2↑;I2+2S2O===2I-+S4O。n答案精析1.D [Cl2与H2O反应生成的HClO具有漂白作用。气体通过甲瓶后不能使有色布条褪色,可能有两个原因:一是甲瓶中溶液将Cl2干燥,二是甲瓶中溶液能吸收Cl2。浓H2SO4吸水,Na2SO3溶液、饱和NaHCO3溶液都能与Cl2发生反应。]2.B [HClO具有漂白性,Cl2无漂白性,A项错误;HClO漂白持久、稳定,实验后的pH试纸加热不会恢复原来的颜色,C项错误;久置的氯水主要成分为稀盐酸,无漂白性,D项错误。]3.B 4.C5.B [光照新制氯水有气泡冒出是因为次氯酸分解产生了氧气,A项错误;将NaHCO3固体加入新制氯水中,有无色无味的气体产生,这是由于氯水中含有盐酸,与NaHCO3反应可产生CO2,B项正确;氯气没有漂白性,液氯滴到干燥的有色布条上时,有色布条不会褪色,C项错误;观察K元素的焰色反应,需要通过蓝色钴玻璃,D项错误。]6.D [二氧化锰只能与浓盐酸反应,与稀盐酸不反应,所以如果MnO2过量,盐酸不能被全部消耗,A项错误;氯化氢极易溶于水,不可能剩余,B项错误;铜与氯气燃烧生成氯化铜,会产生棕黄色烟,C项错误;Ⅳ图中:湿润的有色布条能褪色,是因为氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,使有色布条褪色,剩余氯气通入盛有氢氧化钠溶液的烧杯中发生反应:Cl2+2NaOH===NaCl+NaClO+H2O,将稀硫酸滴入烧杯中,至溶液显酸性,氯化钠和次氯酸钠会发生氧化还原反应,离子方程式为Cl-+ClO-+2H+===Cl2↑+H2O,所以有Cl2生成,D项正确。]7.(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O 除去Cl2中的HCl B中长颈漏斗中液面上升,形成水柱(2)d(3)橙黄 E中溶液分为两层,上层(苯层)为紫红色(4)SO+Cl2+H2O===SO+2Cl-+2H+解析 (1)为了防止Cl2的溶解可用饱和NaCl溶液除去Cl2中的HCl。若发生堵塞,气压增大,漏斗内液面上升。(2)从B中出来的Cl2不干燥,故Ⅱ应为干燥剂,Ⅲ应为干燥的有色布条。(3)根据非金属单质的氧化性可确定非金属性强弱。(4)SO具有还原性,能吸收Cl2。8.(1)用导管将A的上口和B相连(或将A换成恒压滴液漏斗),在G和H之间增加干燥装置 (2)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O 2S+Cl2S2Cl2 (3)饱和食盐水 浓硫酸 (4)分液漏斗 蒸馏烧瓶 导气、冷凝 (5)产率降低(或S2Cl2分解) 有固体产生(或其他正确描述) (6)SCl2n S(答案合理即可) 控制浓盐酸的滴速不要过快 (7)吸收多余的氯气,保护环境 Cl2+2NaOH===NaClO+NaCl+H2O解析 (1)Cl2的发生装置必须考虑浓盐酸的顺利流下,尾气的处理必须考虑S2Cl2的水解。(2)B中发生的是Cl2的制备反应;E中发生的是干燥Cl2与S生成S2Cl2的反应:2S+Cl2S2Cl2。(3)生成的Cl2需除杂和干燥,所用试剂为饱和食盐水与浓硫酸。(4)从E中出来的S2Cl2气体被冷凝,并导入G中。(5)S2Cl2在300℃以上完全分解,所以温度过高使产量降低,并导致分解产生的硫凝华,积存于F中。(6)根据信息,温度控制不当,则会生成SCl2,还有未反应的氯气以及蒸发出的硫。(7)由于Cl2有毒且它是酸性气体,尾气需要用碱液吸收。9.(1)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O(2)饱和食盐水 C2H5Cl 水浴(3)冷凝回流,导气 Cl2+2OH-===Cl-+ClO-+H2O、H++OH-===H2O(4)73.8%解析 由题给反应原理和装置图可知,A是制取氯气的装置,B、C是干燥除杂装置,D是制备三氯乙醛的装置,E是尾气吸收装置。(1)二氧化锰与浓盐酸反应制取氯气的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。(2)装置B的作用是除去Cl2中的HCl气体,故B中应盛放饱和食盐水。结合题给反应,C2H5OH和HCl反应生成C2H5Cl,故若撤去装置B,则副产物C2H5Cl的量增加,可以采用水浴加热的方法控制反应温度在70℃左右。(3)球形冷凝管起冷凝回流和导气的作用。装置E的作用是吸收过量的Cl2和HCl,发生无机反应的离子方程式为Cl2+2OH-===Cl-+ClO-+H2O、H++OH-===H2O。(4)反应消耗的n(S2O)=0.02000mol·L-1×20.00×10-3L=4.0×10-4mol,根据I2+2S2O===2I-+S4O知,4.0×10-4molS2O消耗的n(I2)==2.0×10-4mol,则参加反应HCOO-+I2===H++2I-+CO2↑的I2的物质的量为22.00×10-3L×0.1000mol·L-1-2.0×10-4mol=2.0×10-3mol,根据滴定反应原理知,存在关系式:CCl3CHO~HCOO-~I2,故参加反应的CCl3CHO的物质的量为2.0×10-3mol,样品中m(CCl3CHO)=2.0×10-3mol×147.5g·mol-1=0.295g,故产品纯度为×100%≈73.8%。