- 374.72 KB
- 2022-04-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
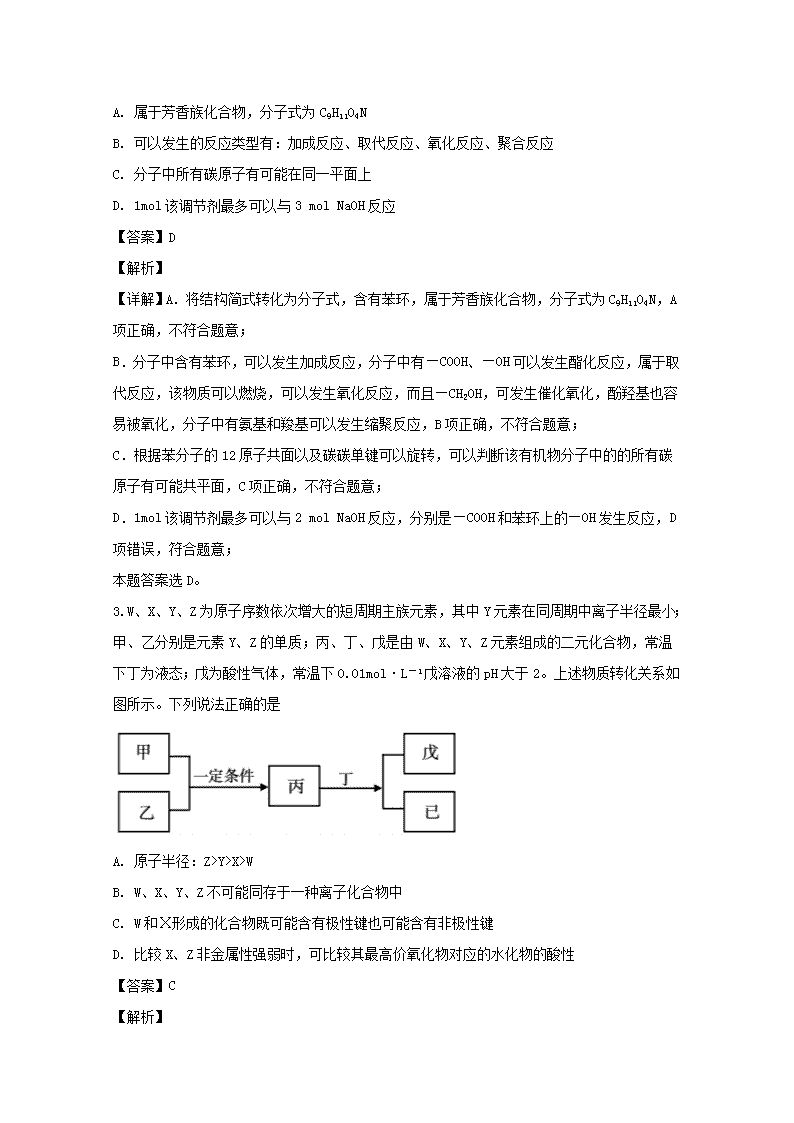
蚌埠市2019届高三年级第二次教学质量检查考试理科综合(化学部分)可能用到的相对原子质量:H-1Li-7C-12N-14O-16一、选择题:本题共13小题,每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。1.化学与生活、社会发展息息相关,下列有关说法不正确的是A.将海水中的镁转化为氯化镁,再电解熔融氯化镁可制得金属镁B.稻草秸秆和甘蔗渣中富含纤维素,可以用它来制造纸张C.芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程涉及到化学变化D.《新修本草》中有关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如瑙璃……烧之赤色……”这里的赤色是析出了Cu单质【答案】D【解析】【详解】A.海水中含有Mg元素,经沉淀富集、溶解、结晶、脱水后转化为无水MgCl2,电解熔融的MgCl2可得到镁单质,A项正确,不符合题意;B.纸张主要成分为纤维素,稻草秸秆和甘蔗渣含有纤维素,可用于造纸。B项正确,不符合题意;C.光敏树脂遇光会改变其化学结构。它是由高分子组成的胶状物质。在紫外线照射下,这些分子结合成长长的交联聚合物高分子,属于化学变化,C项正确,不符合题意;D.“本来绿色,新出窟未见风者,正如瑙璃……烧之赤色……”,由以上信息可以推测,青矾可能为FeSO4·7H2O,青矾在空气中灼烧后发生分解、氧化,可以生成红棕色的氧化铁,D项错误;本题答案选D。2.一种免疫调节剂,其结构简式如图所示,关于该物质的说法不正确的是nA.属于芳香族化合物,分子式为C9H11O4NB.可以发生的反应类型有:加成反应、取代反应、氧化反应、聚合反应C.分子中所有碳原子有可能在同一平面上D.1mol该调节剂最多可以与3molNaOH反应【答案】D【解析】【详解】A.将结构简式转化为分子式,含有苯环,属于芳香族化合物,分子式为C9H11O4N,A项正确,不符合题意;B.分子中含有苯环,可以发生加成反应,分子中有—COOH、—OH可以发生酯化反应,属于取代反应,该物质可以燃烧,可以发生氧化反应,而且—CH2OH,可发生催化氧化,酚羟基也容易被氧化,分子中有氨基和羧基可以发生缩聚反应,B项正确,不符合题意;C.根据苯分子的12原子共面以及碳碳单键可以旋转,可以判断该有机物分子中的的所有碳原子有可能共平面,C项正确,不符合题意;D.1mol该调节剂最多可以与2molNaOH反应,分别是—COOH和苯环上的—OH发生反应,D项错误,符合题意;本题答案选D。3.W、X、Y、Z为原子序数依次增大的短周期主族元素,其中Y元素在同周期中离子半径最小;甲、乙分别是元素Y、Z的单质;丙、丁、戊是由W、X、Y、Z元素组成的二元化合物,常温下丁为液态;戊为酸性气体,常温下0.01mol·L-1戊溶液的pH大于2。上述物质转化关系如图所示。下列说法正确的是A.原子半径:Z>Y>X>WB.W、X、Y、Z不可能同存于一种离子化合物中C.W和Ⅹ形成的化合物既可能含有极性键也可能含有非极性键D.比较X、Z非金属性强弱时,可比较其最高价氧化物对应的水化物的酸性【答案】C【解析】n【详解】Y元素在同周期中离子半径最小,金属离子外的电子层数比相应的原子少一层,而且同周期金属元素离子半径随着原子序数的递增而减小,而非金属元素的离子的电子层没有减少,所以Y应为Al元素。丁为二元化合物,而且为液态,为水。丙与水反应得到两种物质,而且一种为酸。0.01mol·L-1戊溶液的pH大于2,为弱酸。短周期中二元化合物为弱酸的HF和H2S。结合乙是Z的单质,Z的原子序数比Al大,Z为S元素。涉及的反应为2Al+3SAl2S3,Al2S3+6H2O=2Al(OH)3+3H2S↑。W、X、Y、Z分别为H、O、Al、S。A.H原子半径最小。同周期的元素,原子序数越大,原子半径越小,Al原子的半径大于S;同主族元素,原子序数越大,原子半径越大,S的原子半径大于O,排序为Y(Al)>Z(S)>X(O)>W(H),A项错误;B.H、O、Al、S可以存在于KAl(SO4)2·12H2O中,存在离子键,为离子化合物,B项错误;C.W(H)和X(O)的化合物可能为H2O和H2O2。H2O的结构简式为H—O—H,含有极性键。H2O2的结构简式为H—O-O—H,含有极性键和非极性键,C项正确;D.比较X(O)和Z(S)的非金属性,不能比较最高价氧化物对应的水化物的酸性,因为O没有它的含氧酸。D项错误;本题答案选C。4.设NA为阿伏加德罗常数的值,下列说法正确的是A.常温常压下,22.4L的37Cl2中所含的中子数为20NAB.标准状况下,8.0g甲烷所含C一H键数目为2.0NAC.若将1mol氯化铁完全转化为氢氧化铁胶体,则分散系中胶体微粒数为NAD.一定条件下,0.1molN2与足量H2充分反应,生成NH3分子数为0.2NA【答案】B【解析】【详解】A.常温常压并不是标准状况,标准状况为0℃、101kPa,所以22.4LCl2并不是1mol,无法计算其所含的中子数,A项错误;B.1mol甲烷中含有4molC—H键,8gCH4为0.5mol,则C—H键为2mol,数目为2NA,B项正确;C.1molFeCl3中含有1molFe3+,最多水解生成1mol氢氧化铁。氢氧化铁胶体中的1个胶体粒子是由很多个Fe(OH)3组合而成的,因此分散系中的胶体微粒小于NA,C项错误;D.N2+3H22NH3为可逆反应,0.1molN2与足量H2充分反应,N2不能转化为0.2mol的NH3n,D项错误;本题答案选B。5.在25mL0.1mol·L-1某一元碱中,逐滴加入0.1mol·L-1醋酸,滴定曲线如图所示。则下列说法不正确的是A.该碱溶液可以溶解Al(OH)3B.a点对应的体积值大于25mLC.C点时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-)D.D点时,c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)【答案】D【解析】【详解】从滴定曲线可知,没有滴加醋酸前,0.1mol·L-1某一元碱其溶液的pH为13,c(OH-)=0.1mol/L,完全电离,该一元碱为强碱。A.该一元碱为强碱,可以溶解Al(OH)3,A项正确,不符合题意;B.根据曲线,a点的pH值为7,为中性,假设加入醋酸的体积为25mL,酸和碱恰好完全反应,生成醋酸盐,为强碱弱酸盐,水解为碱性,现在为中性,说明要多加点酸,B项正确,不符合题意;C.C点pH<7,溶液呈现酸性,c(H+)>c(OH-),根据电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+),可以知道c(CH3COO-)>c(Na+),C项正确,不符合题意;D.D点,加入了50mL的醋酸,为CH3COONa和CH3COOH的混合溶液,根据电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+),以及物料守恒,c(CH3COOH)+c(CH3COO-)=2c(Na+),联合两式,得c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH),D项错误,符合题意;本题答案选D。6.大阳能路灯蓄电池是磷酸铁锂电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+n通过,电池反应式为LixC6+Li1-xFePO4LiFePO4+6C。下列说法正确的是A.放电时Li+从左边移向右边,PO43-从右边移向左边B.放电时,正极反应式为:Li1-xFePO4+xLi++xe-=LiFePO4C.充电时M极连接电源的负极,电极反应为6C+xe-=C6x-D.充电时电路中通过2.0mol电子,产生7.0gLi【答案】B【解析】【详解】A.M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),含有Li单质。M电极为负极,放电时,阳离子向正极移动,Li+从左向右移动,隔膜只允许Li+通过,PO43-不能通过,A项错误;B.放电时,正极得到电子,Li1-xFePO4变成LiFePO4,根据电子守恒,Li1-xFePO4+xLi++xe-=LiFePO4,B项正确;C.放电时,M为负极,充电时M为阴极,连接电源的负极,生成LixC6,电极反应为6C+xLi++xe-=LixC6,C项错误;D.C是锂的载体,根据6C+xLi++xe-=LixC6,转移xmole-得到xmolLi,则转移2mole-,生成2molLi单质,为14g,D项错误;本题答案选B。7.下列实验中,对应的操作、现象及实验原理或结论均正确的是nA.AB.BC.CD.D【答案】A【解析】【详解】A.NaCl和AgNO3反应时,NaCl是过量的,溶液中没有大量的Ag+,向此混合物中加入2滴碘化钠溶液,AgCl沉淀转化为AgI沉淀,由于所加碘离子的浓度小于原混合物中的氯离子浓度,故可以证明AgI的Ksp小于AgCl的Ksp大小,A项正确;B.NaClO溶液具有漂白性,不能在pH试纸上正确对比出颜色,B项错误;C.KNO3的溶解度随着温度升高变化较大,NaCl的溶解度随着温度的升高,变化不明显,现要提纯NaCl,只能蒸发溶剂使NaCl结晶析出,趁热过滤除去KNO3,则应蒸发结晶,趁热过滤,洗涤、干燥,C项错误;D.向某溶液中加入盐酸,产生气泡,而且该气泡可以使澄清石灰水变浑浊,该气体可能是二氧化碳,也可能是二氧化硫,原溶液中可能含有CO32-、HCO3-、HSO32-、SO32-等,D项错误;本题答案选A。三、非选择题(一)必考题:共129分。8.硫氰酸盐在化学工业中有广泛的应用。如NH4SCN在有机工业用于聚合反应的催化剂,医药工业用于抗生素生产,印染工业用作印染扩散剂等。Co(SCN)2可以用来检验可卡因的存在。n(1)Co(SCN)2可以用CoSO4(aq)+Ba(SCN)2(aq)=BaSO4(s)+Co(SCN)2(aq)来制备,也可用CoCO3与足量HSCN制备,请写出反应方程式___________。(2)某小组为探究NH4SCN的热分解产物,按如图所示装置进行实验。①图中盛放NH4SCN的装置名称是___________,通入氮气的作用___________。②反应一段时间后,发现B瓶中溶液分层,分液后取下层液体,该液体可将硫磺溶解,由此判断分解产物中有___________。③D瓶中的石蕊溶液由紫色变为蓝色,证明分解产物生成___________,C瓶装置的作用___________。④反应完成后,取一定量B瓶上层溶液用盐酸酸化,然后滴入到0.1mol·L-1CuSO4溶液中,立即析出黑色沉淀,请写该反应的离子方程式___________。⑤某同学指出该实验装置存在不足,请写出改进措施___________。【答案】(1).2HSCN+CoCO3=Co(SCN)2+H2O+CO2↑(2).硬质玻璃管(3).防止空气(或氧)干扰实验结果(4).二硫化碳(5).氨气(6).防石蕊溶液倒吸(7).Cu2++H2S=CuS↓+2H+(8).在D装置后面添加尾气吸收装置【解析】【详解】(1)CoCO3和HSCN的反应,类似于CaCO3和HCl的反应,复分解反应,答案为2HSCN+CoCO3=Co(SCN)2+H2O+CO2↑;(2)①,图中的装置为硬质玻璃管。该小组要探究NH4SCN的热分解产物,那么要防止物质与氧气反应,通入N2,排除装置中的氧气,防止其干扰试验,答案为硬质玻璃管防止空气(或氧)干扰实验结果;②根据S难溶于水、微溶于酒精、易溶于CS2,而下层液体可以溶解硫磺,可以知道产物中有CS2,答案为CS2;③D瓶中的石蕊溶液由紫色变为蓝色,通入了碱性气体,高中阶段的碱性气体只有氨气。氨气n极易溶于水,C装置为了防止D中的石蕊溶液进入C中,答案为氨气防石蕊溶液倒吸;④滴加硫酸铜溶液,产生黑色沉淀,根据原子守恒,为CuS。用盐酸酸化后,溶液中S2-存在形式为H2S,答案为Cu2++H2S=CuS↓+2H+;⑤根据前面的过程知道,分解产物中有氨气生成,需要进行尾气处理,答案为在D装置后面添加尾气吸收装置。9.1871年门捷列夫最早预言了类硅元素锗,1886年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。下图为工业上利用锗锌矿(主要成分GeO2和ZnS)来制备高纯度锗的流程。已知:1.丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀;2.GeCl4易水解,在浓盐酸中溶解度低。(1)简述步骤①中提高酸浸效率的措施___________(写两种)。(2)步骤②操作A方法是___________。(3)步骤③中的物质在___________(填仪器名称)中加热。(4)步骤④不能用稀盐酸,原因可能是___________。(5)写出步骤⑤的化学方程式___________。写出步骤⑦的化学方程式___________。(6)请写出一种证明步骤⑦反应完全的操作方法___________。【答案】(1).把矿石粉碎;加热;充分搅拌(2).过滤(3).坩埚(4).防止四价锗水解;防止GeO2不能充分反应;有利于GeCl4析出(5).GeCl4+(2+n)H2O=GeO2·nH2O+4HCl(6).GeO2+2H2Ge+2H2O(7).将反应生成的气体通入装有无水硫酸铜的U形管,无现象(其他合理组合亦可)【解析】【分析】锗锌矿在酸浸取下生成四价锗,再被有机沉淀剂沉淀,。沉淀经灼烧得到GeO2,再与浓盐酸反n应得到GeCl4,其发生水解,得到GeO2·nH2O,脱水得到GeO2。从得到粗品的GeO2再得到高纯度的GeO2的整个过程,是为了提高GeO2的纯度,最后得到高纯度的Ge。【详解】(1)提高酸浸速率,即提高化学反应速率,可以通过粉碎矿石增大矿石与酸的接触面积、适当的提高温度,搅拌等等,答案为把矿石粉碎;加热;充分搅拌;(2)根据流程图,经过操作A之后,得到了沉淀和滤液,所以操作A为过滤,答案为过滤;(3)步骤③为焙烧,固体加热需要用到坩埚,答案为坩埚;(4)根据已知GeCl4易水解,而且在浓盐酸中溶解度低,能沉淀,易分离。如果用稀盐酸,GeCl4会水解,而且在稀盐酸中的溶解度较大不利于析出,而且要确保GeO2完全反应成GeCl4。答案为防止四价锗水解;防止GeO2不能充分反应;有利于GeCl4析出;(5)步骤⑤,GeCl4和纯水反应生成GeO2·nH2O,为水解反应。步骤⑦,GeO2为H2还原得到Ge。答案为GeCl4+(2+n)H2O=GeO2·nH2O+4HClGeO2+2H2Ge+2H2O;(6)步骤⑦反应完全从Ge或者GeO2不易看出现象,可以从成物水分析,可以通过检验气体中是否含水来验证是否反应完,通常用无水硫酸铜检验水蒸气的存在。答案为将反应生成的气体通入装有无水硫酸铜的U形管,无现象(其他合理组合亦可);10.节能减排措施是我国“十一五”期间提出的政策措施。(1)煤的燃烧,会产生大量有害气体。将煤转化为水煤气,可有效降低排放。C(s)+O2(g)=CO2(g)△H=-393.5kJ·mol-1H2(g)+O2(g)=H2O(g)△H=-242.0kJ·mol-1CO(g)+O2(g)=CO2(g)△H=-283.0kJ·mol-1根据以上数据,写出C(s)与水蒸气反应生成CO和H2的热化学方程式___________。(2)汽车尾气的排放是大气污染物的重要来源,其中含有NO气体。根据资料显示用活性炭还原法可以处理氮氧化物,某硏究小组向固定容积的密闭容器中加入一定量的活性炭和NO发生反应C(s)+2NO(g)CO2(g)+N2(g)△H=-574kJ·mol-1,并在温度T时将所测反应数据制成下表:n①0到10min内,NO的平均反应速率v(NO)=___________mol·L-1·min-1。②下列数据不再变化可表示该反应达到平衡的是___________。a.容器内压强b.混合气体的平均摩尔质量c.混合气体的密度③若容器改为可变容积容器,达平衡后改变某一条件,一段时间后,反应再次达到原平衡,请写出可能改变的条件是___________(任写一种)。(3)在某温度T时能同时发生反应:2N2O5(g)2N2O4(g)+O2(g)K1N2O4(g)2NO2(g)K2若向一体积固定为2L的密闭容器内加入N2O52mol,一段时间后,容器内的反应达到平衡,此时n(NO2)=0.4mol,已知K2=0.1,请计算出K1=___________。(4)一定条件下,将汽车尾气通入到氢氧化钠溶液,尾气中氮的氧化物可以转化为亚硝酸钠,工业上可以用亚硝酸钠来制备亚硝酸。已知,25℃时亚硝酸(HNO2)、亚硫酸(H2SO3)的电离平衡常数分别如下:Ka1Ka2亚硝酸(HNO2)7.1×10-4亚硫酸(H2SO3)1.54×10-21.02×10-7请回答下列问题①常温下,将0.1mol·L-1的亚硝酸稀释100倍,c(H+)将___________(填“不变”、增大”、“减小”);Ka值将(填“不变”、“增大”、“减小”)___________。②下列离子方程式能发生的是___________(填字母)。a.NO2-+SO2+H2O=HNO2+HSO3-b.2HNO2+SO32-=2NO2-+SO2↑+H2Oc.2NO2-+SO2+H2O=2HNO2+SO32-d.HNO2+SO32-=NO2-+HSO3-【答案】(1).C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ·mol-1(2).0.048(3).bc(4).加圧或减压或增加NO浓度等(5).0.16(6).减小(7).不变(8).ad【解析】n【分析】(1)利用盖斯定律求反应热;(2)①反应速率的求解,利用公式;②平衡状态的标准,抓住变化的量不变,即可表示平衡;③气体体积不变的反应的等效平衡;(3)三等式求平衡常数;【详解】(1)C(s)与H2O(g)的反应方程式为C(s)+H2O(g)=CO(g)+H2(g),该反应等于反应①-②-③,△H=△H1-△H2-△H3=-393.5-(-242.0)-(-283.0)kJ·mol-1=+131.5kJ·mol-1;答案为C(s)+H2O(g)=CO(g)+H2(g)△H=+131.5kJ·mol-1;(2)①0到10min内,NO的浓度从1mol·L-1降低到了0.52mol·L-1,降低了0.48mol·L-1,,答案为0.048;②容器内发生的反应为C(s)+2NO(g)CO2(g)+N2(g),a.C是固体,反应前后气体的物质的量不变。在相同条件下,物质的量之比等于压强之比,气体的物质的量不变,则压强一直都没有变,因此a不能说明反应已经达到平衡;b.,由于C是固体,气体的总质量发生变化,所以平均摩尔质量发生变化,当它不变的时候,说明平衡,b符合要求;c.,由于C是固体,气体的总质量发生变化,所以密度发生变化,当它不变的时候,说明平衡,c符合要求。答案为bc;③若容器变为容积可变的容器,但是反应前后气体的物质的量不变,压强的改变不会影响平衡的移动,所以可以改变压强,压缩体积或者扩大体积;另外C是固体,增大反应物NO的浓度,平衡正向移动,达平衡后与原平衡等效,平衡不移动,答案:加圧或减压或增加NO浓度等;(3)体积为2L,n(NO2)=0.4mol,c(NO2)=0.2mol·L-1。已知K2=0.1,,则c(N2O4)=0.4mol·L-1,n(N2O4)=0.8mol。为了生成NO20.4mol,需要消耗N2O4为0.2mol,加上剩余的N2O4,则N2O5分解一共生成了1molN2O4,生成N2O5和O2的比例为2:1,则生成的氧气为0.5mol。2N2O5(g)2N2O4(g)+O2(g)开始的物质的量200n转化的物质的量110.5平衡的物质的量10.80.5体积为2L,答案为0.16;(4)①加水稀释,虽然能促进电离,但是离子浓度还是比原来的小,稀释后,温度没有发生改变,电离平衡常数不变,答案为减小不变;②通过亚硝酸和亚硫酸的电离平衡常数的对比,HNO2、H2SO3、HSO3-的酸性排序为H2SO3>HNO2>HSO3-;反应为强酸制弱酸。a.SO2和H2O反应生成H2SO3,与NO2-反应,生成HNO2和HSO3-,HNO2的酸性比HSO3-的强,a正确;b.HNO2的酸性比H2SO3的弱,不能弱酸制取强酸,b错误;c.产物中HNO2会与SO32-反应生成HSO3-,c项错误,d正确;答案选ad。【点睛】(2)②在判断是否达到平衡的时候,一般情况下一个变化的物理量,不变的时候就达到了平衡。此外要注意C是固体,会引起气体体积的变化。(二)选考题:11.第四期某些过渡元素在工业生产中有着极其重要的作用。(1)铬是最硬的金属单质,被称为“不锈钢的添加剂”。写出Cr在周期表中的位置___________;其原子核外电子排布的最高能层符号___________.(2)在1molCrO5(其中Cr为+6价)中,含有过氧键的数目为___________。(3)钒(23V)是我国的丰产元素,被称之为“工业的味精”,广泛用于催化及钢铁工业。回答下列问题:写出钒原子价电子排布图___________;V2O5常用作SO2转化为SO3的催化剂。SO3的三聚体环状结构如图所示,该结构中S原子的杂化轨道类型为___________;(4)Ni是一种优良的有机反应催化剂,Ni能与CO形成正四面体形的配合物Ni(CO)4,其中配原子是___________。(5)钛称之为21世纪金属,具有一定的生物功能。钙钛矿(CaTiO3)晶体是工业获取钛的重要原料。CaTiO3晶胞如下图,边长为a=0.266m,晶胞中Ti、Ca、O分别处于顶角、体心、面心位n置。Ti与O间的最短距离为___________nm,与Ti紧邻的O个数为___________。(6)在CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,则T处于___________位置,O处于___________位置。【答案】(1).第四周期第ⅥB族(2).N(3).2NA(4).(5).sp3(6).C(7).0.188(8).12(9).体心(10).棱心【解析】【详解】(1)Cr为24号元素,在元素周期表中的位置为第四周期第ⅥB族,核外电子排布最高的能级层为第4层,为N层。答案为第四周期第ⅥB族N;(2)过氧根中的氧的化合价为-1价,其他的氧为-2价,则可以设有x个过氧根,有y个氧离子,则根据化合物的化合价代数和为0以及原子守恒,过氧根中有2个O为-1价,则有2x×(-1)+y×(-2)+5=0,2x+y=5,可以求得x=2,则1molCrO5中含有2mol过氧键,过氧键的数目为2NA;答案为2NA;(3)V为23号元素,其价电子的排布为3d34s2,则其价电子排布图为;从示意图可以看出来,每个S原子与4个氧原子形成四面体结构,类似于CH4,故其S原子的杂化类型为sp3,答案为sp3;(4)Ni(CO)4中,配位原子能够提供电子对,其配位原子是否有孤对电子和电负性有关,O的电负性太大,不易提供电子对,而O的孤对电子配位给C原子,使得C原子一端拥有的电子较多,而且C的电负性没有O大,易给出电子,因此配位原子是C。答案是C。(5)晶胞中Ti、Ca、O分别处于顶角、体心、面心位置。Ti与O间的最短距离为面对角线的一半,为nm,与Ti紧邻的O,在Ti原子的上部有4个,在与Ti原子同平面的有4个O原子,在Ti原子的下面也有4个O原子,一共12个,答案为0.188nm12;(6)CaTiO3晶胞结构的另一种表示中,Ca处于各顶角位置,O与Ga在同一直线上,则O在棱上。Ti在Ga形成的六面体的中心,则Ti为体心。答案为体心棱心12.对甲氧基肉桂酸异辛酯是目前世界上最常用的防晒剂之一,具有极高的紫外光吸收率,安n全性良好,毒性极小,因此广泛应用于日用化工、塑料、橡胶和涂料等领域。其合成路线如下:回答下列问题:(1)C的化学名称是___________。E中的两种含氧官能团的名称___________、___________。(2)B为单卤代烃,请写出合成线路中①的反应方程式___________。(3)写出由C生成D和由D生成E的反应类型___________、___________。(4)写出合成甲基肉桂酸异辛酯所需的F的结构简式___________。(5)X与F互同分异构体。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为6:2:1。写出符合上述条件的X的结构简式___________。(6)巴豆酸乙酯存在于苹果、木瓜、草莓、可可等中,在引发剂的作用下可以生成聚巴豆酸乙酯。请运用所学知识,结合上述合成过程,请写出以乙烯和丙二酸为原料合成聚巴豆酸乙酯的合成路线(无机试剂可任选)。____________________________________________________【答案】(1).对甲基苯酚(2).醛基(3).醚键(4).(5).取代反应(6).氧化反应(7).(8).(9).n【解析】【分析】甲苯在溴化铁作催化剂的条件下生成溴苯,根据C的结构简式,溴原子取代了甲基对位上的H。B到C为卤代烃的取代反应,C到D为羟基上的H被-CH3取代,生成醚键。D到E,甲基被氧化成醛基。F和G发生酯化反应。【详解】(1)属于酚类,羟基的对位有个甲基,名称为对甲基苯酚。E的两种含氧官能团,,图中的为醛基,图中的为醚键,答案为对甲基苯酚醛基、醚键;(2)B到C为卤代烃的取代反应,条件为NaOH水溶液,答案为;(3)C到D为羟基上的H被-CH3取代,生成醚键,为取代反应。D到E,甲基变成了醛基,—CH3变成—CHO,少了2个H原子,多了1个O原子,去氢加氧为氧化,为氧化反应,答案为取代反应氧化反应;(4)F和G发生的为酯化反应,再将产物中的酯基水解为醇和酸,即可得到F的结构简式,答案为;(5)X与F互同分异构体,F的分子式为C8H18O,核磁共振氢谱的峰面积之比为6:2:1,共有18个H原子,则其个数比为12:4:2。12表示4个处于对称位置的—CH3;另不可能是醇,因为醇羟基上的H,为单独的一个峰,只能是醚,则答案为;(6)从产物得到单体,单体应为CH3CH=CHCOOC2H5,得到的是酯,酯水解得到酸和醇,乙醇和nCH3CH=CHCOOH。要得到CH3CH=CHCOOH,模仿E到G的过程,乙醛和丙二酸可以得到CH3CH=CHCOOH。乙醛通过乙醇氧化得到,乙醇通过乙烯与水加成得到。答案为。