- 288.03 KB
- 2022-04-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
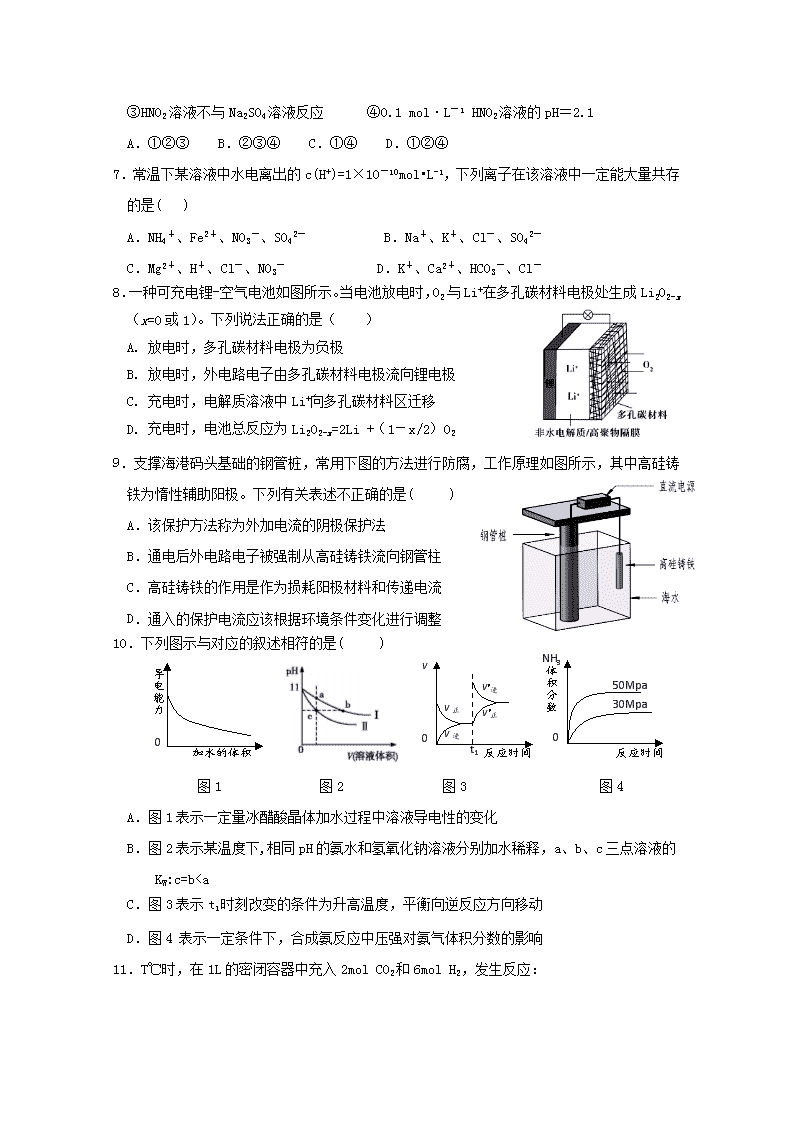
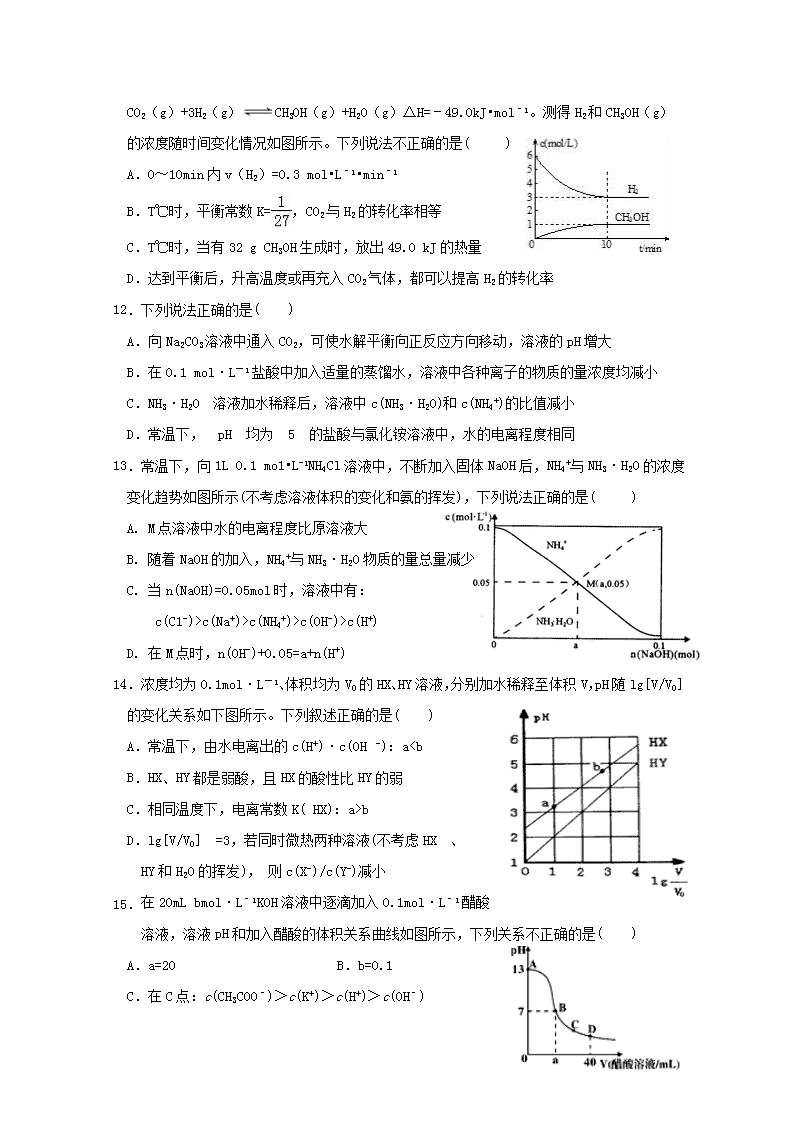
厦门市湖滨中学2018---2019学年第二学期期中考高二化学试卷可能用到的相对原子质量:C-12H-1O-16N-14Cu-64Fe-56一、单选题(共15题,每小题3分,共45分)1.下列对生产、生活中的有关问题认识正确的是()A.用新能源代替化石燃料,可以减少雾霾天气的发生B.采用催化转换技术提高汽车尾气中有害气体的转化率C.明矾、活性炭、氯化铁等净水剂,使用时均利用了水解的原理D.氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理2.下列说法正确的是()A.碳燃烧的热化学方程式为C(s)+1/2O2(g)=CO(g)ΔH=+110.5kJ·mol-1B.镀锌铁皮发生电化学腐蚀时,负极反应式为:Zn-2e–=Zn2+C.NaHS水解的离子方程式是:HS﹣+H2OS2﹣+H3O+D.溶液中碳酸的电离方程式为:H2CO32H++CO32–3.在CH3COOHH++CH3COO﹣的电离平衡中,要使电离平衡向左移动,应采取的措施是()A.加冰醋酸B.加CH3COONaC.加水D.加NaOH4.设NA为阿伏加德罗常数的值,下列说法正确的是()A.常温下,pH=1的盐酸中,含H+的数目为0.1NAB.含有1molNH4Cl和少量NH3·H2O的中性溶液中,NH4+数目为NAC.密闭容器中,2molSO2与1molO2充分反应后生成SO3的分子数为2NAD.电解饱和食盐水,当阴极产生2.24LH2时,转移的电子数一定为0.2NA5.下列说法中正确的是( )A.盐酸的导电能力一定比醋酸的导电能力强B.一定量的锌粒与足量稀硫酸反应,向反应混合液中加入醋酸钠固体,产生H2速率减小,H2体积减小C.同温度下,0.1mol·L-1氨水中NH的浓度比0.1mol·L-1NH4Cl溶液中NH的浓度小D.将CuCl2溶液在蒸发皿中加热蒸干并灼烧可得到CuCl2固体6.下列事实能说明亚硝酸是弱电解质的是()①25℃时亚硝酸钠溶液的pH大于7②用HNO2溶液做导电试验,灯泡很暗n③HNO2溶液不与Na2SO4溶液反应④0.1mol·L-1HNO2溶液的pH=2.1A.①②③B.②③④C.①④D.①②④7.常温下某溶液中水电离出的c(H+)=1×10-10mol•L-1,下列离子在该溶液中一定能大量共存的是()A.NH4+、Fe2+、NO3-、SO42-B.Na+、K+、Cl-、SO42-C.Mg2+、H+、Cl-、NO3-D.K+、Ca2+、HCO3-、Cl-8.一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是()A.放电时,多孔碳材料电极为负极B.放电时,外电路电子由多孔碳材料电极流向锂电极C.充电时,电解质溶液中Li+向多孔碳材料区迁移D.充电时,电池总反应为Li2O2-x=2Li+(1-x/2)O29.支撑海港码头基础的钢管桩,常用下图的方法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是()A.该保护方法称为外加电流的阴极保护法B.通电后外电路电子被强制从高硅铸铁流向钢管柱C.高硅铸铁的作用是作为损耗阳极材料和传递电流D.通入的保护电流应该根据环境条件变化进行调整10.反应时间0vv正v正v逆’v逆’t1体积分数0反应时间30Mpa50MpaNH3下列图示与对应的叙述相符的是()导电能力0加水的体积图1图2图3图4A.图1表示一定量冰醋酸晶体加水过程中溶液导电性的变化B.图2表示某温度下,相同pH的氨水和氢氧化钠溶液分别加水稀释,a、b、c三点溶液的KW:c=bc(Na+)>c(NH4+)>c(OH-)>c(H+)D.在M点时,n(OH-)+0.05=a+n(H+)14.浓度均为0.1mol·L-1、体积均为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg[V/V0]的变化关系如下图所示。下列叙述正确的是()A.常温下,由水电离出的c(H+)·c(OH -):abD.lg[V/V0] =3,若同时微热两种溶液(不考虑HX 、HY和H2O的挥发),则c(X-)/c(Y-)减小15.在20mLbmol·L﹣1KOH溶液中逐滴加入0.1mol·L﹣1醋酸溶液,溶液pH和加入醋酸的体积关系曲线如图所示,下列关系不正确的是()A.a=20B.b=0.1C.在C点:c(CH3COO﹣)>c(K+)>c(H+)>c(OH﹣)nD.在D点:c(CH3COO﹣)+c(CH3COOH)=2c(K+)二、填空题(共5题,55分)16.(10分)电化学应用广泛。请回答下列问题:(1)自发进行的氧化还原反应可以设计成原电池。若电池放电时的反应式为:2Cu+2H2SO4+O2=2CuSO4+2H2O,该电池的负极材料为_________;正极的电极反应式为____________。(2)燃料电池和二次电池的应用非常广泛。①如图为甲烷燃料电池的示意图,则负极的电极反应式为;②铅蓄电池为生活中常用的二次电池。放电时的反应为:PbO2+Pb+2H2SO4===2PbSO4+2H2O,铅蓄电池负极的电极反应式为;充电时,铅蓄电池的PbO2极应与外加直流电源的_____极相连。(3)以铅蓄电池为电源精炼粗铜(含Fe、Pb、Ag、Au及其他不反应物质)时,以硫酸铜溶液为电解质溶液,粗铜做_____极;精炼一段时间后,当阴极增重128g时,铅蓄电池参加反应的硫酸的物质的量为______mol。17.(16分)I:电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25℃):化学式电离平衡常数HCNK=4.9×10-10CH3COOHK=1.8×10-5H2CO3K1=4.4×10-7,K2=4.7×10-11(1)25℃时,等浓度的三种溶液【A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液】的pH由大到小的顺序为__________________(填写序号)(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为;(3)现有浓度为0.02mol/L的HCN与0.01mol/LNaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是(填标号)。A.c(H+)>c(OH-)B.c(H+)”“<”或“=”)③向反应器中再分别充入下列气体,能使H2S转化率增大的是(填标号)。A.H2SB.CO2C.COSD.N219.(10分)一定条件下,在体积为5L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如图1所示。已知达平衡后,降低温度,A的体积百分含量将减小。(1)根据上图数据,写出反应的化学方程式;从反应开始到平衡时的平均速率v(C)=。(2)该反应的ΔH0(填“>”、“<”或“=”)。(3)此反应平衡常数的表达式为K=。(4)该反应的反应速率v和时间t的关系如图2所示:①根据上图判断,在t3时刻改变的外界条件是。②A的转化率最大的一段时间是。n③各阶段的平衡常数如表所示:K1、K2、K3之间的关系为:(用“>”、“<”或“=”连接)。20.(11分)我们在实验室模拟工业制氨的过程,以探究外界条件对平衡的影响。查阅资料,获得以下键能数据:化学键N≡NH-HN-H键能/(kJ/mol)946436391(1)计算工业合成氨反应的反应热:N2(g)+3H2(g)2NH3(g)△H=________kJ/mol(2)一定温度下,向一个恒压容器中充入N20.6mol,H20.5mol,在一定温度下进行反应:N2(g)+3H2(g)2NH3(g),达到平衡时,N2的转化率为1/6,此时容器的体积为1L。①该温度时容器中平衡体系的平衡常数是______________。②若保持平衡时的温度和压强不变,继续向平衡体系中通入氖气,则平衡将____(填“正向”,“逆向”或“不”)移动。(3)在两个压强相等,温度分别为T1和T2的容器中充入由1molN2和3molH2组成的混合气体,发生反应N2(g)+3H2(g)2NH3(g),平衡后改变容器体积,容器内N2的体积分数随压强的变化如图所示。据图判断下列说法正确的是____(填标号)。a.A、B、C三点的平衡常数大小关系:KAC(4)合成氨工业会产生大量副产物CO2,工业上常用高浓度的K2CO3溶液吸收CO2得溶液X,再利用电解法使K2CO3溶液再生,其装置如图所示:①在阳极区发生的反应包括____________________和H++HCO3-=H2O+CO2↑。②简述CO32-在阴极区再生的原理_______________________________________________________。③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。已知:25℃,101KPa下:n2H2(g)+O2(g)=2H2O(g)ΔH1=—484kJ/mol2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)ΔH2=—1352kJ/mol写出CO2和H2生成1molCH3OH(g)的热化学方程式______________________________。n厦门市湖滨中学2018---2019学年第二学期期中考高二化学试卷答案123456789101112131415ABBBCCBDCDDCDAA16.(10分)(1)铜或Cu(1分)O2+4e-+4H+=2H2O(2分)(2)①CH4+10OH--8e-==CO32-+7H2O (2分)②Pb+SO42--2e-=PbSO4(2分)正(1分)(3)阳(1分)4(1分)17、(16分)I:(1)B>A>C(2分)(2)CNˉ+CO₂+H2O=HCO3ˉ+HCN(2分)(3)B、D(2分)(4)HCO3ˉ+H2OH2CO3+OHˉ(2分)c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)(2分)c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)(2分)II:(1)稀盐酸。(1分)(2)Al3++3HCO3ˉ=Al(OH)3↓+3CO₂↑(2分)(3)10:1(1分)18.(8分)(1)D(1分)(2)①2.5(2分)0.0028(2分)②>(1分)>(1分)③B(1分)19.(10分)(1)A+2B2C;(2分)0.04mol•L﹣1•min﹣1(2分)(2)<。(1分)(3)K=。(2分)(4)①升高温度。(1分)②t2—t3(1分)③K13>K2=K3(1分)20.(11分)(1)—92(2分)(2)①10(2分)②逆向(1分)(3)b(1分)(4)①4OH--4e-==O2↑+2H2O(1分)n②溶液中HCO3-存在电离平衡:HCO3-CO32-+H+(1分),阴极H+放电,c(H+)减少平衡右移CO32-再生(或阴极H+放电,使c(OH-)增大,OH-与HCO3-反应生成CO32-).(2分)③CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-50kJ/mol.(2分)