- 2.33 MB
- 2022-04-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
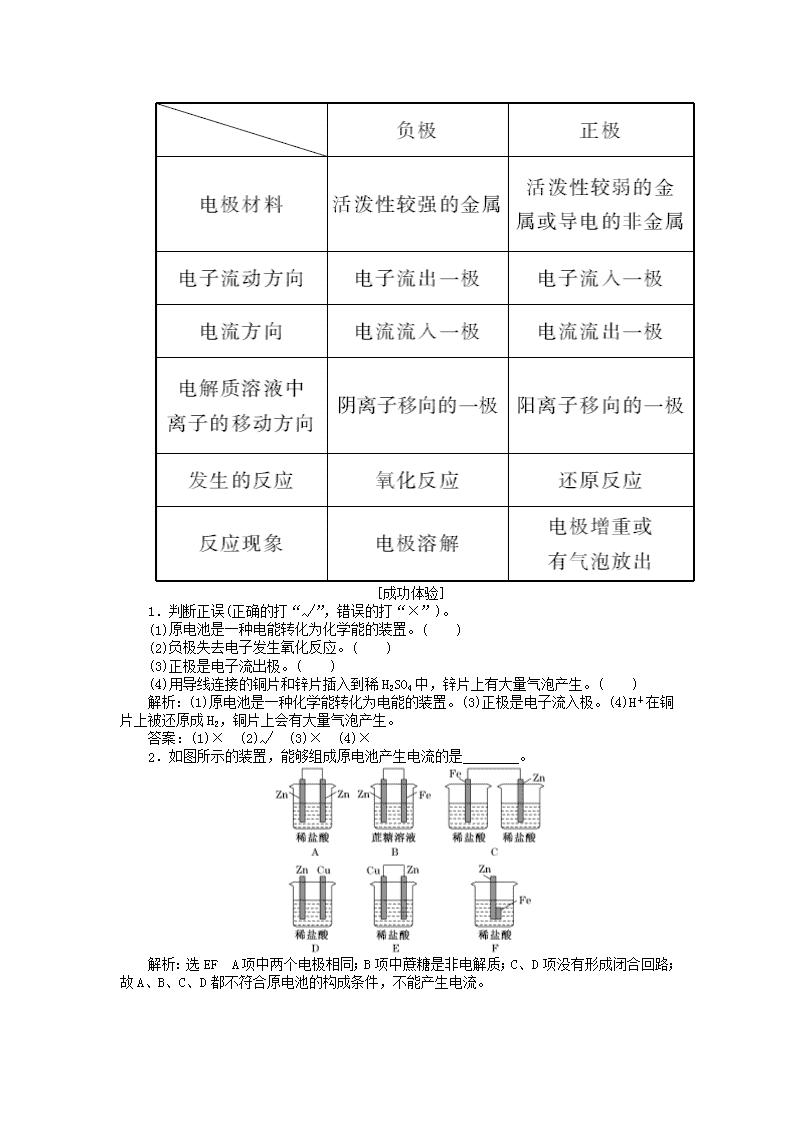
化学能转化为电能 化学电源1.什么是氧化反应?物质发生氧化反应时,所含元素的化合价如何变化?提示:元素原子失去电子的反应称为氧化反应;物质发生氧化反应时,元素的化合价升高。2.什么是还原反应?物质发生还原反应时,所含元素的化合价如何变化?提示:元素原子得到电子的反应称为还原反应;物质发生还原反应时,元素的化合价降低。3.铜和锌都与稀硫酸反应吗?若反应,请写出反应的离子方程式,并指出反应中的哪种物质发生氧化反应,哪种物质发生还原反应。提示:铜与稀硫酸不反应;锌和稀硫酸发生反应:Zn+2H+===Zn2++H2↑,反应中Zn发生氧化反应,H+发生还原反应。[新知探究]探究1 铜、锌用导线相连浸入稀硫酸中,线路中能否有电流产生?依据教材P40活动与探究,完成表格。n探究2 能否将HCl+NaOH===NaCl+H2O设计成原电池?2Fe3++Cu===Cu2++2Fe2+呢?提示:不能将HCl与NaOH的反应设计成原电池,原因是该反应不是氧化还原反应;能将2Fe3++Cu===Cu2++2Fe2+的反应设计成原电池,原因是该反应是氧化还原反应。探究3 请从电子流向和离子移动的方向分析原电池是怎样形成闭合回路并产生电流的?提示:在外电路,电子从负极流出经过导线流向正极;故在电解质溶液中,阳离子向正极移动,阴离子向负极移动,从而形成闭合回路产生电流。[必记结论]1.原电池的构成条件原电池2.原电池的电极名称及电极反应3.原电池正、负极的判断方法n[成功体验]1.判断正误(正确的打“√”,错误的打“×”)。(1)原电池是一种电能转化为化学能的装置。( )(2)负极失去电子发生氧化反应。( )(3)正极是电子流出极。( )(4)用导线连接的铜片和锌片插入到稀H2SO4中,锌片上有大量气泡产生。( )解析:(1)原电池是一种化学能转化为电能的装置。(3)正极是电子流入极。(4)H+在铜片上被还原成H2,铜片上会有大量气泡产生。答案:(1)× (2)√ (3)× (4)×2.如图所示的装置,能够组成原电池产生电流的是________。解析:选EF A项中两个电极相同;B项中蔗糖是非电解质;C、D项没有形成闭合回路;故A、B、C、D都不符合原电池的构成条件,不能产生电流。n[新知探究]探究1 钢铁在潮湿空气中长时间放置后表面有褐色的锈斑,你知道锈斑的化学成分是什么吗?提示:锈斑的主要成分是Fe2O3·xH2O。探究2 什么叫电化学腐蚀?写出钢铁在潮湿的空气里发生电化学腐蚀时的正极反应式。提示:金属跟电解质溶液接触,发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀;正极反应式为2H2O+O2+4e-===4OH-。[必记结论]1.电化学腐蚀金属跟电解质溶液接触,发生原电池反应,比较活泼的金属失去电子而被氧化的腐蚀。2.钢铁的电化学腐蚀[成功体验]3.家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此过程中不能发生的化学反应是( )A.4Fe(OH)2+O2+2H2O===4Fe(OH)3B.2Fe+O2+2H2O===2Fe(OH)2C.O2+2H2O+4e-===4OH-D.Fe-3e-===Fe3+解析:选D 只考虑到Fe与O2在室温下不反应而错选B。洗过的铁锅在空气中放置,可发生吸氧腐蚀。电极反应式分别为负极:2Fe-4e-===2Fe2+,正极:O2+2H2O+4e-===4OH-;总反应式:2Fe+O2+2H2O===2Fe(OH)2,而Fe(OH)2在空气中又易被氧化为Fe(OH)3。4.如图所示,液面上浮着一个空心铁球。数天后可观察到的现象是( )n①铁球表面出现红棕色锈斑 ②铁球表面出现黑色锈斑③量筒内水位下降 ④量筒内水位上升A.①③ B.①④ C.②③ D.③④解析:选B 量筒中的空气、溶有O2的食盐水和铁球(铁碳合金)组成原电池,发生了电化学腐蚀。其负极反应式是2Fe-4e-===2Fe2+,正极反应式是O2+2H2O+4e-===4OH-。Fe2+与OH-结合成Fe(OH)2,再被氧化成Fe(OH)3,Fe(OH)3脱水成为Fe2O3·xH2O而在铁球表面出现红棕色锈斑。由于量筒中的O2被吸收,所以量筒内的水位会上升。[新知探究]探究1 铅蓄电池作为电池的反应为:Pb(s)+PbO2(s)+2H2SO4===2PbSO4(s)+2H2O(l),电池的正、负极材料是什么?电解质溶液是什么?提示:正极材料:PbO2;负极材料:Pb;电解质溶液;稀H2SO4。探究2 常见的化学电源主要有①锌锰干电池,②银锌纽扣电池,③铅蓄电池,④镍氢电池(用于电动自行车)。以上电池哪些属于一次电池?哪些属于二次电池?提示:①②属于一次电池;③④属于二次电池。探究3 氢氧燃料电池反应原理示意图如下:该电池的正、负极分别是哪一极?试写出正、负极的电极反应式。提示:通入O2的一极为正极,通入H2的一极是负极。电极反应式分别为负极:2H2+4OH--4e-===4H2O,正极:2H2O+O2+4e-===4OH-。[必记结论]1.化学电源的原理原电池原理。2.化学电源的优点化学电源的能量转化率比燃料燃烧大的多。3.化学电源的分类4.常见化学电源的组成n[成功体验]5.判断正误(正确的打“√”,错误的打“×”)。(1)手机上用的锂离子电池属于二次电池。( )(2)锌锰干电池中,锌电极是正极。( )(3)氢氧燃料电池中通入氢气的一极为负极,发生还原反应。( )(4)废旧电池需回收集中处理的原因是为了回收电池外壳的金属材料。( )答案:(1)√ (2)× (3)× (4)×6.已知空气锌电池的电极反应如下:锌电极:Zn+2OH--2e-===ZnO+H2O;石墨电极:O2+H2O+2e-===2OH-。可以判断石墨电极是( )A.负极,发生还原反应B.正极,发生氧化反应C.负极,发生氧化反应D.正极,发生还原反应解析:选D 空气锌电池中,失去电子的一极是负极,发生氧化反应,得到电子的一极是正极,发生还原反应。[新知探究]nnnn[成功体验]7.在如图所示的装置中,金属a的金属活动性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )A.碳棒上有气体放出,溶液pH变大B.a是正极,b是负极C.导线中有电子流动,电子从a极到b极D.a极上发生了氧化反应解析:选B 显然,电极a、b与电解质溶液稀H2SO4组成原电池,因活泼性a>b(碳棒),所以a为电池的负极,失电子,发生氧化反应,b为正极,H+在表面得电子,发生还原反应。由于正极消耗H+,故溶液中c(H+)减小,pH增大,在外电路中,电子由a极流向b极。———————————————[关键语句小结]————————————————1.构成原电池的条件(1)具有活泼性不同的两个电极;(2)两电极必须插入电解质溶液中;(3)形成闭合回路;(4)能自发地发生氧化还原反应。2.原电池工作原理口诀原电池分两极(正、负);负极氧化正(极)还原;电子由负(极)流向正(极);阳(离子)向正(极)阴(离子)向负(极)。3.原电池正、负极的判断化合价升高―→失去电子―→发生氧化反应―→负极;化合价降低―→得到电子―→发生还原反应―→正极。n4.钢铁发生电化学腐蚀的电极反应和总反应负极反应:Fe-2e-===Fe2+,正极反应:O2+4e-+2H2O===4OH-,总反应:2Fe+O2+2H2O===2Fe(OH)2,4Fe(OH)2+O2+2H2O===4Fe(OH)3。[例1] 将锌片和铜片用导线连接置于稀硫酸溶液中,下列各叙述错误的是( )A.锌片作负极,锌发生还原反应B.铜片作正极C.正极反应为:2H++2e-===H2↑D.溶液中的H+移向正极解析:选A 该装置为原电池,锌比铜活泼,锌作负极,失电子发生氧化反应;铜作正极,H+向正极移动,在正极得电子,电极反应为2H++2e-===H2↑,A错,B、C、D正确。(1)原电池工作中“三个方向”和“一个类型”:(2)电极反应式的书写:1.在例1中:(1)实验中观察到哪些现象?(2)电子的流向如何?若收集到标准状况下气体2.24L,则转移电子的物质的量是多少?n提示:(1)锌电极不断溶解,铜电极上产生H2。(2)电子由负极(锌片)经导线流向正极(铜片)。收集到H2为=0.1mol,转移电子为0.1mol×2=0.2mol。1.加快化学反应速率(1)分析:构成原电池,加快了电子转移,加快了化学反应速率。(2)实例:实验室用Zn和稀H2SO4(或稀HCl)反应制H2,常用粗锌,它产生H2的速率快。原因是粗锌中的杂质和锌、稀H2SO4的溶液形成原电池,加快了锌的腐蚀,使产生H2的速率加快。2.比较金属的活动性强弱(1)分析:原电池中,一般活动性强的金属为负极,活动性弱的金属为正极。(2)实例:有两种金属A和B,用导线连接后插入到稀硫酸中,观察到A极溶解,B极上有气泡产生,由原电池原理可知,金属活动性A>B。3.金属腐蚀的防护(1)分析:将被保护金属设计成原电池的正极。(2)实例:轮船在海里航行时,为了保护轮船不被腐蚀,可以在轮船上焊上一些活泼性比铁更强的金属,如Zn,这样构成的原电池Zn为负极,而Fe为正极,从而防止了铁的腐蚀。4.制作化学电源——设计原电池(1)分析:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(电解质溶液中的阳离子)在正极上被还原。即:负极:还原剂-ne-===氧化产物;正极:氧化剂+ne-===还原产物。(2)实例:利用氧化还原反应Zn+CuSO4===ZnSO4+Cu设计成如图所示的原电池。a.该原电池的电极反应为:负极(Zn):Zn-2e-===Zn2+(氧化反应);正极(Cu):Cu2++2e-===Cu(还原反应)。b.装置:[例2] 一个原电池总反应为:Zn+M2+===Zn2++M。(1)该原电池电极材料及电解质可能是________。(2)M可以是下列金属中________。A.Mg B.FeC.CuD.Agn解析:(1)原电池总反应Zn+M2+===Zn2++M可分为Zn-2e-===Zn2+(氧化反应),M2++2e-===M(还原反应),发生氧化反应的一极为原电池的负极,发生还原反应的一极为原电池的正极,因此,负极材料只能为Zn,正极上M2+放电被还原为M,电解质为M的可溶性盐,电极材料为活泼性比Zn弱的金属(或导电的非金属),如Cu、Fe、Pt(或石墨)等。故C正确。(2)据(1)分析知M可以为比Zn活泼性差的+2价金属,故B、C正确。答案:(1)C (2)BC利用给出的氧化还原反应设计原电池的两种情况:(1)若给出的为氧化还原反应的化学方程式,则负极为还原剂失电子,正极为氧化剂得电子,电解质为氧化剂(或反应物中的溶剂)。如Fe+CuSO4===FeSO4+Cu,负极为Fe-2e-===Fe2+,正极为Cu2++2e-===Cu,电解质为CuSO4。(2)若给出的为离子方程式,则负极为还原剂失电子,正极为氧化剂得电子,电解质为含氧化性离子的酸或盐。如该例2中电解质为CuSO4,也可为CuCl2。2.例2中:(1)该原电池中负极、正极的质量如何变化?(2)请画出该原电池装置图,并指出反应的正、负极及电解质。提示:(1)负极锌失电子溶解,质量减小,正极Cu2++2e-===Cu,析出金属,质量增加。(2) [例3] 如图为氢氧燃料电池原理示意图,根据此图的提示,下列叙述不正确的是( )A.a电极是负极B.b电极的电极反应为4OH--4e-===2H2O+O2↑C.氢氧燃料电池是一种具有应用前景的绿色电源D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部贮存在电池内的新型发电装置解析:选B 氢氧燃料电池的总反应为2H2+O2===2H2O,因此a电极上发生反应2H2-4e-===4H+,a电极是负极;b电极上发生反应O2+2H2O+4e-===4OH-,b电极是正极,以上电极反应式,适用电解质溶液为Na2SO4溶液等;氢氧燃料电池的能量转化率较高,且产物是H2O,无污染,是一种具有应用前景的绿色电源;氢氧燃料电池通入H2、O2就能工作,无需将H2、O2贮存在电池内部。燃料电池中当两电极均为惰性电极时,由引入到两电极上的物质发生反应,负极是还原剂,即燃料失电子,正极是氧化剂,得电子,写电极反应时,要注意电解质溶液对电极反应的影响。燃料电池是一种新型电池,它主要是利用燃料燃烧原理把化学能直接转化为电能,氢氧燃料电池的基本反应是:nX极:O2(g)+H2O(l)+2e-===2OH-Y极:H2(g)+2OH--2e-===2H2O(l)下列说法正确的是( )A.X是负极B.Y是正极C.Y极上发生还原反应D.Y极上发生氧化反应解析:选D 由电极反应式可知:X极上发生得到电子的还原反应,是原电池的正极,Y极上发生失去电子的氧化反应,是原电池的负极。1.下列关于原电池的叙述,错误的是( )A.构成原电池的正极和负极必须是两种不同的金属B.原电池是将化学能转变为电能的装置C.在原电池中,电子流出的一极是负极,发生氧化反应D.原电池放电时,电子的方向是从负极到正极解析:选A 构成原电池的两个电极也可以是一种金属和一种能导电的非金属,如石墨,A项错误;B项正确;在原电池中,电子流出的一极发生氧化反应,是负极,C项正确;原电池放电时,电子从负极到正极,D项正确。2.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为( )A.铝 B.铜 C.锡 D.硅解析:选C 据题意可知该金属的活泼性比锌弱,但在金属活动性顺序表中排在H的前面,故选C。3.下列有关电池的说法不正确的是( )A.手机上用的锂离子电池属于二次电池B.铜、锌原电池工作时,电子沿外电路从铜电极流向锌电极C.甲醇燃料电池可把化学能转化为电能D.锌锰干电池中,锌电极是负极解析:选B 铜、锌原电池中,Zn作负极,Cu作正极,稀H2SO4作电解质溶液,电子沿外电路从Zn极流向Cu极。4.某原电池的总反应的离子方程式是Zn+Cu2+===Zn2++Cu,则该反应的原电池组成正确的是( )选项ABCD正极ZnCuAgCu负极CuZnCuFe电解质溶液CuCl2CuSO4H2SO4ZnCl2解析:选B 根据原电池中发生的化学反应,负极反应式为Zn-2e-===Zn2+,正极反应式为Cu2++2e-===Cu。故选项B符合题意。5.(1)下列装置属于原电池的是________。n(2)在选出的原电池中,________是负极,发生________反应,________是正极,该极的现象是________________________________________________________________________;(3)此原电池反应的化学方程式为________________________________。解析:(1)依据构成原电池的基本条件,只有⑤符合。(2)在装置⑤中,较为活泼的金属铁作负极,发生氧化反应:Fe-2e-===Fe2+;不活泼的金属铜作正极,正极上发生还原反应:2H++2e-===H2↑,所以看到的现象是正极产生气泡。(3)由上述分析,可确定此原电池的总反应式是Fe+H2SO4===FeSO4+H2↑。答案:(1)⑤ (2)Fe 氧化 Cu 电极上产生气泡 (3)Fe+H2SO4===FeSO4+H2↑