- 439.23 KB
- 2022-04-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
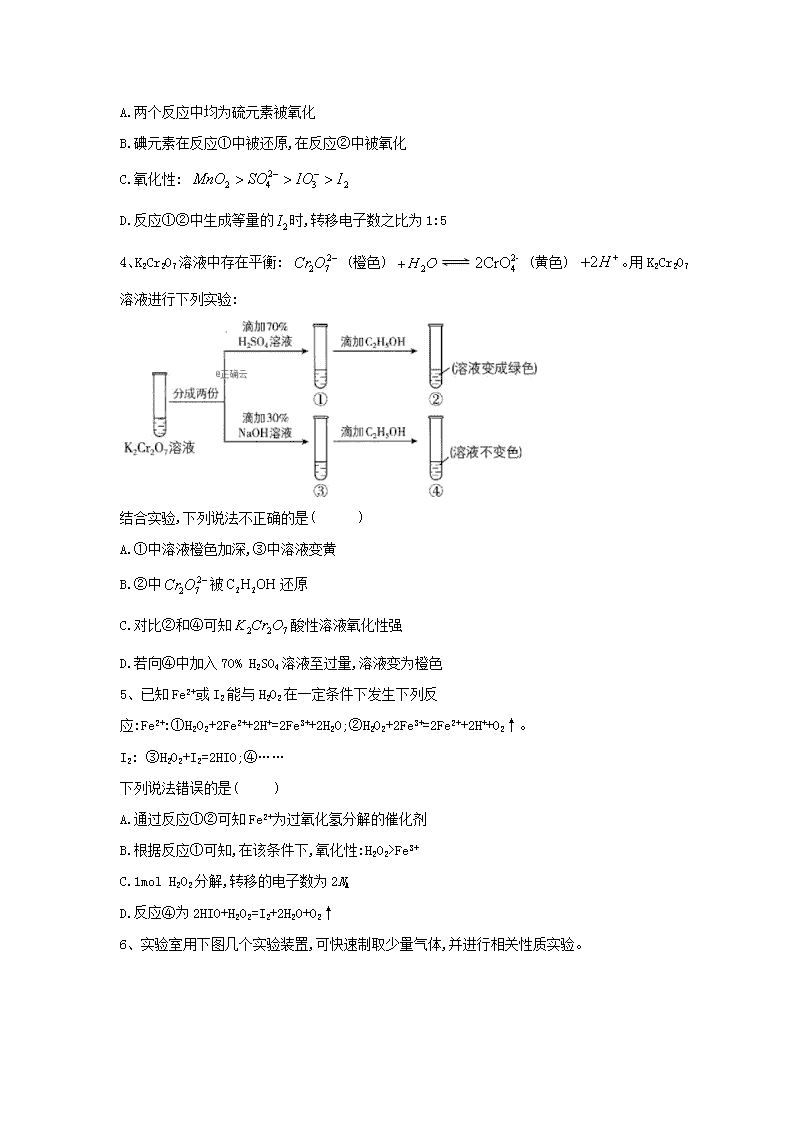
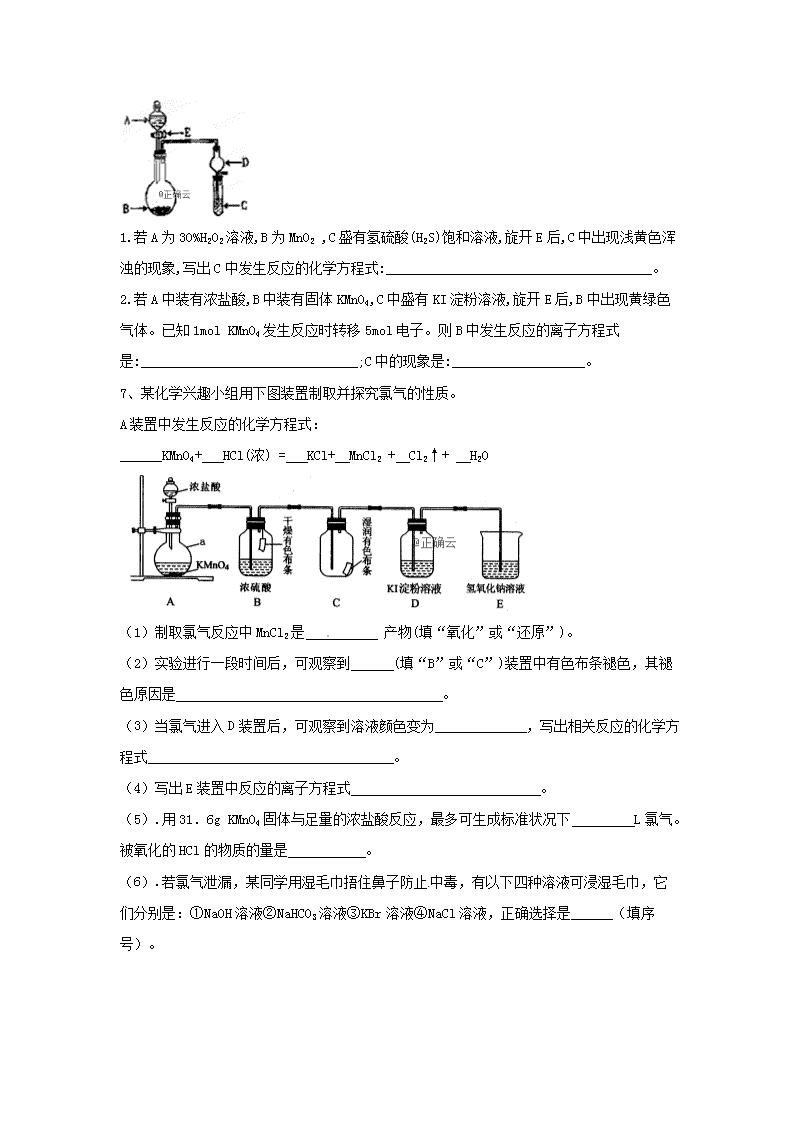
氧化还原反应(9)1、下列叙述中不正确的是( )A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、、B.1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NAC.在中和滴定实验中,既可用标准溶液滴定待测液,也可用待测液滴定标准溶液D.某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O。已知As是产物之一,则该反应配平后H2O的化学计量数为62、煤的电化学脱硫是借助煤在电解槽阳极发生的电化学氧化反应,将煤中黄铁矿(FeS2)或有机硫化物氧化成可溶于水的含硫化合物而达到净煤目的,下图是一种脱硫机理,则下列说法正确的是( )l—电极a 2—黄铁矿 3—MnSO4、H2SO4混合溶液 4—未反应黄铁矿 5一电解产品A.Mn3+充当了电解脱硫过程的催化剂B.电极a应与电源负极相连C.脱硫过程中存在的离子反应为D.阴极发生的反应3、反应①②分别是从海藻灰和某种矿石中提取碘的主要反应:①;②。下列说法正确的是( )nA.两个反应中均为硫元素被氧化B.碘元素在反应①中被还原,在反应②中被氧化C.氧化性:D.反应①②中生成等量的时,转移电子数之比为1:54、K2Cr2O7溶液中存在平衡:(橙色)(黄色)。用K2Cr2O7溶液进行下列实验:结合实验,下列说法不正确的是( )A.①中溶液橙色加深,③中溶液变黄B.②中被还原C.对比②和④可知酸性溶液氧化性强D.若向④中加入70%H2SO4溶液至过量,溶液变为橙色5、已知Fe2+或I2能与H2O2在一定条件下发生下列反应:Fe2+:①H2O2+2Fe2++2H+=2Fe3++2H2O;②H2O2+2Fe3+=2Fe2++2H++O2↑。I2:③H2O2+I2=2HIO;④……下列说法错误的是( )A.通过反应①②可知Fe2+为过氧化氢分解的催化剂B.根据反应①可知,在该条件下,氧化性:H2O2>Fe3+C.1molH2O2分解,转移的电子数为2NAD.反应④为2HIO+H2O2=I2+2H2O+O2↑6、实验室用下图几个实验装置,可快速制取少量气体,并进行相关性质实验。n1.若A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式:______________________________________。2.若A中装有浓盐酸,B中装有固体KMnO4,C中盛有KI淀粉溶液,旋开E后,B中出现黄绿色气体。已知1molKMnO4发生反应时转移5mol电子。则B中发生反应的离子方程式是:_______________________________;C中的现象是:___________________。7、某化学兴趣小组用下图装置制取并探究氯气的性质。A装置中发生反应的化学方程式:______KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O(1)制取氯气反应中MnCl2是产物(填“氧化”或“还原”)。(2)实验进行一段时间后,可观察到(填“B”或“C”)装置中有色布条褪色,其褪色原因是。(3)当氯气进入D装置后,可观察到溶液颜色变为,写出相关反应的化学方程式。(4)写出E装置中反应的离子方程式。(5).用31.6gKMnO4固体与足量的浓盐酸反应,最多可生成标准状况下L氯气。被氧化的HCl的物质的量是。(6).若氯气泄漏,某同学用湿毛巾捂住鼻子防止中毒,有以下四种溶液可浸湿毛巾,它们分别是:①NaOH溶液②NaHCO3溶液③KBr溶液④NaCl溶液,正确选择是______(填序号)。n8、Ⅰ.某厂废水中含KCN,其浓度为0.01mol·L-1,现用氯氧化法处理,发生如下反应(化合物中N化合价均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O(1)上述反应中被氧化的元素是__________(用元素符号表示)。(2)投入过量液氯,可将氰酸盐进一步氧化为氮气,请配平下列化学方程式:__________KOCN+__________Cl2+__________=__________K2CO3+__________N2+__________KCl+__________(3)若将10L含KCN的浓度为0.01mol·L-1的废水中KCN氧化除去,最少需要氯气__________mol。(4)Ⅱ.某实验小组为了测定(3)中溶液多余Cl2的含量,常用Na2S2O3标准溶液进行定量测定。现实验室需用480mL一定浓度的Na2S2O3溶液,配制该溶液所需玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管外,还需__________.(5)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO,因此Na2S2O3常用作脱氯剂,该反应的离子方程式为__________.9、FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:(1).FeCl3净水的原理是__________________________________。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离字方程式表示)__________________。(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为_________。②完成NaClO3氧化FeCl2的离子方程式:____+____Fe2++_______=____Cl-+____Fe3++_______10、在热的稀硫酸中溶解11.4gFeSO4固体,加入足量KNO3溶液,使Fe2+全部转化成Fe3+,并放出NO气体。n(1)反应中氧化产物是__________(填化学式);当FeSO4恰好完全反应时,转移电子的物质的量为__________(2)配平该反应的化学方程式:__________FeSO4+__________KNO3+__________H2SO4=__________K2SO4+__________Fe2(SO4)3+__________NO+__________H2O(3)用单线桥法表示下列反应的电子转移方向和数目:2Mg+CO22MgO+C11、高纯硝酸锶[Sr(NO3)2]用于制造电视显像管、光学玻璃,也用于医药等。I.工业硝酸锶中常含有硝酸钙、硝酸钡等杂质(硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸)。提纯硝酸锶的实验步骤如下:①取含杂质的硝酸锶样品,__________,搅拌,过滤,并用浓HNO3洗涤滤渣。②将滤渣溶于水中,加略过量(NH4)2Cr2O7(重铬酸铵),用氨水调节pH为7.5左右,使Ba2+沉淀,过滤。③将滤液用硝酸调节pH为1时,慢慢加入H2C2O4·2H2O将过量的还原为Cr3+,再用氨水调节pH=7,生成Cr(OH)3沉淀,过滤。④将滤液用硝酸调节pH至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。⑤将得到的Sr(NO3)2·2H2O晶体在100℃条件下干燥,得到高纯硝酸锶。II.Sr(NO3)2受热易分解,生成Sr(NO2)2和O2;在500℃时,Sr(NO2)2进一步分解生成SrO及氮氧化物。取一定质量含Sr(NO2)2的Sr(NO3)2样品,加热至完全分解,得到10.40gSrO固体和10.16g混合气体。(1)补充完整步骤①;(2)步骤③中H2C2O4·2H2O将过量的还原为Cr3+,同时产生一种无色无味的气体,写出该反应的离子方程式:___________________________。(3)步骤③中生成的Cr(OH)3沉淀经处理后可以循环使用,方法是:一定条件下向Cr(OH)3中加入H2O2后,再加入氨水,即可得到(NH4)2Cr2O7(重铬酸铵)。请写出由Cr(OH)3生成(NH4)2Cr2O7的化学方程式:________________________。(4)过氧化锶(SrO2·2H2O)制备原理:Sr(NO3)2+H2O2+2NH3·H2O=SrO2·2H2O↓+2NH4NO3。测得相同时间内H2O2的利用率随浓度的变化关系如图所示。5%的H2O2比20%的H2O2的利用率低的原因是_____________________________。n(5)计算该样品中Sr(NO3)2的质量分数(请写出计算过程,结果精确到0.01)__________________________________。12、CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解制备CuCl,并验证其它分解产物。【查阅资料】①②CuCl是一种白色难溶固体,潮湿CuCl在空气中缓慢被氧化【实验探究】该小组选用下图装置进行实验(夹持加热仪器略)。(1)配平潮湿CuCl在空气中被氧化的化学方程式:____CuCl+_____+_____=3+______HCl(2)装置A用于制取HCl:,浓硫酸在该反应中体现强酸性和_________性;(3)按实验要求选择上图装置,连接顺序为:a____________(按气流方向,用小写字母表示);(4)根据完整的实验装置进行实验,实验步骤如下:①连接装置,________________;②装入药品;③打开分液漏斗活塞;④控制温度加热硬质玻璃管一段时间;⑤停止通HCl,升温继续加热;步骤④通HCl的目的是______________________;n(5)装置E中发生反应的离子方程式是______________________________。【实验分析与改进】(6)装置B中试纸先变蓝后又褪色,经查资料获知过量的能将氧化。甲同学认为可将湿润的淀粉KI试纸改成足量的淀粉KI溶液以克服过量的问题,但小组分析后认为该方案存在一个明显安全问题:__________________________________(7)反应结束后,CuCl产品中可能含有少量未分解的,乙同学认为只用一种日常生活常见的液体即可检验。该实验方案为:取少量固体放入小试管中,_________________________________。13、钒电池是一种新型酸性硫酸盐二次电池,钒电池失效后,废电解液回收利用的一种工艺如下:已知:a.+5价钒在溶液中存在如下平衡:。b.部分含钒物质在水中的溶解性见下表:物质VOSO4NH4VO3(VO2)2SO4溶解性可溶难溶易溶(1)氧化工序中,其他价态的钒全部氧化成,完成V2+氧化的离子方程式:____V2++____+_____ ________=________Cl-+_____ _________NaClO和NaClO3均可作氧化剂,该工序中不选择NaClO作氧化剂的理由是_________________________。(2)浓缩工序中,加入NaOH的作用是________________________。(3)沉钒工序的化学方程式为_________________________。n(4)煅烧偏钒酸铵时,固体(取234gNH4VO3)质量的减少量随温度变化的曲线如图所示,100~200℃时产生的一种气体的电子式为________,300~350℃时发生反应的化学方程式为____________________。14、化石燃料燃烧时会产生SO2进入大气形成酸雨,有多种方法可用于SO2的脱除。(1)已知SO2可参与如下热力学循环:SO2(g)+I2(s)+2H2O(l)=2HI(aq)+H2SO4(aq) ΔH1=-151kJ•mol-12HI(aq)=I2(s)+H2(g) ΔH2=+110kJ•mol-1H2S(g)+H2SO4(aq)=S(s)+SO2(g)+2H2O(l) ΔH3=+61kJ•mol-1反应H2S(g)=H2(g)+S(s)的ΔH=__________kJ•mol-1(2)NaClO碱性溶液吸收法。工业上常用碱性NaClO废液吸收SO2,反应原理为:ClO−+SO2+2OH−=Cl−++H2O,为了提高吸收效率,常用Ni2O3作为催化剂。在反应过程中产生的四价镍和氧原子具有极强的氧化能力,可加快对SO2的吸收。该催化过程如下图所示:a.过程1的离子方程式是Ni2O3+ClO-=2NiO2+Cl-,过程2的离子方程式为___________________________________。b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是__________________________。(3)Na2CO3溶液、氨水等碱性溶液吸收法。已知25℃时,含硫物种(即水溶液中H2SO3、、)随pH变化如图−1所示,脱硫效率随pH变化如图−2所示。①当用Na2CO3溶液吸收SO2至溶液的pH为4时,发生反应的离子方程式是_____________________________。②当用氨水吸收SO2至溶液的pH=7时,与溶液中存在的含硫物种之间的关系是c()=______________。③由实验测得氨水脱除SO2时,脱硫效率随pH的变化如图-2所示。在pH<5.5,p较小时脱硫效率低的可能原因是_____________________________________;实际工艺中,吸收液的pH应控制在一定范围内,pH不宜过大的原因是____________________________n15四氯化锡是一种无色、有强烈刺激性的液体,有腐蚀性,常用作媒染剂和有机合成上的氯化催化剂,工业上常用氯气与金属锡或SnCl2反应来制得。某化学兴趣小组把干燥氯气通入熔融SnCl2·2H2O中制取无水SnCl4,实验装置如图所示.物质摩尔质量/g·mol-1熔点/℃沸点/℃性质SnCl2·2H2O22637.7623易水解SnCl4261-33114.1易水解(1)盛装SnCl4的容器应贴上的安全警示标签是( )A.B.nC.D.(2)装置b的名称是 ,其作用为 、 .(3)为避免SnCl4水解,通Cl2前应先除去SnCl2·2H2O的结晶水,其操作是 ;在潮湿空气中SnCl4水解产生白色烟雾,该反应的化学方程式为 .(4)该学习小组最终制得的SnCl4呈黄色,可能的原因是 ;如果要除去黄色得到无色产品,做法是 .(5)可以通过测定剩余SnCl2的量来计算实验的产率,方法是让残留的SnCl2与足量硫酸铁铵反应,其中Fe3+被Sn2+还原为Fe2+。然后在硫酸和磷酸混合条件下,以二苯胺磺酸钠作指示剂,用K2Cr2O7标准溶液滴定生成的Fe2+。操作过程中涉及的离子方程式为a.Sn2++2Fe3+=2Fe2++Sn4+b.①完成并配平上述方程式b.②已知二苯胺磺酸钠还原态为无色,氧化态为紫色,则滴定达到终点的现象是 .③若实验前称取22.6gSnCl2·2H2O晶体于烧瓶中,实验结束后,向烧瓶内残留物中通入足量N2,取烧瓶内残留物溶于水配成250mL溶液,取25mL于锥形瓶中,用以上方法滴定,消耗0.0100mol/LK2Cr2O7标准溶液20.00mL,则SnCl4产率的最大值为 .