- 203.82 KB
- 2022-07-17 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
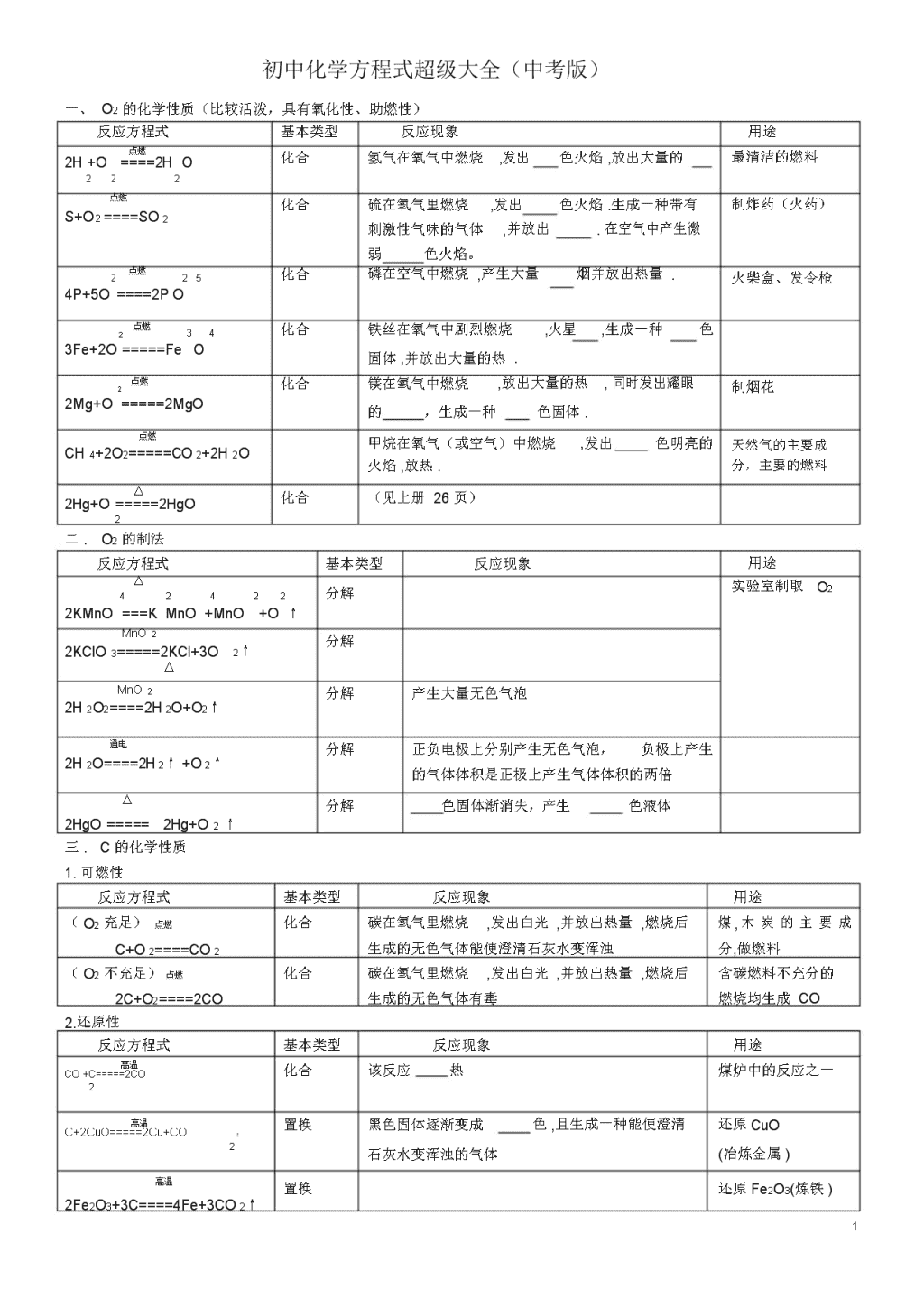
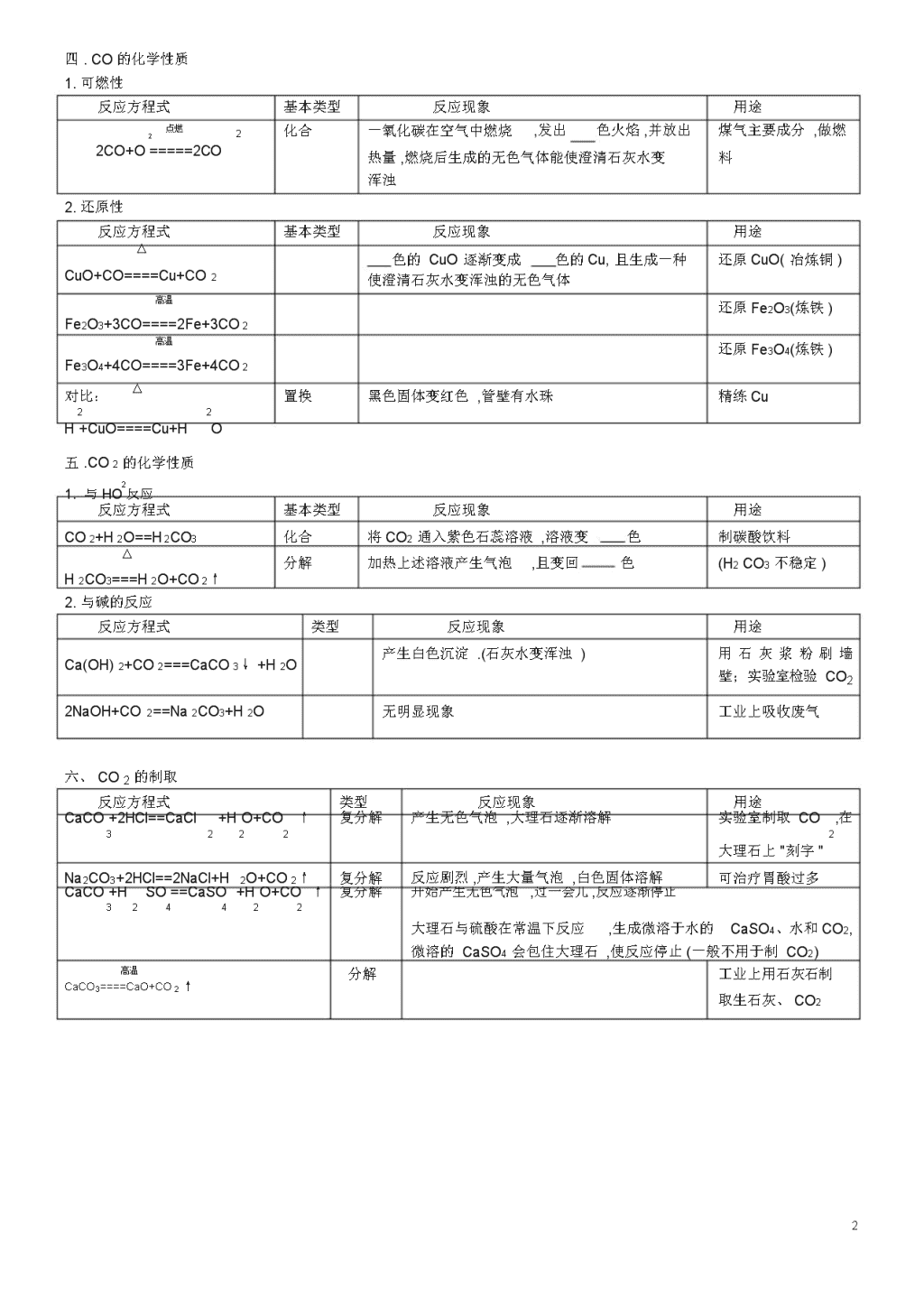
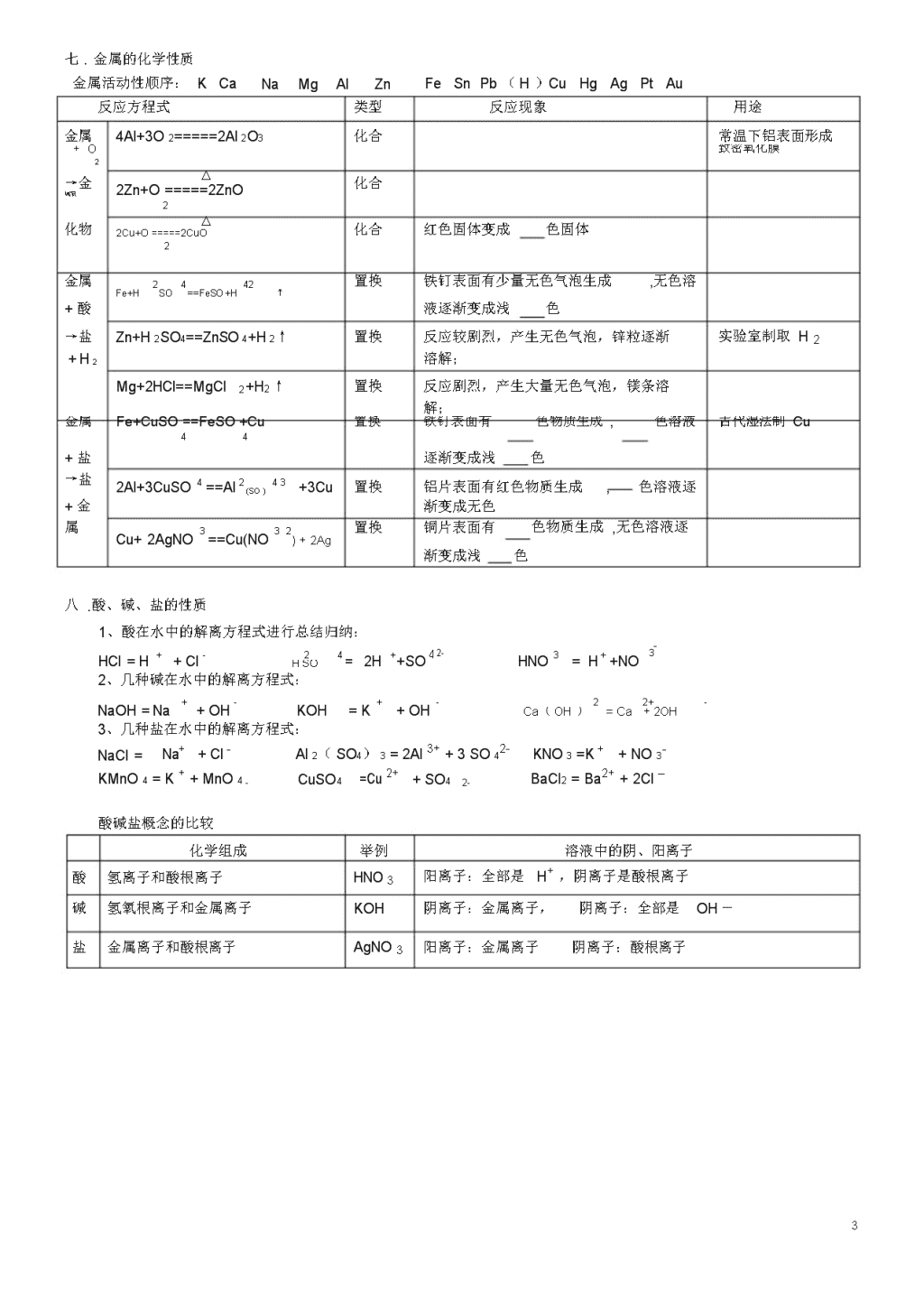
初中化学方程式超级大全(中考版)一、O2的化学性质(比较活泼,具有氧化性、助燃性)反应方程式基本类型反应现象点燃化合氢气在氧气中燃烧,发出色火焰,放出大量的2H+O====2HO222点燃化合硫在氧气里燃烧,发出色火焰.生成一种带有S+O2====SO2刺激性气味的气体,并放出.在空气中产生微弱色火焰。2点燃25化合磷在空气中燃烧,产生大量烟并放出热量.4P+5O====2PO点燃34化合铁丝在氧气中剧烈燃烧,火星,生成一种色2O3Fe+2O=====Fe固体,并放出大量的热.点燃化合镁在氧气中燃烧,放出大量的热,同时发出耀眼22Mg+O=====2MgO的,生成一种色固体.点燃甲烷在氧气(或空气)中燃烧,发出色明亮的CH4+2O2=====CO2+2H2O火焰,放热.△化合(见上册26页)2Hg+O=====2HgO2二.O2的制法反应方程式基本类型反应现象△分解42422↑2KMnO===KMnO+MnO+OMnO2分解2KClO3=====2KCl+3O2↑△MnO2分解产生大量无色气泡2H2O2====2H2O+O2↑通电分解正负电极上分别产生无色气泡,负极上产生2H2O====2H2↑+O2↑的气体体积是正极上产生气体体积的两倍△分解色固体渐消失,产生色液体2HgO=====2Hg+O2↑三.C的化学性质用途最清洁的燃料制炸药(火药)火柴盒、发令枪制烟花天然气的主要成分,主要的燃料用途实验室制取O21.可燃性反应方程式基本类型反应现象用途(O2充足)点燃化合碳在氧气里燃烧,发出白光,并放出热量,燃烧后煤,木炭的主要成C+O2====CO2生成的无色气体能使澄清石灰水变浑浊分,做燃料(O2不充足)点燃化合碳在氧气里燃烧,发出白光,并放出热量,燃烧后含碳燃料不充分的2C+O2====2CO生成的无色气体有毒燃烧均生成CO2.还原性反应方程式基本类型反应现象用途高温化合该反应热煤炉中的反应之一CO+C=====2CO2高温置换黑色固体逐渐变成色,且生成一种能使澄清还原CuOC+2CuO=====2Cu+CO↑2石灰水变浑浊的气体(冶炼金属)高温置换还原Fe2O3(炼铁)2Fe2O3+3C====4Fe+3CO2↑1\n四.CO的化学性质1.可燃性反应方程式基本类型反应现象用途点燃2化合一氧化碳在空气中燃烧,发出色火焰,并放出煤气主要成分,做燃22CO+O=====2CO热量,燃烧后生成的无色气体能使澄清石灰水变料浑浊2.还原性反应方程式基本类型反应现象用途△色的CuO逐渐变成色的Cu,且生成一种还原CuO(冶炼铜)CuO+CO====Cu+CO2使澄清石灰水变浑浊的无色气体高温还原Fe2O3(炼铁)Fe2O3+3CO====2Fe+3CO2高温还原Fe3O4(炼铁)Fe3O4+4CO====3Fe+4CO2对比:△置换黑色固体变红色,管壁有水珠精练Cu22H+CuO====Cu+HO五.CO2的化学性质21.与HO反应反应方程式基本类型反应现象用途CO2+H2O==H2CO3化合将CO2通入紫色石蕊溶液,溶液变色制碳酸饮料△分解加热上述溶液产生气泡,且变回色(H2CO3不稳定)H2CO3===H2O+CO2↑2.与碱的反应反应方程式类型反应现象用途Ca(OH)2+CO2===CaCO3↓+H2O产生白色沉淀.(石灰水变浑浊)用石灰浆粉刷墙壁;实验室检验CO22NaOH+CO2==Na2CO3+H2O无明显现象工业上吸收废气六、CO2的制取反应方程式类型反应现象用途CaCO+2HCl==CaCl2+HO+CO↑复分解产生无色气泡,大理石逐渐溶解实验室制取CO,在3222大理石上"刻字"Na2CO3+2HCl==2NaCl+H2O+CO2↑复分解反应剧烈,产生大量气泡,白色固体溶解可治疗胃酸过多CaCO+HSO==CaSO+HO+CO↑复分解开始产生无色气泡,过一会儿,反应逐渐停止324422大理石与硫酸在常温下反应,生成微溶于水的CaSO4、水和CO2,微溶的CaSO4会包住大理石,使反应停止(一般不用于制CO2)高温分解工业上用石灰石制CaCO3====CaO+CO2↑取生石灰、CO22\n七.金属的化学性质金属活动性顺序:KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu反应方程式类型反应现象用途金属4Al+3O2=====2Al2O3化合常温下铝表面形成+O致密氧化膜2→金△化合2Zn+O=====2ZnO属氧2化物△化合红色固体变成色固体2Cu+O=====2CuO2金属2442置换铁钉表面有少量无色气泡生成,无色溶Fe+HSO==FeSO+H↑+酸液逐渐变成浅色→盐Zn+H2SO4==ZnSO4+H2↑置换反应较剧烈,产生无色气泡,锌粒逐渐实验室制取H2+H2溶解;Mg+2HCl==MgCl2+H2↑置换反应剧烈,产生大量无色气泡,镁条溶解;金属Fe+CuSO==FeSO+Cu置换铁钉表面有色物质生成,色溶液古代湿法制Cu44+盐逐渐变成浅色→盐2Al+3CuSO4==Al243+3Cu置换铝片表面有红色物质生成,色溶液逐(SO)+金渐变成无色属Cu+2AgNO3==Cu(NO32置换铜片表面有色物质生成,无色溶液逐)+2Ag渐变成浅色八.酸、碱、盐的性质1、酸在水中的解离方程式进行总结归纳:HCl=H++Cl-24=2H++SO42-HNO3=H++NO3-HSO2、几种碱在水中的解离方程式:NaOH=Na++OH-KOH=K++OH-22+-Ca(OH)=Ca+2OH3、几种盐在水中的解离方程式:NaCl=Na++Cl-Al2(SO4)3=2Al3++3SO42-KNO3=K++NO3-KMnO4=K++MnO4-CuSO4=Cu2++SO42-BaCl2=Ba2++2Cl–酸碱盐概念的比较化学组成举例溶液中的阴、阳离子酸氢离子和酸根离子HNO3阳离子:全部是H+,阴离子是酸根离子碱氢氧根离子和金属离子KOH阴离子:金属离子,阴离子:全部是OH—盐金属离子和酸根离子AgNO3阳离子:金属离子阴离子:酸根离子3\n附表1稀硫酸的化学性质(稀盐酸相似)实验内容实验现象实验结论(或化学方程式,注明基本类型)......跟指示剂反应1、紫色石蕊试液1、试液显色1、紫色石蕊遇酸溶液2、无色酚酞试液试液显色2、无色酚酞遇酸溶液跟金属反应1、反应剧烈,产生,镁条溶解;Mg+H2SO4=MgSO4+H2↑1、镁条2、锌粒2、反应较剧烈,产生,锌粒逐渐24=ZnSO4+H2↑Zn+HSO溶解;3、铁钉3、铁钉表面有少量,溶液逐渐变为色Fe+H2442SO=FeSO+H↑跟金属氧化物反应1、铁锈(除铁锈)1、铁钉表面的锈逐渐溶解,溶液显色Fe2O3+3H2SO4=Fe2(SO4)3+3H2O2、氧化铜2、黑色固体溶解,溶液显色CuO+H2SO4=CuSO4+H2O跟碱反应Cu(OH)蓝色固体慢慢溶解,溶液显色224422Cu(OH)+HSO=CuSO+2HO跟盐反应1、BaCl2溶液1、生成1、BaCl2+H2SO4=BaSO4↓+2HCl2、Na2CO3固体2、固体溶解,产生大量2、Na2CO3+H2SO4=Na2SO4+H2O+CO2↑附表2盐酸与硫酸的性质比较表项目盐酸硫酸名称化学式HClH2SO4颜色,气味浓HCl无色、有性气味浓H2SO4无色无味挥发性浓HCl易挥发(在空气中形成)不挥发。有性、性与指示剂作用紫色石蕊变紫色石蕊变无色酚酞无色酚酞与活泼金属反应Zn+2HCl=ZnCl2+H2↑2442↑Fe+HSO=FeSO+H(练习书写化学方Mg+2HCl==MgCl2+H2↑2Al+3H2SO4==Al2(SO4)3+3H2↑程式,并注明基本类型,下同)与金属氧化物反应CuO+2HCl=CuCl2+H2OOAl2O3+3H2SO4=Al2(SO4)3+3H2OFeO+6HCl==2FeCl3+3H2ZnO+H2SO==ZnSO+HO23442与碱的反应NaOH+HCl=NaCl+H2OCa(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+2HCl==MgCl2+2H2O2Fe(OH)3+3H2SO4==Fe2(SO4)3+6H2O与某些盐反应AgNO3+HCl=AgCl↓+HNO3Ba(NO3)2+H2SO4=BaSO4↓+2HNO3CaCO+2HCl=CaCl2+HO+CO↑KCO3+H2SO=K2SO+HO+CO↑32224422NaHCO+HCl=NaCl+H223O+CO↑鉴别试剂AgNO3溶液和稀HNO3BaCl2溶液或Ba(NO3)2溶液和稀HNO34\n附表3氢氧化钠的化学性质实验步骤实验现象实验结论(或化学方程式)1、与指示剂的反应紫色石蕊试液变色氢氧化钠溶液使紫色石蕊试液变色,无色酚酞试液变色氢氧化钠溶液使无色酚酞试液变色2、与非金属氧化物反应1、1、①氢氧化钠与二氧化碳2、2、②氢氧化钙溶液与二氧化碳3、与盐溶液的反应1、产生色沉淀1、CuSO4+2NaOH==Cu(OH)2↓+Na2SO4①氢氧化钠溶液与硫酸铜溶液2、产生色沉淀2、FeCl3+3NaOH==Fe(OH)3↓+3NaCl3、Ca(OH)+NaCO==CaCO↓+2NaOH②氢氧化钠溶液与氯化铁溶液3、产生色沉淀22334、CuSO+Ba(OH)==Cu(OH)↓+BaSO↓4224③氢氧化钙溶液与碳酸钠溶液4、产生蓝、白色沉淀④氢氧化钡溶液与硫酸铜溶液附表4氢氧化钠与氢氧化钙的性质比较表用途氢氧化钠氢氧化钙性质化学式NaOH俗名烧碱火碱苛性钠物理性质1、白色固体2、具有吸水性(易潮解)3、极易溶于水,放热4、具有强腐蚀性工业制法Ca(OH)2+Na2CO3=CaCO3↓+2NaOH(纯碱)化学性质1、使紫色石蕊试液变蓝色,使无色酚酞试液变红色2、与某些非金属氧化物反应2NaOH+CO2=Na2CO3+H2O2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2O(工业上吸收废气)3、与酸反应NaOH+HCl=NaCl+H2O2NaOH+H2SO4==Na2SO4+2H2ONaOH+HNO3==NaNO3+H2O4、与某些盐反应2NaOH+CuSO4=Cu(OH)2↓+Na2SO4MgCl2+2NaOH==Mg(OH)2↓+2NaClZn(NO3)2+2NaOH==Zn(OH)2↓+2NaNO3Ca(OH)2熟石灰消石灰1、白色固体2、微溶于水3、具有腐蚀性高温CaCO3=====CaO+、CO2↑CaO+H2O==Ca(OH)(2剧烈反应,放出大量热,白色块状固体变成粉末)1、使紫色石蕊试液变蓝色,使无色酚酞试液变红色2、与某些非金属氧化物反应Ca(OH)2+CO2=CaCO3↓+H2O(用于鉴别CO2气体)3、与酸反应(用于中和土壤酸性)Ca(OH)2+H2SO4=CaSO4+2H2OCa(OH)2+2HCl==CaCl2+2H2OCa(OH)2+H2SO4==CaSO4+2H2O4、与某些盐反应Ca(OH)2+Na2CO3=CaCO3↓+2NaOHCa(OH)2+CuSO4=Cu(OH)2↓+CaSO4(波尔多液的制取)Ca(OH)2+K2CO3=CaCO3↓+2KOH5\n△盐的化学性质(1、2、3见上述内容)1、盐溶液+金属→新盐+新金属2、盐+酸→新盐+新酸3、盐+碱→新盐+新碱4、盐+盐→两种新盐例:CuSO4+BaCl2=BaSO4↓+CuCl2AgNO3+NaCl=AgCl↓+NaNO3NaCO+CaCl=2NaCl+CaCO↓KCO+Ba(NO)=2KNO3+BaCO↓232323323初中化学全册方程式网络图一、氧系网络①②③④⑤⑥⑦⑧⑨⑩6\n⑾⑿⒀⒁⒂二、碳系网络⑴可燃性还原性⑵可燃性还原性⑶可燃性还原性⑷⑸7\n⑹⑺⑻实验室制二氧化碳工业制二氧化碳⑼⑽⑾⑿三、金属、酸、碱、盐系网络(一)、复分解反应(有五类、见上图①②③④⑤)①酸+金属氧化物→盐+水②酸+碱→盐+水8\n③酸+盐→酸+盐④盐+碱→盐+碱⑤盐+盐→盐+盐(二)金属和酸、盐溶液的置换反应(见上图⑥⑦)⑥金属+酸→盐+氢气⑦金属+盐→金属+盐(三)金属氧化物制碱的反应(见上图⑧Na2O、K2O、BaO、CaO分别和水反应)⑧金属氧化物+水→碱(四)非金属氧化物制取酸(见上图⑨CO2、SO2、SO3分别和水反应)⑨非金属氧化物+水→酸9\n(五)碱溶液和金属氧化物反应(见上图⑩)⑩碱溶液+非金属氧化物→盐+水(六)还原剂还原金属氧化物(见上图⑾)巧记初中化学全册方程式反应类型化合反应单+单单+化化+化分解反应氧化物酸碱盐置换反应金属+酸金属+盐金属氧化物+还原性单质复分解反应酸+金属氧化物酸+碱盐+酸盐+碱盐+盐非四大一氧化碳做还原剂反应类型二氧化碳和可溶性碱有机物的燃烧反应类型化合反应巧记内容P、S、H2、C、Fe、Cu、Mg、Al的完全燃烧,C的不完全燃烧CO的燃烧、高温CO2和木炭反应得COCO2、SO2、SO3或CaO、K2O、Na2O、BaO与水反应得对应酸碱H2O、H2O2分解H2CO3分解不溶性碱Cu(OH)2、Fe(OH)3分解KMnO4、KClO3、CaCO3分解金属活动性在H前,酸一般用稀H2SO4、稀HCl遵守金属活动性前置后,盐可溶常见CuO、Fe2O3和H2、C反应酸+金属氧化物→盐+H2O酸+碱→盐+H2O盐+酸→盐+酸(盐不能用BaSO4、AgCl)盐+碱→盐+碱(反应物必须全溶)盐+盐→盐+盐(反应物必须全溶)常见CuO、Fe2O3和CO反应常见CO2和Ca(OH)2、NaOH反应常见CH4的燃烧写出以上反应的化学方程式记忆化学方程式单+单P+S+10\nH2+C+C+Fe+Cu+Mg+Al+单+化(全书共2个)CO+CO+2化+化CO+2SO+2SO+3CaO+K2O+Na2O+BaO+分解反应氧化物分解2——HO22——HO酸分解HCO——23不溶性碱分解Cu(OH)2——Fe(OH)3——盐分解KMnO4——KClO3——CaCO——3置换反应1、金属+酸Zn+(金属活动顺序表)Fe+2、金属+盐(可溶)Cu+Fe+3、金属氧化物+单质还原剂CuO+Fe2O3+复分解反应1、酸+金属氧化物CuO+Fe2O3+(反应条件为生成物有H2O、↑、2、酸+碱NaOH+↓)(中和反应)Cu(OH)2+3、盐+酸CaCO+不参加复分解反应的四个物质分3(盐必须溶于酸)BaCO3+别为:NaHCO3+AgNO3+BaCl2+4、盐+碱CuSO+Ba(OH)42(反应物全溶)5、盐+盐(反应物全溶)11\n非四大反应类型一氧化碳做还原剂CuO+23+FeO二氧化碳+可溶性碱CO2+2+COCO2+CO2+有机物燃烧CH+412