- 672.50 KB
- 2022-07-19 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
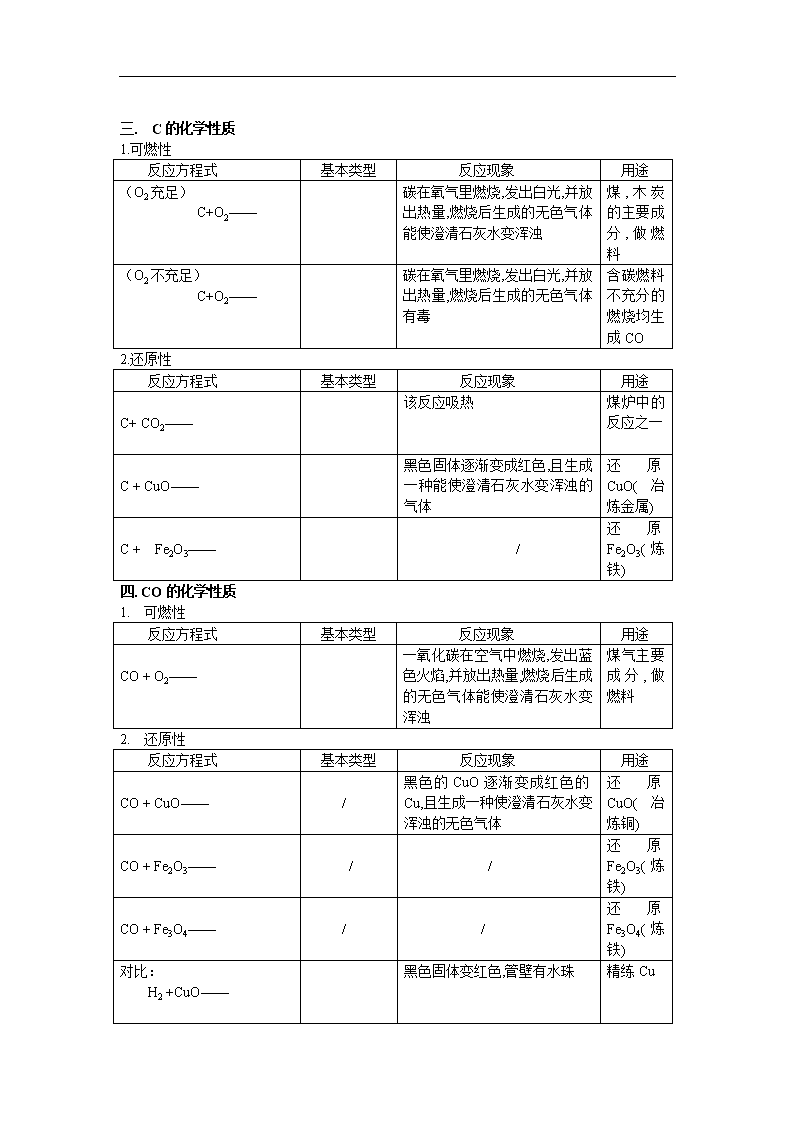
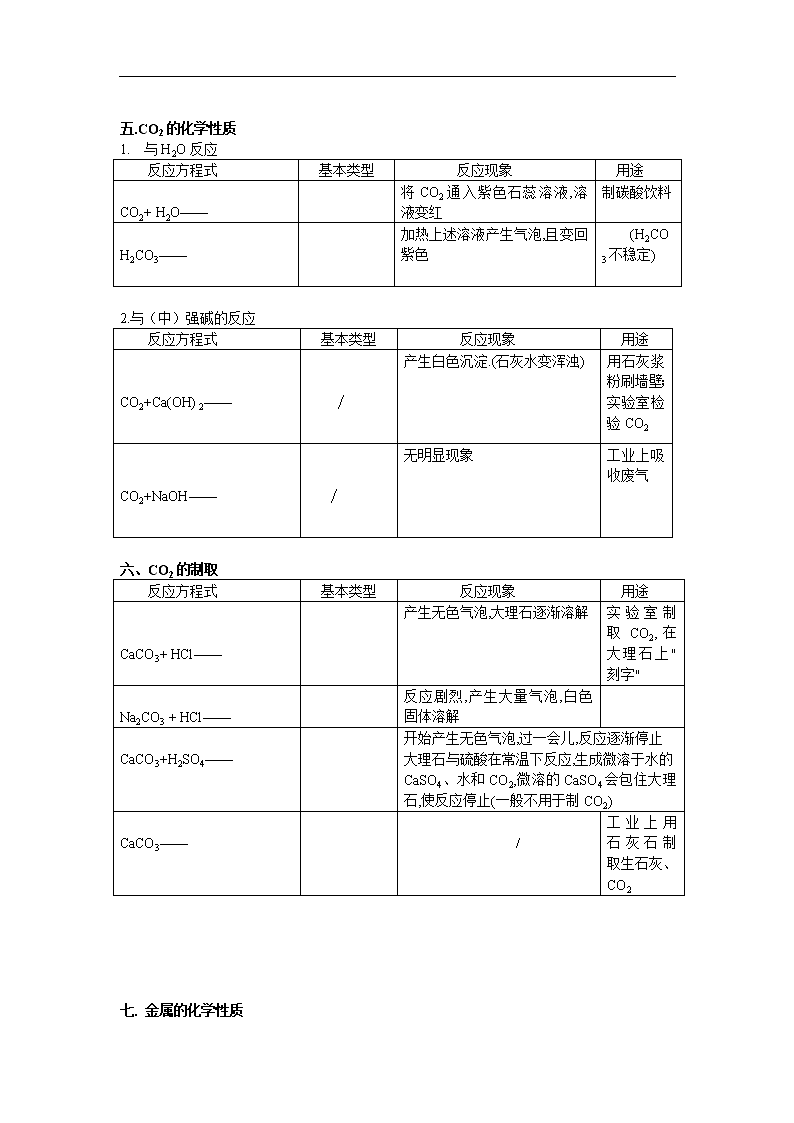
中考复习归纳初中化学方程式请完成下列化学方程式,并注明反应基本类型:一、O2的化学性质(氧化性、可以助燃)反应方程式反应基本类型反应现象用途H2+O2——氢气在氧气中燃烧,发出淡蓝色火焰,放出大量的热,生成水H2是最清洁的燃料S+O2——硫在氧气里燃烧,发出蓝紫色火焰.生成一种带有刺激性气味的气体,并放出热量.在空气中产生微弱蓝紫色火焰。制炸药(火药)P+O2——磷在空气中燃烧,产生大量白烟并放出热量.火柴盒、发令枪Fe+O2——铁丝在氧气中剧烈燃烧,火星四射,生成一种黑色固体,并放出大量的热./Mg+O2——镁在氧气中燃烧,放出大量的热,同时发出耀眼的白光.生成一种白色固体.制烟花CH4+O2——/甲烷在氧气(或空气)中燃烧,发出蓝色明亮的火焰,放热.天然气的主要成分,主要的燃料Hg+O2——(见上册26页)/二.O2的制法反应方程式基本类型反应现象用途KMnO4——/实验室制取O2KClO3——/H2O2——产生大量无色气泡H2O——正负电极上分别产生无色气泡.负极上产生的气体体积是正极上产生气体体积的两倍/HgO——红色固体渐消失,产生银色液体/\n三.C的化学性质1.可燃性反应方程式基本类型反应现象用途(O2充足)C+O2——碳在氧气里燃烧,发出白光,并放出热量,燃烧后生成的无色气体能使澄清石灰水变浑浊煤,木炭的主要成分,做燃料(O2不充足)C+O2——碳在氧气里燃烧,发出白光,并放出热量,燃烧后生成的无色气体有毒含碳燃料不充分的燃烧均生成CO2.还原性反应方程式基本类型反应现象用途C+CO2——该反应吸热煤炉中的反应之一C+CuO——黑色固体逐渐变成红色,且生成一种能使澄清石灰水变浑浊的气体还原CuO(冶炼金属)C+Fe2O3——/还原Fe2O3(炼铁)四.CO的化学性质1.可燃性反应方程式基本类型反应现象用途CO+O2——一氧化碳在空气中燃烧,发出蓝色火焰,并放出热量,燃烧后生成的无色气体能使澄清石灰水变浑浊煤气主要成分,做燃料2.还原性反应方程式基本类型反应现象用途CO+CuO——/黑色的CuO逐渐变成红色的Cu,且生成一种使澄清石灰水变浑浊的无色气体还原CuO(冶炼铜)CO+Fe2O3——//还原Fe2O3(炼铁)CO+Fe3O4——//还原Fe3O4(炼铁)对比:H2+CuO——黑色固体变红色,管壁有水珠精练Cu\n五.CO2的化学性质1.与H2O反应反应方程式基本类型反应现象用途CO2+H2O——将CO2通入紫色石蕊溶液,溶液变红制碳酸饮料H2CO3——加热上述溶液产生气泡,且变回紫色(H2CO3不稳定)2.与(中)强碱的反应反应方程式基本类型反应现象用途CO2+Ca(OH)2——∕产生白色沉淀.(石灰水变浑浊)用石灰浆粉刷墙壁;实验室检验CO2CO2+NaOH——∕无明显现象工业上吸收废气六、CO2的制取反应方程式基本类型反应现象用途CaCO3+HCl——产生无色气泡,大理石逐渐溶解实验室制取CO2,在大理石上"刻字"Na2CO3+HCl——反应剧烈,产生大量气泡,白色固体溶解CaCO3+H2SO4——开始产生无色气泡,过一会儿,反应逐渐停止大理石与硫酸在常温下反应,生成微溶于水的CaSO4、水和CO2,微溶的CaSO4会包住大理石,使反应停止(一般不用于制CO2)CaCO3——/工业上用石灰石制取生石灰、CO2七.金属的化学性质\n金属活动性顺序:)反应方程式基本类型反应现象用途金属+O2→金属氧化物Al+O2——∕常温下铝表面形成致密氧化膜Zn+O2——∕/Cu+O2——红色固体变成黑色固体/金属+酸→盐+H2Fe+H2SO4——/Zn+H2SO4——Mg+HCl——/金属+盐→盐+金属Fe+CuSO4——铁钉表面有红色物质生成,蓝色溶液逐渐变成浅绿色古代湿法制CuAl+CuSO4——/Cu+AgNO3——/八.酸、碱、盐的性质1、酸在水中的解离方程式进行总结归纳:HCl=H++Cl-H2SO4=2H++SO42-HNO3=H++NO3-2、几种碱在水中的解离方程式:NaOH=Na++OH-KOH=K++OH-Ca(OH)2=Ca2++2OH-3、几种盐在水中的解离方程式:NaCl=Na++Cl-Al2(SO4)3=KNO3=K++NO3-KMnO4=CuSO4=Cu2++SO42-BaCl2=酸碱盐概念的比较化学组成举例溶液中的阴、阳离子酸氢离子和酸根离子HNO3阳离子:全部是H+,阴离子是酸根离子碱氢氧根离子和金属离子KOH阴离子:金属离子,阴离子:全部是OH——盐金属离子和酸根离子AgNO3阳离子:金属离子阴离子:酸根离子附表1稀硫酸的化学性质(稀盐酸相似)\n实验内容实验现象实验结论(或化学方程式,注明基本类型)跟指示剂反应1、紫色石蕊试液2、无色酚酞试液1、试液显()色2、试液显()色1、紫色石蕊遇酸溶液()2、无色酚酞遇酸溶液()跟金属反应1、镁条2、锌粒3、铁钉1、反应剧烈,产生(),镁条溶解;2、反应较剧烈,产生(),锌粒逐渐溶解;3、铁钉表面有少量(),溶液逐渐变为()色Mg+H2SO4=MgSO4+H2↑Zn+H2SO4=ZnSO4+H2↑Fe+H2SO4=FeSO4+H2↑跟金属氧化物反应1、铁锈(除铁锈)2、氧化铜1、铁钉表面的锈逐渐溶解,溶液显()色2、黑色固体溶解,溶液显()色Fe2O3+3H2SO4=Fe2(SO4)3+3H2OCuO+H2SO4=CuSO4+H2O跟碱反应Cu(OH)2蓝色固体慢慢溶解,溶液显()色Cu(OH)2+H2SO4=CuSO4+2H2O跟盐反应1、BaCl2溶液2、Na2CO3固体1、生成()2、固体溶解,产生大量()1、BaCl2+H2SO4=BaSO4↓+2HCl2、Na2CO3+H2SO4=Na2SO4+H2O+CO2↑附表2盐酸与硫酸的性质比较表项目名称盐酸硫酸化学式HClH2SO4颜色,气味浓HCl无色、有刺激性气味浓H2SO4无色无味挥发性浓HCl易挥发(在空气中形成白雾)不挥发 。有吸水性、脱水性与指示剂作用 紫色石蕊变红无色酚酞不变色紫色石蕊变红无色酚酞不变色与活泼金属反应(练习书写化学方程式,并注明基本类型,下同)Zn+2HCl=ZnCl2+H2↑Fe+H2SO4=FeSO4+H2↑与金属氧化物反应CuO+2HCl=CuCl2+H2OAl2O3+3H2SO4=Al2(SO4)3+3H2O与碱的反应NaOH+HCl=NaCl+H2O Ca(OH)2+H2SO4=CaSO4+2H2O\n与某些盐反应AgNO3+HCl=AgCl↓+HNO3CaCO3+2HCl=CaCl2+H2O+CO2↑NaHCO3+HCl=NaCl+H2O+CO2↑Ba(NO3)2+H2SO4=BaSO4↓+2HNO3K2CO3+H2SO4=K2SO4+H2O+CO2↑鉴别试剂AgNO3溶液和稀HNO3BaCl2溶液或Ba(NO3)2溶液和稀HNO3附表3氢氧化钠的化学性质实验步骤实验现象实验结论(或化学方程式)1、与指示剂的反应紫色石蕊试液变()色无色酚酞试液变()色氢氧化钠溶液使紫色石蕊试液变()色,氢氧化钠溶液使无色酚酞试液变()色2、与盐溶液的反应12341、产生()色沉淀2、产生()色沉淀3、产生()色沉淀4、产生()色沉淀化学方程式1、2、3、4、\n附表4氢氧化钠与氢氧化钙的性质比较表用途性质氢氧化钠氢氧化钙化学式NaOHCa(OH)2俗名烧碱火碱苛性钠熟石灰消石灰物理性质1、白色固体2、具有吸水性(易潮解)3、极易溶于水,放热4、具有强腐蚀性1、白色固体2、微溶于水3、具有腐蚀性工业制法Ca(OH)2+Na2CO3=CaCO3↓+2NaOH(纯碱)高温CaCO3=====CaO+、CO2↑CaO+H2O==Ca(OH)2(剧烈反应,放出大量热,白色块状固体变成粉末)化学性质1、使紫色石蕊试液变蓝色,使无色酚酞试液变红色2、与某些非金属氧化物反应2NaOH+CO2=Na2CO3+H2O2NaOH+SO2=Na2SO3+H2O2NaOH+SO3=Na2SO4+H2O(工业上吸收废气)3、与酸反应NaOH+HCl=NaCl+H2O4、与某些盐反应2NaOH+CuSO4=Cu(OH)2↓+Na2SO41、使紫色石蕊试液变蓝色,使无色酚酞试液变红色2、与某些非金属氧化物反应Ca(OH)2+CO2=CaCO3↓+H2O(用于鉴别CO2气体)3、与酸反应(用于中和土壤酸性)Ca(OH)2+H2SO4=CaSO4+2H2O4、与某些盐反应Ca(OH)2+Na2CO3=CaCO3↓+Na2CO3△盐的化学性质(1、2、3见上述内容)1、盐溶液+金属→新盐+新金属2、盐+酸→新盐+新酸3、盐+碱→新盐+新碱4、盐+盐→两种新盐例:CuSO4+BaCl2=,AgNO3+NaCl=,Na2CO3+CaCl2=,K2CO3+Ba(NO3)2=