- 636.01 KB
- 2022-07-20 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
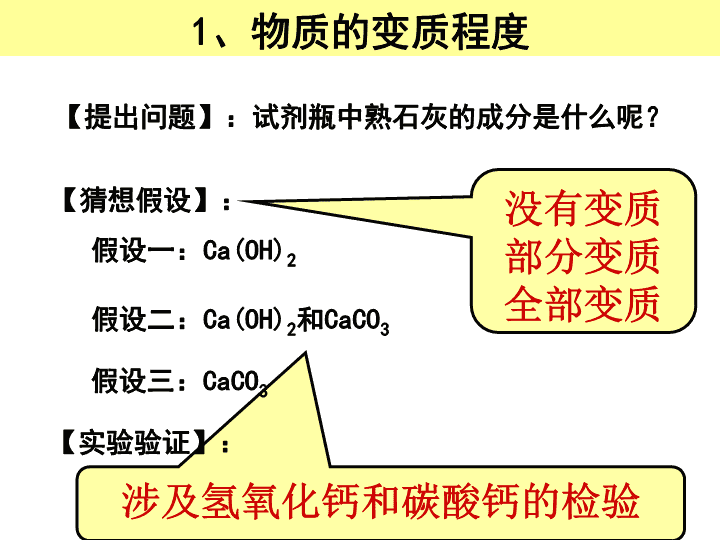
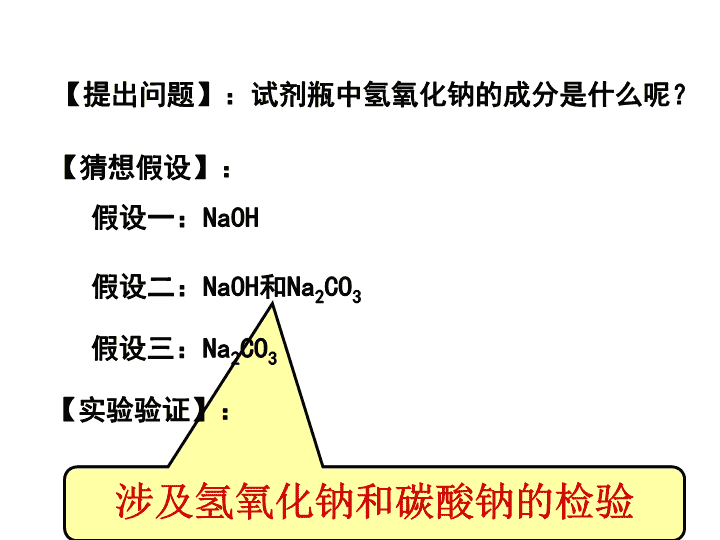
实验探究\n【提出问题】:试剂瓶中熟石灰的成分是什么呢?假设一:Ca(OH)2假设二:Ca(OH)2和CaCO3【猜想假设】:1、物质的变质程度涉及氢氧化钙和碳酸钙的检验【实验验证】:假设三:CaCO3没有变质部分变质全部变质\n【提出问题】:试剂瓶中氢氧化钠的成分是什么呢?假设一:NaOH假设二:NaOH和Na2CO3【猜想假设】:涉及氢氧化钠和碳酸钠的检验【实验验证】:假设三:Na2CO3\n【提出问题】从食品包装中取出的双吸剂的成分。【猜想假设】假设一:可能是Fe;假设二:可能是Fe和Fe2O3的混合物;假设三:可能是Fe2O3。涉及铁和氧化铁的检验检验【实验验证】\n【提出问题】如图所示,在空气放置一段时间的干燥剂的的成分。【猜想假设】CaOCaCO3Ca(OH)2涉及氧化钙、氢氧化钙、碳酸钙的检验【实验验证】\n由以上例题的分析可以看出,其实探究就是利用物质之间性质的差异性进行的复杂的鉴别\n1、二氧化碳和水2、二氧化碳和氢氧化钠3、氢氧化钠和盐酸2、反应无明显现象,探究反应的发生\n2、二氧化碳和氢氧化钠①利用特殊装置作对比试验\n2、二氧化碳和氢氧化钠②验证生成物稀盐酸(过量);氢氧化钙溶液;氯化钙溶液①利用特殊装置作对比试验\n3、氢氧化钠和盐酸①酚酞②测pH③测2~3次温度(利用酸碱中和均放热)\n1、指示剂或测pH(适用于反应前后酸碱性发生改变的)2、设计特殊装置进行对比试验(适用于有气体参与的,反应前后产生压强差的)3、验证反应物的消耗或有新物质生成(适用于反应物和生成物发生化学变化时有不同的现象)4、测温度若两种物质混合无现象,证明是否发生反应的思路(适用于有明显温度改变的)\n在中学所学的化学反应中,有很多反应没有明显现象.某探究小组想通过实验来证明某些无现象的反应确实发生了,他们做了以下探究过程.Ⅰ.对NaOH溶液与盐酸反应的探究
甲同学按如图所示的装置验证NaOH与盐酸发生反应,结果甲同学根本就看不到酚酞试液由红色逐渐变为无色的过程,原因是_________________,如果要想证明盐酸与NaOH发生反应,则实验应改为__________________.盐酸过量逐滴滴加稀盐酸\nⅡ,对CO2与NaOH溶液反应的探究【查阅资料】通常状况下,1体积水能溶解1体积二氧化碳.【设计实验】甲同学设计了三个实验进行验证,请你帮他完成下列实验报告.实验操作实验现象结论及解释①氢氧化钠溶液可以与CO2反应.
反应的化学方程式为:______②____________氢氧化钠溶液可以与CO2反应.CO2+2NaOH═Na2CO3+H2O气球膨胀\n实验操作实验现象结论及解释③洗气瓶中的溶液均为氢氧化钠溶液或澄清石灰水(均为200mL)A,B均无明显变化氢氧化钠溶液可以与CO2反应.B中盛放的溶液是______.澄清石灰水【反思交流】(1)实验①由于甲同学选用的仪器不当,导致未能观察到明显现象,乙同学将甲同学的广口瓶替换成,看到了现象,证明CO2可以与NaOH溶液反应.丙同学认为乙同学的改进实验仍然存在缺陷,应增加一个对比实验,证明CO2确实可以与NaOH溶液发生反应,该对比实验所用的试剂是.(2)请判断③中V200mL(填“>”、“<”或“=”),理由是.【实验结论】通过实验探究,证明了氢氧化钠溶液可以与二氧化碳反应.软塑料瓶瓶子变瘪水和二氧化碳>当V≤200mL时,二氧化碳完全溶于水中也会产生同样现象\n3、反应后废液成分的探究\n反应后废液的成分是什么?\n方法总结:恰好反应---只有生成物。过量反应---生成物和过量反应物情况一情况二生成物一定有反应物可能余\n反应后废液的成分是什么?氢氧化钠溶液氢氧化钠和碳酸钠的混合溶液氢氧化钠和氢氧化钙的混合溶液肯定有的是可溶性的生成物可能有的是可溶性反应物之一\n废液中含有哪些物质呢?\n甲同学乙同学实验后,乙同学将除去沉淀后的废液倒入烧杯中,然后甲同学也将废液缓慢倒入同一个烧杯中,发现烧杯中开始没有现象,随后产生气泡。问题1:根据上述现象推断,甲、乙两同学的试管中的废液所含溶质是什么\n甲同学乙同学问题1:甲、乙两同学的试管中的废液所含溶质是什么问题3:如何验证你的猜想问题2:最终废液中的溶质可能是什么?实验步骤实验现象结论甲:NaClHCl乙:NaOHNa2CO3猜想1:NaCl猜想2:NaClHCl猜想3:NaClNa2CO3肯定有的是未参与反应的可溶性物质在熟知物质的性质的基础上,利用物质的差异性进行的鉴别\n如何处理?测得废液pH=2\n3、多个反应混合后溶液成分的分析实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,看到废液浑浊并呈红色,可知废液中含有能使废液呈碱性的物质。思维过程:1、写方程式得知反应后生成什么NaOH+HCl=NaCl+H2O2NaOH+CO2=Na2CO3+H2OCa(OH)2+Na2CO3=CaCO3↓+2NaOH2、根据现象判断一定有什么,一定没有什么√\n(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,看到废液浑浊并呈红色,可知废液中含有能使废液呈碱性的物质。NaOH+HCl=NaCl+H2O2NaOH+CO2=Na2CO3+H2OCa(OH)2+Na2CO3=CaCO3↓+2NaOH√实验内容实验现象实验结论取少量废液缸中的上层清液于试管中,加入过量氯化钙溶液无白色沉淀生成,溶液呈红色呈碱性的物质可能的组成成分是。思维过程:1、写方程式得知反应后生成什么2、根据现象判断一定有什么,一定没有什么只有NaOH、NaOH和Ca(OH)2√?\n多个反应混合后溶液成分的分析解题策略:1、写出单个反应方程式2、根据现象判断一定有什么一定没有什么3、追踪没有了的物质变成了什么\n当三个实验的废液倒入另一干净的废液缸中,看到废液澄清并为无色。则废液的组成成分中一定含有的是。NaOH+HCl=NaCl+H2O2NaOH+CO2=Na2CO3+H2OCa(OH)2+Na2CO3=CaCO3↓+2NaOH3、生成的碳酸钠、碳酸钙、氢氧化钠为什么都没有了?盐酸将其反应掉了!Na2CO3+2HCl=2NaCl+H2O+CO2↑NaOH+HCl=NaCl+H2OCaCO3+2HCl=CaCl2+H2O+CO2↑废液中一定有:NaCl和CaCl2可能有:HCl\n探究题注意事项1、提出有价值的问题,进行合理猜想2、设计实验的原理正确,如有对比实验的则需注意控制变量3、设计实验与前后相关联,对应猜想和结论4、评价所设计的实验可从操作是否简单安全、现象是否明显、是否环保、价格是否合理、是否节能等社会热点角度进行5、语言完整、科学规范