- 285.00 KB
- 2022-07-25 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
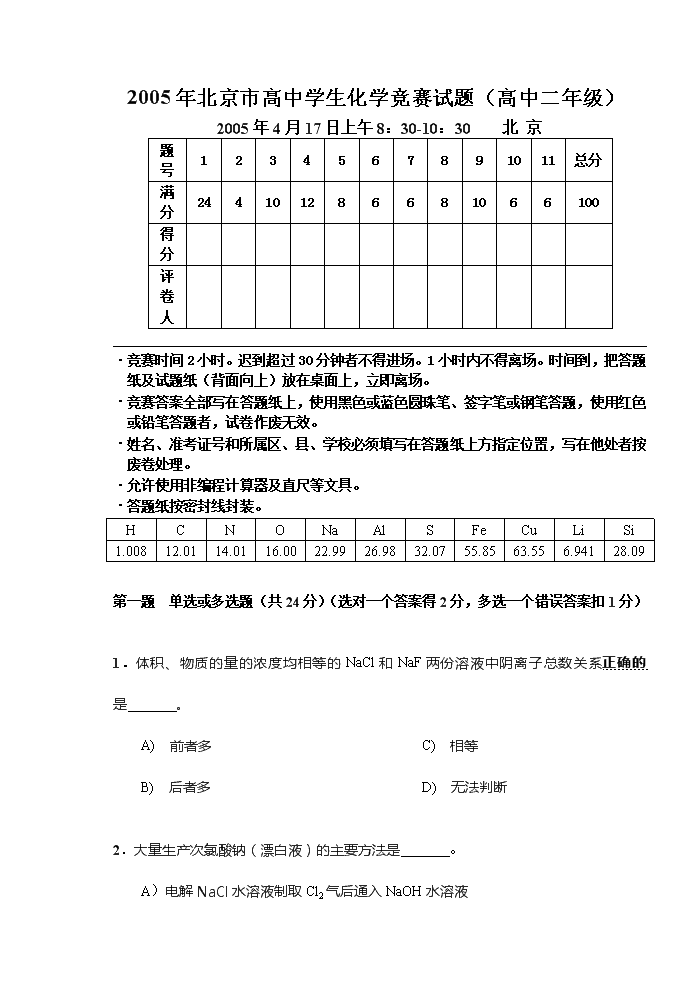
2005年北京市高中学生化学竞赛试题(高中二年级)2005年4月17日上午8:30-10:30北京题号1234567891011总分满分244101286681066100得分评卷人·竞赛时间2小时。迟到超过30分钟者不得进场。1小时内不得离场。时间到,把答题纸及试题纸(背面向上)放在桌面上,立即离场。·竞赛答案全部写在答题纸上,使用黑色或蓝色圆珠笔、签字笔或钢笔答题,使用红色或铅笔答题者,试卷作废无效。·姓名、准考证号和所属区、县、学校必须填写在答题纸上方指定位置,写在他处者按废卷处理。·允许使用非编程计算器及直尺等文具。·答题纸按密封线封装。HCNONaAlSFeCuLiSi1.00812.0114.0116.0022.9926.9832.0755.8563.556.94128.09第一题单选或多选题(共24分)(选对一个答案得2分,多选一个错误答案扣1分)1.体积、物质的量的浓度均相等的NaCl和NaF两份溶液中阴离子总数关系正确的是。A)前者多B)后者多C)相等D)无法判断2.大量生产次氯酸钠(漂白液)的主要方法是。A)电解NaCl水溶液制取Cl2气后通入NaOH水溶液\nB)电解NaCl水溶液直接得到NaClO水溶液C)浓盐酸和MnO2反应制取氯气后通入NaOH水溶液D)浓盐酸和KMnO4反应制取氯气后通入NaOH水溶液3.导电仪测得液态BrF3具有微弱的导电性,表示BrF3液体中有阴、阳离子X和Y。X和Y也存在于BrF2SbF6、KBrF4、(BrF2)2SnF6等化合物中,则下列的电离式正确的是。A)BrF3Br3++3F-B)BrF3BrF2++FC)2BrF3BrF2++BrF4-D)2BrF3BrF4-+Br3++2F-4.美国Gokel教授研制了氧化还原型电控分子开关——蒽醌套索醚电控开关。它是使冠醚“胳膊”阴离子化,从而加强对流动阳离子的束缚力,达到“关”的作用。下列说法正确的是。A)[a]过程是氧化反应B)通过[b]过程达到“开启”状态C)A为“关闭”状态D)A的分子式为C25H30O85.amol铁粉和硫粉bmol混合均匀(a¹b),隔绝空气加热充分反应。然后向反应物中加入足量稀硫酸,将产生的气体完全燃烧,消耗氧气物质的量是。A)1.5aB)a+2bC)a+2.5bD)0.5a+b6.乙醛,丙醛,环己醇()的混合液中,氢元素的质量分数为10%,则此混合物的平均摩尔质量应为。A)46.1B)52.2C)53.3D)62.47.在一恒定的容器中充入2molA和1molB发生反应:2A(g)+B(g)xC(g)\n,达到平衡后,C的体积分数为ω%,若维持容器的容积和温度不变,按起始物质的量A:0.6mol,B:0.3mol,C:1.4mol充入容器,达到平衡后,C的体积分数仍为ω%,则x值应。A)只能为1B)只能为3C)可能是1,也可能是3D)可能是2,也可能是38.已知0.1mol/LNa2CO3溶液的pH=10,0.1mol/L的NaAlO2溶液的pH=12,根据上述信息判断下列推论正确的是。A)通入适量CO2于AlO2-溶液中,有CO32-生成B)等物质的量浓度的NaHCO3和NaAlO2溶液前者pH大于后者pHC)HCO3-只能跟Al3+反应,而不能跟AlO2-反应D)NH4+、AlO2-、HCO3-不能大量共存于同一溶液中9.2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。右图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子;6个硼原子位于棱柱内。则该化合物的化学式可以表示为是。A)MgBB)MgB2C)Mg2BD)Mg3B210.准确称取6g铝土矿样品(含Al2O3、Fe2O3、SiO2),加入100mL硫酸溶液,充分反应后向滤液中加入10mol∙L-1NaOH溶液,产生沉淀的质量与加入溶液体积的关系如图右所示,则所用硫酸溶液的物质的量的浓度应该为。A)3.50mol∙L-1B)1.7mol∙L-1\nC)0.85mol∙L-1D)无法计算第二题(共4分)Li2O2和Na2O2都可用于航天飞船制造宇航员赖以生存的氧气。(A)它们在载人飞船里会自动产生氧气,并去除飞船内不需要的气体,这个过程涉及的化学方程式是:(B)载人宇航飞船的设计师宁愿用价格较贵的Li2O2而不用Na2O2获得氧气。其最主要的原因是第三题(共10分)铜无论是在化学中还是在工业、国防或日常生活中都是一种非常重要的金属。铜的化合物的颜色变化也是丰富多彩的。请从化学组成、结构和化学反应的角度来解释下列与颜色有关的现象:1.导线中的铜丝是紫红色,铜钥匙是黄色;青铜塑像是深灰色,为什么(从组成上说明)?2.硫酸铜的水溶液是浅蓝色,受热的蓝色硫酸铜晶体却变成白色粉末;3.往硫酸铜水溶液中加入足量氨水后变成蓝紫色(用反应方程式说明发生的变化);4.往硫酸铜溶液中加入KI会析出白色沉淀,而溶液由蓝色变成棕色;5.薄铜片会慢慢溶解在氯化铁(Ⅲ)溶液中,该溶液由棕色逐渐变成蓝绿色。第四题(12分)仔细研究BF3、NF3、IF3中的化学键,就这3种分子分别回答下列问题:1.画出它们的电子结构式,即用点或线标明各原子的价电子结构;\n1.推测它们的几何结构,说明在这3种分子中,键角的变化情况;2.分别说明它们是极性分子,还是非极性分子,并说明理由。第五题(共8分)RX是第二周期和第三周期两种非金属元素(1:1)化合形成的晶体。它的天然矿物称为莫瓦桑石(Moissanite),曾大量合成用作磨料,1997年,发明了它的透明单晶的合成法。用合成的莫瓦桑石透明单晶制作的首饰甚至比钻石更美丽(更显光彩、更透亮)、更轻(对比:金刚石密度3.5g/cm3,莫瓦桑石密度3.24g/cm3)、更耐火(热至1500oC不分解)、更显光彩、更透亮,价廉物美,巧夺天工,仅硬度较差,但仍是已知固体中第三种硬度最高的(对比:金刚石的硬度为10,莫瓦桑石为9.25)。RX的摩尔质量40.1g/mol,有多种不同的晶体结构,其中最常见的一种的晶胞是六方的,这种晶胞是一个平行六面体,棱长分别为a=b=3.073x10-8cm,c=15.07x10-8cm,面夹角分别为α=β=90o,γ=120o。1.写出莫瓦桑石的化学式。2.莫瓦桑石是原子晶体、分子晶体、离子晶体还是金属晶体?3.莫瓦桑石的上述晶胞里有几个原子?给出计算过程。原子数取整。\n4.如何理解莫瓦桑石的密度比金刚石小?第六题(共6分)脱除石油炼厂气中H2S的两种方法是:干法用ZnO,湿法用HOCH2CH2NH2(乙醇胺)溶液。两个反应的方程式为:乙醇胺的沸点170.8℃,和水完全互溶,碱性略强于NH3∙H2O。为什么工业上用HOCH2CH2NH2而不用NH3∙H2O脱硫(H2S)?第七题(共6分)以石墨为电极,通电电解含酚酞的KI溶液(无色)1.阴、阳极的电极反应和阴、阳极区溶液呈现的现象是:阳极电极反应式阳极区现象阳极电极反应式阳极区现象2.观察到以上现象时停止通电,摇匀电解液,恢复成(几乎)无色,为什么?\n第八题(共8分)为了利用天然气矿中的甲烷,有人设计了如下两个化学反应:2CH4(g)+H2O(l)=C2H5OH(l)+2H2(g)①CH4(g)+1/2O2(g)=CH3OH(l)②已知:298K,PΘ下物质ΔfΗΘm(kJ/mol)ΔfGΘm(kJ/mol)H2O(l)—285.84—237.19CH4(g)—74.85—50.79CH3OH(l)—238.57—166.23C2H5OH(l)—277.63—174.77CO2(g)—393.51—394.381.请用计算结果判断,反应①和②在常温常压下(298K,PΘ)实现的可能性如何?2.对于常温常压下不可能实现的反应,当选用“高效催化剂”之后,能否变为常温常压下可实现的反应?为什么?3.对于可能实现的反应,请利用ΔrGΘm=–RTlnKΘ从理论上求出298K,PΘ下其平衡常数KΘ。若该反应为可逆的话,讨论温度、压力等外界条件对化学平衡的影响。(R=8.314J/mol∙K)\n1.若将CH4与O2(或空气)制造燃料电池(1)这个电池放电时发生的化学反应方程式为:(2)电池中电极发生反应负极发生的反应是正极发生的反应是向外电路释放电子的电极是(3)请根据ΔrGΘm=–nFEΘ的关系式求出该电池的电动势EΘ(F为法拉第常数,F=96500库仑)。第九题(共10分)化合物A、B分子式均为C8H15Cl3,经乙醇的氢氧化钠溶液处理,A得到C和D,而B得到C和E。在热的酸性高锰酸钾处理后,C得到1mol丁二酸同时放出气泡,D得到乙酸和丙二酸各1mol并放出气泡,而E得到2mol乙酸和气泡。请给出A、B、C、D、E的结构简式。第十题(共6分)化合物A(C8H8O2),在铁粉催化下与氯反应,\n一元取代物有两个异构体。经热的酸性高锰酸钾处理后,A转变为B,B在铁粉催化下与氯反应只得到一种一元取代物,B可与NaHCO3放出气泡。B在催化剂存在下与乙二醇反应,可得一高分子化合物C。请写出A、B、C的结构简式。第十一题(共6分)含I2的水溶液100mL,其中含I210.00mg,用90mLCCl4按下述两种方式进行萃取:(1)用90mL,一次萃取;(2)每次用30mL,分三次萃取。试计算并比较两种方式的萃取效率E。(K=/=85,K为被萃取物在各相中浓度之比;萃取效率为被萃取物质在萃取相中的总量与被萃取物质的总量之比。)2005年北京市高中学生化学竞赛试题参考答案及评分标准(高中二年级)第一题(共24分)选对一个答案得2分,多选一个错误答案扣1分1.A2.A3.C4.B5.A&D6.C7.D8.A&D9.B10.B第二题(共4分)Li2O2+CO2=Li2CO3+1/2O2(1分)Na2O2+CO2=Na2CO3+1/2O2(1分)Li2O2摩尔质量比Na2O2小,同质量时得到氧气更多。(2分)\n第三题(共10分)1.导线中的铜丝是纯铜单质,故呈紫红色;铜钥匙的材料是黄铜,它是Cu—Zn合金,故呈黄色;青铜塑像是青铜,它是的材料Cu—Sn合金,故呈深灰色。(3分)2.硫酸铜水溶液的浅蓝色是Cu(H2O)62+的颜色;蓝色硫酸铜是晶体的颜色是[Cu(H2O)4]∙H2O(SO4)的颜色,当该晶体受热脱水后变成无水CuSO4,故为白色粉末。(3分)3.生成硫酸四氨合铜络合物(配合物),该络合物显蓝紫色。Cu(H2O)42++4NH3®[Cu(NH3)4]2+(蓝紫色)(共2分)4.2Cu2++5KI®KI3(棕色)+2CuI¯(白色)+4K+(1分)5.2FeCl3(棕色)+Cu®CuCl2(蓝绿色)+2FeCl2(1分)第四题(共12分)1.(6分)2.BF3,平面三角形,键角120º;NF3,三角锥形,键角约107º;IF3,T形,键角约90º(3分)3.BF3是非极性分子,正电荷中心重合;NF3分子中N原子上有孤对电子,故为三角锥体,是极性分子,正负电荷中心不重合;IF3为T形分子,极性分子,正负电荷中心不重合。(3分)第五题(共8分)1.SiC(1分)2.原子晶体(1分)3.晶胞体积:V=abcsin120o=3.073x10-8cmx3.073x10-8cmx15.07x10-8cmxsin120o=123x10-24cm3\n(注:无需更多有效数字,因本题求原子数,而原子量是要求记忆的有效数字很少的数值)摩尔体积:Vm=123x10-24cm3x6.02x1023/mol=74cm3/mol摩尔质量:28+12=40g/mol计算密度:n(40g/mol)/(74cm3/mol)=n0.54g/cm3按SiC计的原子数=n=(3.24g/cm3)/(0.54g/cm3)≈6即Si和C各6个原子。(4分)(注:不给出具体数字不给分。此题硅的相对原子质量是要求记忆的数据,)。4.硅的原子半径较大(2分)(注:答其他不合题意的答案不给分,如不稳定,易分解,不硬,摩尔质量不合等等)第六题(共6分)干法:ZnO+H2S=ZnS+H2O 湿法:2HOCH2CH2NH2+H2S=(HOCH2CH2NH3)2S(HOCH2CH2NH3)2S+H2S=2HOCH2CH2NH3HS(3分)乙醇胺脱硫产物,加热释出H2S后,可利用,乙醇胺可循环使用(HOCH2CH2NH3)2S=2HOCH2CH2NH2+H2SHOCH2CH2NH3HS=HOCH2CH2NH2+H2SNH3∙H2O和H2S作用的产物(NH4)2S、NH4HS,受热分解为NH3和H2S,不易分离和循环使用。(3分)第七题(共6分)1.阳极电极反应式:2I―-2e=I2或3I―-2e=I3―阳极区现象: 溶液呈黄棕或浅黄棕色阴极电极反应式:2H++2e=H2或2H2O+2e=H2+2OH―阴极区现象: 溶液呈红色(共3分)2.阳极、阴极生成的I2和OH―物质的量之比为1∶2,因此发生以下反应:\n3I2+6OH―=IO3―+5I―+3H2OI2和OH―完全反应(共3分)注:若写成I2+2OH―=IO―+I―+H2O,因IO―是弱酸盐,水解显碱性,溶液应呈现红色。又,室温IO―会发生3IO―=IO3―+2I―反应。最多只能给一半分。第八题(共8分)1.①ΔrHΘm=2×0+(-277.63)–(-285.84)-2×(-74.85)=157.91kJ/mol(吸热)ΔrGΘm=2×0+(-174.77)–(-237.19)-2×(-50.79)=164.09kJ/mol②ΔrHΘm=-238.57–1/2×0–(-74.85)=–163.72kJ/mol(放热)ΔrGΘm=-166.23–1/2×0–(-50.79)=-115.44kJ/mol反应②有实现的可能性,∵298K,PΘ下ΔrGΘm<0(共2分)2.对反应①选用高效催化剂,也不可能在298K,PΘ下进行,∵ΔrGΘm>0,热力学上不可能进行反应,催化剂无效。(1分)3.ΔrGΘm=-RTlnKΘlnKΘ=-ΔrGΘm/RT=115.44×103/8.314×298=46.594KΘ=1.72×1020∵为放热反应,升温不利于正向进行,Δn=0–1.5=–1.5,升高压力有利于正向进行。(2分)4.(1)CH4(g)+2O2(g)=CO2(g)+2H2O(l)正极:2O2+8e=4O2―(2)负极:CH4+4O2―–8e=CO2+2H2O总反应:CH4+2O2=CO2+2H2O,向外电路释放电子的电极是负极。(3)ΔrGΘm=–nFEΘΔrGΘm=2×(-237.19)+(-394.38)-(-50.79)=-817.97kJ/molEΘ=–ΔrGΘm/nF=817.97×103/8×96500=1.06V(共3分)第九题(共10分)每个答案2分\n第十题(共6分)每个答案2分第十一题(共6分)(1)用90mL,一次萃取时:(3分)(2)每次用30mL,分三次萃取时:由此可见,同样量的萃取溶剂,分几次萃取的效率比一次萃取的效率高。(3分)题中所用公式:E=mn=m0