- 121.50 KB
- 2022-07-25 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
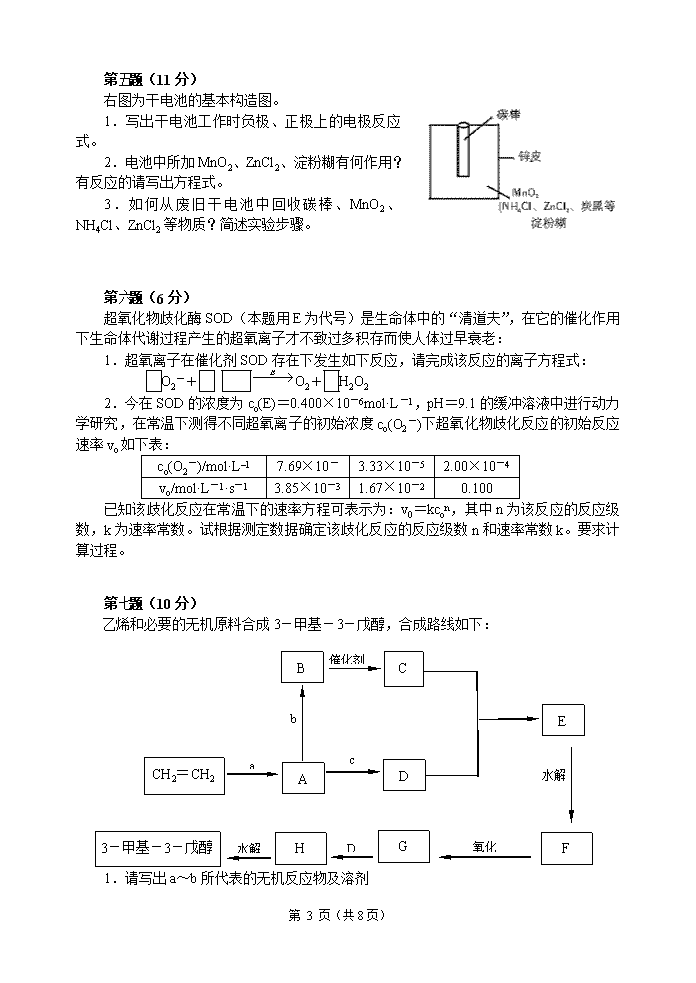
高中化学竞赛初赛试卷(07)(时间:3小时满分:100分)题号12345678910满分11771211610101115H1.008相对原子质量He4.003Li6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr[223]Ra[226]Ac-LaRfDbSgBhHsMtDsLa系La138.9Ce140.1Pr140.9Nd144.2Pm144.9Sm150.4Eu152.0Gd157.3Tb158.9Dy162.5Ho164.9Er167.3Tm168.9Tb173.0Lu175.0第第题(11分)1.三分子高级脂肪酸与甘油形成的酯(1分)2.桐油酸:9,11,13-十八碳三烯酸;蓖麻油酸:12-羟基-9-十八碳烯酸(2分)3.羧酸、酮(1分)4.液体表面张力合成洗涤剂(2分)5.由石油中得到的含20个碳以上的高级烷烃(1分)上光剂、鞋油、地板腊、蜡纸、化妆品(1分)6.亲油基亲水基(1分)7.5(1分)8.环戊烷(1分)题(11分)除糖类和蛋白质外,类脂化合物也是维持正常的生命活动不可缺少的物质。1.由动物或植物中取得的油脂是多种物质的混合物,其主要成分是;2.桐油酸和蓖麻油酸的结构简式分别为CH3(CH2)3(CH=CH)3(CH2)7COOH和CH3(CH2)5CH(OH)CH2CH=CH(CH2)7COOH,请分别命名。3.油脂在空气中氧、水分和霉菌的作用下酸败的主要产物是、等(类别)。4.表面活性剂是能降低的物质,阴离子型表面活性剂是其中一类,如CH3(CH2)10CH2OSO3Na、RSO3Na、R--SO3Na,主要用于。5.蜡和石蜡的物态、物性相近,而化学性质完全不同,蜡的主要组分是高级脂肪酸的高级饱和一元醇酯,而石蜡是。列举蜡的一种用途。6.磷脂是一类含磷的脂类化合物,他们在结构上的共同点是分子中同时有与______,使得磷脂类化合物在细胞膜中起着重要的生理作用。7.萜类化合物广泛存在于动植物界,它们的共同点是分子中的碳原子数都是的整数倍。(填数字)8.甾体化合物也叫类固醇化合物,广泛存在于动植物界。它们的共同特点是都含有一个由与氢化菲并联的骨架。第第题(7分)1.K2O·3Al2O3·6SiO2·2H2O(2分)2.AlⅢ与SiⅣ的半径相近,插入后不会引起结构改变(1分)3.(1)2KMg3AlSi3O10(OH)2+14H2CO3+H2O→2K++6Mg2++14HCO3-+4H4SiO4+Al2Si2O5(OH)4(2分)(2)碳酸较硅酸酸性强,强酸可取代弱酸(1分)(3)中性条件下Al3+完全水解,主要以沉淀形式存在(或铝在岩石中主要以共价形式存在)(1分)题(7分)云母是一种重要的硅酸盐,它具有韧度、弹性、透明度、高介电强度、化学惰性和热稳定性。白云母可看作叶腊石中1/4的SiⅣ被AlⅢ所取代,再由KⅠ平衡其电荷后形成的。而叶腊石可以看作SiO2中有1/3的SiⅣ被AlⅢ取代,再由KⅠ平衡其电荷形成的。1.白云母写成氧化物形式的化学式为。第8页(共8页)\n2.研究表明,在硅酸盐中,AlⅢ很容易取代SiⅣ,取代后不会引起原硅酸盐结构大的变化。从立体几何的知识看,AlⅢ与SiⅣ最直接的关系是。3.黑云母的化学式为KMg3AlSi3O10(OH)2,在水与二氧化碳的同时作用下,风化为高岭土[AI2Si2O5(OH)4]。(1)写出离子反应方程式。(2)上述反应为什么能够发生?(3)风化后Al为什么不能以Al3+形式被地下水溶解?第第题(7分)1.A:(CH3)3COH;HQ:HO--OH(各1分)TBHQ:(2分)2.邻叔丁基对二苯酚(1分)3.(1分)(1分)题(7分)等物质的量的醇A与“HQ”在一定条件下相互作用形成一种食品抗氧化剂“TBHQ”。“TBHQ”与氢氧钠溶液作用得到到化学式为C10H12O2Na2的化合物。经检测,“TBHQ”分子中存在9个完全相同的氢原子,而除此之外的氢原子都不完全一样。“HQ”易氧化,所得产物中氢原子完全等价。1.确定A、HQ、TBHQ的化学式;2.TBHQ的化学名称是;3.TBHQ有种同分异构体,其氧化产物中所有氢原子都等价,写出该异构体和氧化产物的结构简式。第第题(12分)1.a(KCl)︰a(NaCl)=1.14(2分)ρ(KCl)︰ρ(NaCl)=0.853(2分)2.8(1分)ρ=3.54g/cm3(3分)3.81624(各0.5分)4.412共价键范德华力(各0.5分)题(12分)晶体的最小重复单位是晶胞,晶胞一般为平行六面体。NaCl属立方面心晶格,在NaCl晶胞中8个顶点各有一个Na+,6个面心处各有一个Na+,故我们说Na+形成立方面心晶格,而在该晶胞的12条棱的中点处各有一个Cl-,在该立方晶胞的体心处还有一个Cl-,故Cl-也形成立方面心晶格。1.KCl和NaCl的晶格型式相同。已知Na+离子的半径是Cl-离子的0.5倍,而又是K+离子的0.7倍,计算:KCl晶胞和NaCl晶胞的边长之比;KCl和NaCl晶体的密度之比。2.将NaCl晶胞中的所有Cl-去掉,并将Na+全部换成C原子,再在每两个不共面的“小立方体”中心处各放置一个C原子便构成了金刚石的一个晶胞,则一个金刚石的晶胞中有_______个C原子。并计算金刚石的密度。(已知C原子的半径为7.7×10-11m)3.白硅石SiO2属AB2型共价键晶体。若将金刚石晶胞中的所有C原子换成Si原子,同时在每两个相邻的Si原子(距离最近的两个Si原子)中心联线的中点处增添一个O原子,则构成SiO2晶胞,故SiO2晶胞中有____个Si原子,____个O原子,离O原子最近的Si原子有____个,离Si原子最近的O原子有____个。4.干冰(固态CO2)属于分子晶体。若把每个CO2分子抽象为一个质点(微粒),则其晶胞也属于立方面心晶格,故一个干冰晶胞中有_____个CO2,与1个CO2分子最近的CO2分子有_____个;在干冰分子中,原子之间靠______结合,CO2分子之间靠______结合。第8页(共8页)\n第第题(11分)1.Zn-2e-=Zn2+2NH4++2e-=2NH3↑+H2↑(各1分)2.MnO2作去极剂(吸收正极放出的H2,防止产生极化现象),该反应方程式为:H2+2MnO2=Mn2O3+H2O。(2分)正极产生的NH3和ZnCl2溶液作用:Zn2++4NH3=[Zn(NH3)4]2+(2分)淀粉糊的作用是提高阴、阳离子在两个电极的迁移速率。(1分)3.①用钳子和剪刀剪开回收的干电池的锌铜,将锌皮和碳棒取出,并用毛刷刷干净,将电池内的黑色粉末移入小烧杯中。②向小烧杯中加入一定量的蒸馏水,充分搅拌,然后过滤,将滤液移入蒸发皿中,加热蒸发结晶。③加热法可将NH4Cl和ZnCl2的晶体混合物分离开。④最后剩余的黑色残渣的主要成分是MnO2,还有炭黑和有机物等,用灼烧的方法可除去杂质。(4分)题(11分)右图为干电池的基本构造图。1.写出干电池工作时负极、正极上的电极反应式。2.电池中所加MnO2、ZnCl2、淀粉糊有何作用?有反应的请写出方程式。3.如何从废旧干电池中回收碳棒、MnO2、NH4Cl、ZnCl2等物质?简述实验步骤。第第题(6分)1.2O2-+2H+O2+H2O2(1分)2.首先根据题给v和c(O2-)的数据确定反应级数和速率常数kv1/v2={c1(O2–)/c2(O2–)}n,3.85×10-3/1.67×10-2=(7.69×10-6/3.33×10-5)n,n=1v2/v3={c2(O2–)/c3(O2–)}n,1.67×10-2/0.100=(3.33×10-5/2.000×10-4)n,n=1v=kc(O2-)(2分)即k=v1/c(O2-)1=3.85×10-5/7.69×10-6=501s-1k=v2/c(O2-)2=1.67×10-2/3.33×10-5=502s-1k=v3/c(O2-)3=0.1/2.00×10-4=500s-1平均k=501s-1(3分)题(6分)超氧化物歧化酶SOD(本题用E为代号)是生命体中的“清道夫”,在它的催化作用下生命体代谢过程产生的超氧离子才不致过多积存而使人体过早衰老:1.超氧离子在催化剂SOD存在下发生如下反应,请完成该反应的离子方程式:O2-+O2+H2O22.今在SOD的浓度为co(E)=0.400×10-6mol·L-1,pH=9.1的缓冲溶液中进行动力学研究,在常温下测得不同超氧离子的初始浓度co(O2-)下超氧化物歧化反应的初始反应速率vo如下表:co(O2-)/mol·L–17.69×10-3.33×10-52.00×10-4vo/mol·L-1·s-13.85×10-31.67×10-20.100已知该歧化反应在常温下的速率方程可表示为:v0=kcon,其中n为该反应的反应级数,k为速率常数。试根据测定数据确定该歧化反应的反应级数n和速率常数k。要求计算过程。第第题(10分)1.a:HBrb:NaOH/H2Oc:Mg/乙醚(各1分)2.A:BrCH2CH3B:CH3CH2OHC:CH3CHOD:CH3CH2MgBrE:CH3CH2CH(CH3)OMgBrF:CH3--CH2-CH3G:CH3──CH2CH3H:(各1分)题(10分)B催化剂CbADcEaCH2=CH2HGF3-甲基-3-戊醇水解D氧化水解乙烯和必要的无机原料合成3-甲基-3-戊醇,合成路线如下:1.请写出a~b所代表的无机反应物及溶剂第8页(共8页)\n2.请写出A~H物质的结构简式:第第题(10分)1.V+3H2SO4(浓)=VOSO4+2SO2↑+3H2O(2分)2.MnO4-+5VO2++8H+=Mn2++5VO3++4H2O(2分)或MnO4-+5VO2++H2O=Mn2++5VO2++2H+2MnO4-+5NO2-+6H+=2Mn2++5NO3-+3H2O(2分)(NH2)2CO+2NO2-+2H+=CO2↑+2N2↑+3H2O(2分)3.(2分)题(10分)钢中加入微量钒可起到脱氧和脱氮的作用,改善钢的性能。测定钢中钒含量的步骤如下:钢试样用硫磷混合酸分解,钒以四价形式存在。再用KMnO4将其氧化为五价,过量的KMnO4用NaNO2除去,过量的NaNO2用尿素除去。五价钒与N-苯甲酰-N-苯基羟胺在3.5~5mol/L盐酸介质中以1︰2形成紫红色单核电中性配合物,比色测定。回答如下问题:1.高价钒在酸性溶液中通常以含氧阳离子的形式存在。写出钒与浓硫酸作用的反应方程式。2.以反应方程式表示上述测定过程中KMnO4、NaNO2和尿素的作用。3.写出紫红色配合物的结构式(已知V六配位)。第第题(11分)1.2Pb2++Cr2O72-+H2O=2PbCrO4↓+2H+2PbCrO4+2H+=2Pb2++Cr2O72-+H2OCr2O72-+6I-+14H+=2Cr3++3I2+7H2OI2+2S2O32-=2I-+S4O62-(各1分)2.Pb3O4~3Pb2+~3/2Cr2O72-~3×3/2I2~3×3/2×2S2O32-(1分)Pb3O4%=91.41%(3分)3.淀粉(1分)4.(1)I-+I2I3-,过量的KI可固定I2,防止挥发。(1分)(2)碘量瓶(1分)题(11分)四氧化三铅俗名“铅丹”或“红丹”,化学式可以写为2PbO·PbO2,铅丹用于制造铅玻璃,由于它有氧化性,涂在钢材上有利于钢铁表面的钝化,其防锈效果好,所以被大量地用于油漆船舶和桥梁钢架。今欲测定某样品四氧化三铅含量,称取Pb3O40.1000g,加酸溶解,得到含Pb2+的溶液,加热下用过量K2Cr2O7将Pb2+沉淀为PbCrO4,冷却后过滤洗涤,将PbCrO4沉淀用HCl溶液溶解,加入过量KI,用0.1000mol/LNa2S2O3溶液滴定,终点时用去12.00mL。1.写出PbCrO4沉淀、溶解和滴定过程的化学方程式;2.计算试样中Pb3O4的质量分数;3.用标准溶液滴定时应用指示剂?4.加入过量KI后,反应需在暗处放置5~10分钟。(1)所加KI为什么要过量?(2)为了防止生成的I2挥发,可选用何种仪器?第第题(15分)1.钌Ru第五周期第8列(各1分)2.sp3杂化;正四面体(各1分)3.K2RuO4KRuO4(各1分)2K2RuO4+Cl2=KRuO4+2KCl3K2RuO4+2H2O=2KRuO4+RuO2+4KOH(各1分)4.[]4-(式中Cl原子没画出)(1分)5.Ru配合物的异构现象:、(1分)、(1分)(1分)C水解,无论哪个位置上的Cl被H2O取代都得到Y。D水解似乎有两种可能,但题意指示只得到Y,不得到X,说明对于D的水解,只发生在对位是Cl的Cl原子上,不发生在对位是H2O的Cl原子上。这种反应规律又叫做“反位效应”。(1分)题(15分)元素A的单质在氯碱工业中可用作电解槽的阳极材料。A在酸性溶液中被KMnO4氧化时,可生成橙黄色的AO4。在KCl存在下,AO4可被HCl还原成红色晶体K4[A2OCl10]。迄今已知只有两种金属四氧化物,AO4是稳定性较差的一种。A有两种重要的含氧酸钾盐B和C,其中元素A的含量分别为41.81%和49.50%。碱性介质中用Cl2氧化B可得到C;B在酸性介质中易歧化为AO2和C。1.写出A的元素名称和符号。A在长式周期表中的第几周期,第几列?2.写出AO4中A的杂化形态,AO4的几何构型。3.写出B、C的化学式和反应方程式;4.画出配合物(K4[A2OCl10])中阴离子的结构式。第8页(共8页)\n5.写出六配位配合物ACl2(H2O)4+和ACl3(H2O)3的立体异构体?实验证实,后者的所有异构体经水解只转化成前者的某一种异构体Y。试画出Y的结构,并通过分析上述实验结果指出,配合物水解(取代)反应有什么规律?第8页(共8页)\n参考答案第8页(共8页)\n\n