- 273.00 KB
- 2022-07-25 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
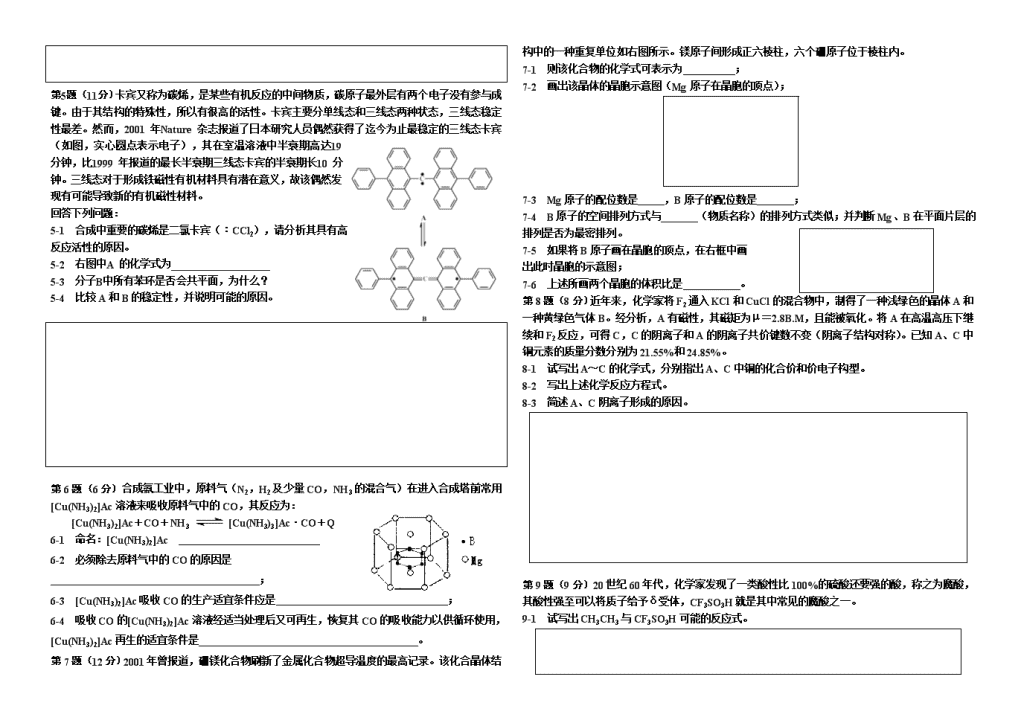
高中化学竞赛模拟试题(六)第1题(8分)根据提供的信息写出相应的化学方程式:1-1据认为“红巨星”星体内部发生着合成重元素的中子俘获反应,例如Zn可以俘获1个中子形成A,过剩的能量以光子形式带走;A发生β衰变转化为B。试写出平衡的核反应方程式。1-2铍与某些普通配体形成的配合物相当稳定,比如铍的化合物A为无色可升华的分子型化合物,易溶于氯仿并可从氯仿溶液中重结晶。A物质中心氧原子周围按四面体方式排布4个Be原子,Be原子两两间又被醋酸根所桥联。该物质可以通过碳酸铍与醋酸反应制备,请写出该制备反应的化学方程式;1-3ClF3是比F2更有效的氟化剂,遇有机物往往爆炸,能燃烧石棉,能驱除许多金属氧化物中的氧。比如气态ClF3与Co3O4反应,作为还原剂的元素有两种,物质的量之比为1︰4,请写出反应方程式。第2题(11分)上世纪末,中国科大的化学家把CCl4(l)和Na混合放入真空容器中,再置于高压容器中逐渐加热,可得一些固体颗粒。经X-射线研究发现:该固体颗粒实际由A和B两种物质组成,其中A含量较少,B含量较多。试回答下列问题:2-1 CCl4和Na为何要放在真空容器中?随后为何要置于高压容器中?2-2 指出CCl4分子的结构特点和碳原子的杂化态。2-3 上述实验的理论依据是什么?请从化学反应的角度加以说明。2-4 试确定A、B各为何物?A、B之间有何关系?2-5 写出上述反应方程式,并从热力学的角度说明A为何含量较少,B为何含量较多?2-6 请你从纯理论的角度说明:采取什么措施后,A的含量将大幅度增多?2-7 请评述一下上述实验有何应用前景?第3题(12分)罂粟碱可以按下列路线(不得增加反应步骤)合成:A()BCD()CEFGHI()3-1命名反应物A;3-2写出合成的中间产物B、C、E、F、G、H的结构简式3-3确定无机试剂a、b、c、d第4题(12分)钢铁表面发蓝(或发黑,在钢铁表面形成一层致密的氧化物Fe3O4)可提高其耐磨、耐蚀性能。其原理是:①在NaOH溶液中,将铁粉溶解在NaNO2溶液中,除水之外,还可产生A和C。其中C为气体,能使湿润的红色石蕊试纸变蓝。②A能在过量的NaNO2溶液中继续反应,生成B和C。③A和B的溶液能继续反应,生成Fe3O4。经研究发现:A和B的焰色反应均为黄色,其导电性实验均为K2SO4型。生成物中A与C、B与C的物质的量之比均为3︰1。回答下列问题:4-1写出并配平化学反应方程式。4-2实践中发现适当提高温度或增大NaNO2溶液的浓度有利于氧化膜增厚,但加大NaOH溶液浓度对膜层厚度影响不大。试说明原因。4-3发蓝层遇光气(COCl2),若不及时清洗,则发蓝层的完整性将被破坏。写出有关的化学反应方程式。4-4有一种隐形材料D可由B与Zn(NO3)2反应生成,也可用以硝酸铁、硝酸锌、氢氧化钠等为原料的水热合成法。请确定D的化学式,并判断上述制备D的反应是否属于氧化还原反应。此法所得产品D能够隐形的原因是什么?\n第5题(11分)卡宾又称为碳烯,是某些有机反应的中间物质,碳原子最外层有两个电子没有参与成键。由于其结构的特殊性,所以有很高的活性。卡宾主要分单线态和三线态两种状态,三线态稳定性最差。然而,2001年Nature杂志报道了日本研究人员偶然获得了迄今为止最稳定的三线态卡宾(如图,实心圆点表示电子),其在室温溶液中半衰期高达19分钟,比1999年报道的最长半衰期三线态卡宾的半衰期长10分钟。三线态对于形成铁磁性有机材料具有潜在意义,故该偶然发现有可能导致新的有机磁性材料。回答下列问题:5-1合成中重要的碳烯是二氯卡宾(︰CCl2),请分析其具有高反应活性的原因。5-2右图中A的化学式为___________________5-3分子B中所有苯环是否会共平面,为什么?5-4比较A和B的稳定性,并说明可能的原因。第6题(6分)合成氨工业中,原料气(N2,H2及少量CO,NH3的混合气)在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收原料气中的CO,其反应为:[Cu(NH3)2]Ac+CO+NH3[Cu(NH3)3]Ac·CO+Q6-1命名:[Cu(NH3)2]Ac6-2必须除去原料气中的CO的原因是;6-3[Cu(NH3)2]Ac吸收CO的生产适宜条件应是;6-4吸收CO的[Cu(NH3)2]Ac溶液经适当处理后又可再生,恢复其CO的吸收能力以供循环使用,[Cu(NH3)2]Ac再生的适宜条件是。第7题(12分)2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的一种重复单位如右图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。7-1则该化合物的化学式可表示为;7-2画出该晶体的晶胞示意图(Mg原子在晶胞的顶点);7-3Mg原子的配位数是,B原子的配位数是;7-4B原子的空间排列方式与(物质名称)的排列方式类似;并判断Mg、B在平面片层的排列是否为最密排列。7-5如果将B原子画在晶胞的顶点,在右框中画出此时晶胞的示意图;7-6上述所画两个晶胞的体积比是。第8题(8分)近年来,化学家将F2通入KCl和CuCl的混合物中,制得了一种浅绿色的晶体A和一种黄绿色气体B。经分析,A有磁性,其磁矩为μ=2.8B.M,且能被氧化。将A在高温高压下继续和F2反应,可得C,C的阴离子和A的阴离子共价键数不变(阴离子结构对称)。已知A、C中铜元素的质量分数分别为21.55%和24.85%。8-1试写出A~C的化学式,分别指出A、C中铜的化合价和价电子构型。8-2写出上述化学反应方程式。8-3简述A、C阴离子形成的原因。第9题(9分)20世纪60年代,化学家发现了一类酸性比100%的硫酸还要强的酸,称之为魔酸,其酸性强至可以将质子给予δ受体,CF3SO3H就是其中常见的魔酸之一。9-1试写出CH3CH3与CF3SO3H可能的反应式。\n9-2以上反应所得产物活性均很高,立即发生分解,试写出分解以后所得到的全部可能产物。第10题(11分)1866年H.Rithausen从谷胶的硫酸分解产物中分离出谷氨酸()。1890年L.Wollf合成并确定了它的结构,1908年池田菊苗从海带的热水提取物中分离出谷氨酸的钠盐(),它才是具有鲜味的成分,即味精。10-1谷氨酸的电离常数Ka1=6.46×10-3,Ka2=5.62×10-5,Ka3=2.14×10-10;pKa=-lgKa,所以pKa1=2.19,pKa2=4.25,pKa3=9.67。目前工业上生产味精的方法有水解法、糖蜜提取法、淀粉发酵法及合成法等。当前我国生产的味精主要采用淀粉发酵法。以发酵法生产的工艺流程如下:淀粉葡萄糖发酵谷氨酸铵L-谷氨酸谷氨酸-钠盐。若生成谷氨酸二钠盐,则不具有鲜味,所以工业生产中控制各阶段的pH是一项关键。(1)Ka1、Ka2、Ka3相对应的基团各是哪个?(2)计算谷氨酸等电点的pH(所谓等电点,就是谷氨酸呈电中性时所处环境的pH)。在下面正确的选项上画圈。A.2.19B.3.22C.4.25D.6.96(3)中和、脱色、结晶时的pH应保持在多少?在下面正确的选项上画圈。A.3.22B.4.25C.6.96D.9.67(4)用什么物质脱色?10-2味精中有效成分是谷氨酸钠,可用沙伦逊甲醛滴定法测定其含量。准确称取味精1.000g,加蒸馏水溶解后稀释到10.0mL;从中取2.0mL放入100mL锥形瓶中,加入2.0mL36%的甲醛溶液,加入20mL水。以酚酞为指示剂,用0.1000mol/L的标准NaOH溶液进行滴定,消耗10.80mL。(1)谷氨酸钠与甲醛反应得到化学式为C6H8NO4Na,写出结构简式。(2)加入甲醛的目的是什么?(3)计算该味精中谷氨酸钠的含量。10-3味精中往往会加入食盐,某学生设计如下实验方案测定NaCl含量:取味精样品5.0g,并溶于蒸馏水;加入足量用稀硝酸酸化的硝酸银溶液,使沉淀完全;过滤;用蒸馏水反复洗涤沉淀多次;将沉淀低温烘干、称量;重复操作3次,计算NaCl含量。另一学生觉得这个实验方案的误差较大,且测定沉淀的质量很不方便。于是他设计了另一个实验方案来测定NaCl的含量。已知AgSCN是难溶于水的沉淀。请简要写出测定NaCl含量的新方案参考答案:(六)1-1(各2分)1-24BeCO3+6CH3COOH→4CO2↑+3H2O+Be4O(OOCCH3)6(2分)1-32Co3O4+6ClF3→6CoF3+3Cl2+4O2↑(2分)2-1 放在真空容器中是为了防止Na被空气中的氧气氧化;随后放在高压容器中是为了生成金刚石,因为生成金刚石需要高温高压。(2分)\n2-2 正四面体;碳原子的杂化形态为sp3;(1分)2-3 上述实验是武慈反应,即卤代烃与钠的反应,生成碳原子数更大的烃。因为CCl4中碳原子为sp3杂化,反应后,许许多多的碳原子通过sp3杂化学形式成键,即组成网状的金刚石。(2分)2-4 A为金刚石;B为石墨,它们互为同素异形体。(2分)2-5 化学反应为:CCl4+4Na→C+4NaCl金刚石和石墨的稳定形态相比,金刚石的内能大,不稳定,易转化为内能较低的石墨。(2分)2-6 从纯理论的角度看,采取高温高压,将使一部分石墨转化成金刚石,使金刚石的含量大幅增多。(1分)2-7 上述实验开辟了人造金刚石的另一途径。(1分)3-14-甲基邻苯二甲醚(2分)3-2B:C:E:F:G:H:(各1分)3-3a:NBS/CCl4b:KCNc:H2/Nid:H3O+,△(各1分)4-13Fe+NaNO2+5NaOH=3Na2FeO2+NH3↑+H2ONa2FeO2+NaNO2+5H2O=3Na2Fe2O4+NH3↑+7NaOHNa2FeO2+Na2Fe2O4+2H2O=Fe3O4+4NaOH(各1分)4-2因NaNO2是氧化剂,增大NaNO2浓度可使反应向生成Fe3O4方向移动;而升高温度可以增强NaNO2的氧化性;由于NaOH是介质,当它的浓度达到一定要求后,再升高c(OH-),对化学平衡(生成氧化物层厚度)影响不大,何况还抑制Na2Fe2O4、Fe3O4的生成。(3分)4-32Fe3O4+9COCl2=6FeCl3+8CO2↑+CO↑。(2分)4-4D:ZnFe2O4;(2分)非氧化还原反应;(1分)D晶粒直径应在10nm(纳米)左右。(1分)5-1卡宾碳原子最外层只有六个电子,不太稳定(2分)(考查8电子稳定结构的经典规律)。(还有“-Cl吸电子,使其成为强的亲电试剂”也是原因之一)5-2︰C41H26(2分)(注意卡宾的对称性,不写这两个电子也给分)5-3不会(1分),中心碳原子是sp杂化,两侧的苯环是互相垂直的。(1分)5-4苯环为富电子基团,B的两个不饱和碳原子最外层各有七个电子,且与三个苯环相连,稳定化作用强。B比A稳定,该卡宾寿命长的原因正是二者互变的结果。(2分,答出“因为共轭才稳定”即可)6-1醋酸二氨合铜(Ⅰ)(2分,不指明铜的化合价给1分)6-2防止催化剂中毒(1分)6-3低温(1分)、加压(1分)6-4高温低压(1分)关注与实际生产生活结合的平衡问题,运用相关的平衡原理去解释问题;另外请不要忽略配合物的命名。7-1MgB2(2分)7-2(2分)7-36个12个(2分)7-4石墨(1分)B不是Mg是(1分)7-5(2分)7-61︰1(2分)8-1A:K3CuF6;B:Cl2;C:K2CuF6(各1分);A、C中铜原子价态分别为+3、+4(1分)。价电子构型分别为3d8和3d7(1分)8-23F2+3KCl+CuClK3CuF6+2Cl2↑2K3CuF6+F22K2CuF6+2KF(各1分)8-3主要是由于F-半径小,电负性大,配位能力强(1分)9-1(2分)(2分)(生成二电子三中心键)9-2\n(2分)(3分)10-1(1)(2分)(2)B(1分)(3)C(1分)(4)用活性炭脱色(1分)10-2(1)(1分)(2)“掩蔽”氨基后滴定羧基,防止氨基对羧基和NaOH中和反应的影响(1分)(3)91.32%(2分)10-3取一定量的味精溶于水,加入过量标准AgNO3溶液(1分),以Fe3+为指示剂(1分),用标准KSCN溶液进行滴定(1分)。