- 83.65 KB
- 2022-07-25 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
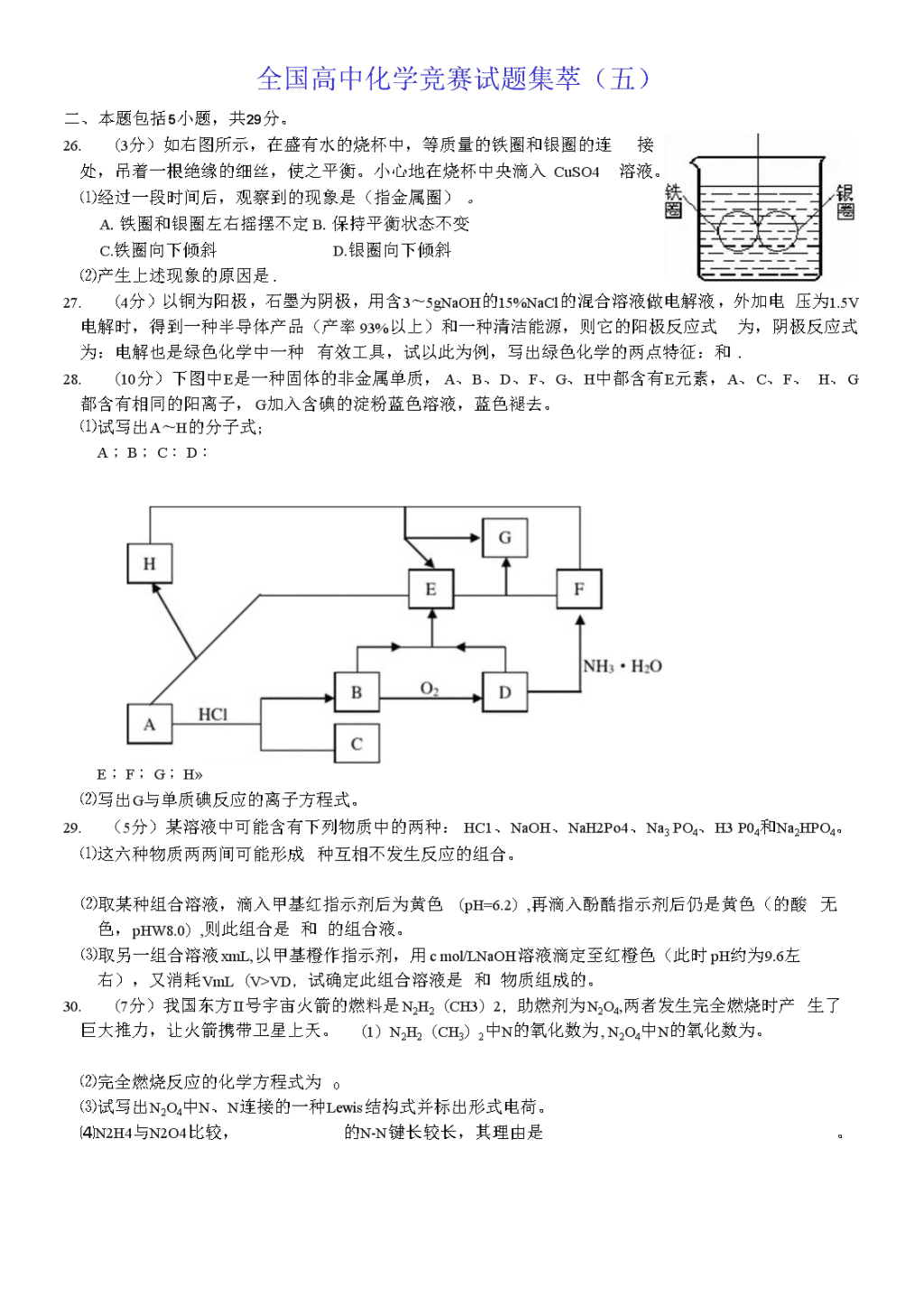
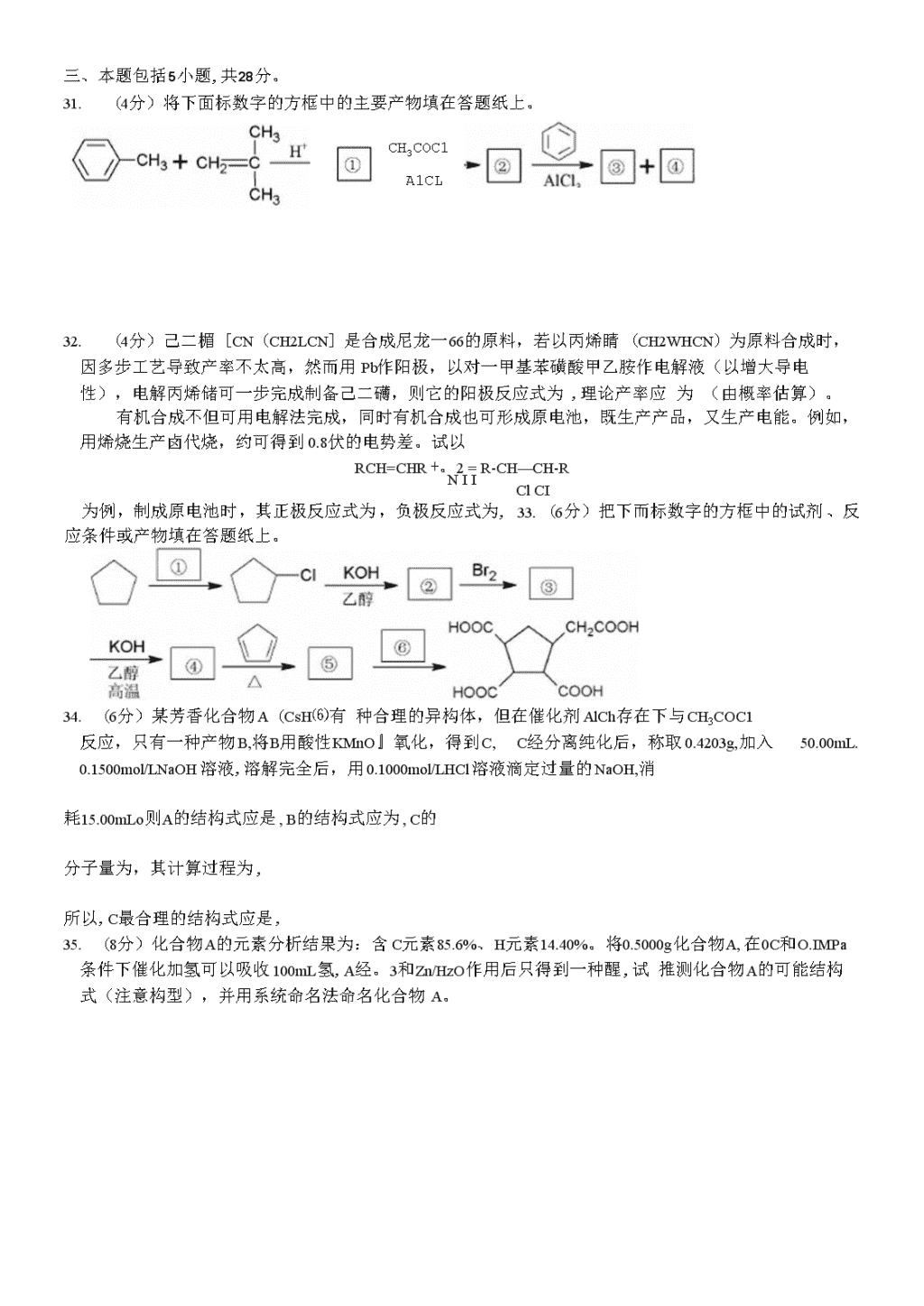
全国高中化学竞赛试题集萃(五)二、本题包括5小题,共29分。26.(3分)如右图所示,在盛有水的烧杯中,等质量的铁圈和银圈的连接处,吊着一根绝缘的细丝,使之平衡。小心地在烧杯中央滴入CuSO4溶液。⑴经过一段时间后,观察到的现象是(指金属圈)。A.铁圈和银圈左右摇摆不定B.保持平衡状态不变C.铁圈向下倾斜D.银圈向下倾斜⑵产生上述现象的原因是.27.(4分)以铜为阳极,石墨为阴极,用含3〜5gNaOH的15%NaCl的混合溶液做电解液,外加电压为1.5V电解时,得到一种半导体产品(产率93%以上)和一种清洁能源,则它的阳极反应式为,阴极反应式为:电解也是绿色化学中一种有效工具,试以此为例,写出绿色化学的两点特征:和.28.(10分)下图中E是一种固体的非金属单质,A、B、D、F、G、H中都含有E元素,A、C、F、H、G都含有相同的阳离子,G加入含碘的淀粉蓝色溶液,蓝色褪去。⑴试写出A〜H的分子式;A;B;C:D:E;F;G;H»⑵写出G与单质碘反应的离子方程式。29.(5分)某溶液中可能含有下列物质中的两种:HC1、NaOH、NaH2Po4、Na3PO4、H3P04和Na2HPO4。⑴这六种物质两两间可能形成种互相不发生反应的组合。⑵取某种组合溶液,滴入甲基红指示剂后为黄色(pH=6.2),再滴入酚酷指示剂后仍是黄色(的酸无色,pHW8.0),则此组合是和的组合液。⑶取另一组合溶液xmL,以甲基橙作指示剂,用cmol/LNaOH溶液滴定至红橙色(此时pH约为9.6左右),又消耗VmL(V>VD,试确定此组合溶液是和物质组成的。30.(7分)我国东方II号宇宙火箭的燃料是N2H2(CH3)2,助燃剂为N2O4,两者发生完全燃烧时产生了巨大推力,让火箭携带卫星上天。(1)N2H2(CH3)2中N的氧化数为,N2O4中N的氧化数为。⑵完全燃烧反应的化学方程式为0⑶试写出N2O4中N、N连接的一种Lewis结构式并标出形式电荷。⑷N2H4与N2O4比较,的N-N键长较长,其理由是。\n三、本题包括5小题,共28分。26.(4分)将下面标数字的方框中的主要产物填在答题纸上。CH3COC1A1CL27.(4分)己二楣[CN(CH2LCN]是合成尼龙一66的原料,若以丙烯睛(CH2WHCN)为原料合成时,因多步工艺导致产率不太高,然而用Pb作阳极,以对一甲基苯磺酸甲乙胺作电解液(以增大导电性),电解丙烯储可一步完成制备己二礴,则它的阳极反应式为,理论产率应为(由概率估算)。有机合成不但可用电解法完成,同时有机合成也可形成原电池,既生产产品,又生产电能。例如,用烯烧生产卤代烧,约可得到0.8伏的电势差。试以RCH=CHR+。2=R-CH—CH-RNIIClCI为例,制成原电池时,其正极反应式为,负极反应式为,33.(6分)把下而标数字的方框中的试剂、反应条件或产物填在答题纸上。34.(6分)某芳香化合物A(CsH⑹有种合理的异构体,但在催化剂AlCh存在下与CH3COC1反应,只有一种产物B,将B用酸性KMnO』氧化,得到C,C经分离纯化后,称取0.4203g,加入50.00mL.0.1500mol/LNaOH溶液,溶解完全后,用0.1000mol/LHCl溶液滴定过量的NaOH,消耗15.00mLo则A的结构式应是,B的结构式应为,C的分子量为,其计算过程为,所以,C最合理的结构式应是,35.(8分)化合物A的元素分析结果为:含C元素85.6%、H元素14.40%。将0.5000g化合物A,在0C和O.IMPa条件下催化加氢可以吸收100mL氢,A经。3和Zn/HzO作用后只得到一种醒,试推测化合物A的可能结构式(注意构型),并用系统命名法命名化合物A。\n四、本题17分。34.R11O4与C2H4、H2O2-H2O发生下列一系列反应:+RuC)4①、②、⑤、⑥、⑦中加入H2O2—比0,③、④中加入C2H4。A与B、E与F有相同的化学式,但是不属于立体异构体。⑴请画出上图A〜F各字母所代表的化合物的结构式并标出Ru的氧化态。⑵说明H2O2—H9在上述系列反应中起哪些作用?⑶H2O2与其它物质反应时,还能起什么作用?试用化学反应方程式说明。五、本题15分。37.Ss与NH3在无水条件下反应,得到一种二元化合物A,元素分析可知,A中含S元素69.60%。A进行如下反应:SnCL的乙醇溶液△•-►A在CS2中力ns(含B元素68.10%,N元素为29.76%)(含S元素85.13%)(含S元素82.07%)A、B、C、D的分子量范围在150〜190之间,各元素含量都是质量分数°试回答下列各问题:(D写出A、B、C、D的化学式。⑵写出生成A的化学方程式。⑶写出A-B的化学方程式。⑷只以A的骨架来⑸D与一种无色液体(该液体是由常见的红棕色气体在加压下形成的)为等电子体,但D与无色液体的几何构型完全不同,试画出D的最稳定的Lewis结构式。并说明它是最稳定Lewis结构式的理由。⑹在D的最稳定的Lewis结构式中,S原子的电子构型分别是多少?从电子构型看,D属于哪一类化合物?\n六、本题11分。38.将XeF?和XeF6混合样品用水处理,得到混合气体A和溶液B。把A通入焦性没食子酸溶液(能吸收氧气)和浓硫酸后,A减少了14.9mL;在B溶液中加入过量的Ba(OH)2,得到BaF?和Ba3XeC)6的混合沉淀物3.981g,加热分解后,得到一种气体D,D与A所含组分相同,但各组分含量不同。D通入焦性没食子酸和浓硫酸后,得到单一组分气体E,其体积为53.5mL,试求n(XeF6)和n(XeF”(气体体积都已换算成标准状态)。参考答案二、本题包括5小题,共29分。26.(3分)(DD⑵Fe和Ag形成原电池,Fe极Fe溶解,Ag极析出Cu增重。27.(4分)®2Cu+2OH--2e=Cu2O+H2O或2Cu+H2O-2e=Cu2O+2H+②2H20+2e=H2t+20H或2H*2e=H2t③原子利用率很高④几乎零排放(也可说,无毒排放等,只要吻合绿色化学的都可。)28.(10分)(DA:(NH4)2S;B:H2S:C:NH4CI:D:SO2:E:S:F:(NH4)2SO3;G:(NH4)2S2O3:H:(NH4)2Sno(每个分子式1分)(2)2S2O32+I2=S4O/+21-(2分)29.(5分)①五②NaH2P。4(3)Na2HPO4④HC1⑤H3Po430.(7分)①-2(1分)②+4(1分)③N2H2(CH3)2+2N2O4=3N2+2CO2+4H2O(1分)④(2分)⑤N2O4(1分)⑥因为N2O4中的两个N原子带同号形式电荷,N、N原子之间存在排斥力,所以N2O4的N-N键长比N2H4中的N-N键长要长。(1分)(其它合理答案也给分)三、本题包括5小题,共28分。31.(4分)①②③④32.(4分)02CH2=CHCN+2H++2e=CN(CH2)4CN②100%(3)Cl2+2e-2C1-④RCH=CHR/+2cl-2lR-CHC1-CHC1-R'33.(6分)①Cb〃”②③④\n26.(6分)①4②③④210.15⑤口二3(^jo(O.15OOX5O.O-O.1OOOX15.00)=0.002000(mol)oM=ITiSj=210,15(g/nK)l)⑥27.(8分)A的可能结构和命名如下:CH3cH2cH2CH2cH2cH3'c二C顺-4-辛烯(1分)/\HH(1分)CH3cH2cH2HC=C/\HCH2cH2cH3(i分)反.4一辛烯(1分)(1分)顺25-二甲基-3-己烯(1分)(1分)反-2,5-二甲基-3-己烯(1分)四、本题17分。28.(1)A1分Ru氧化数为+81分B1分Ru氧化数为+61分C1分Ru氧化数为+41分D1分Ru氧化数为+61分E1分Ru氧化数为+81分F1分Ru氧化数为+61分⑵氧化剂(1分)取代基(或配位剂)(1分)⑶还原剂(1分)5H2O2+2KM11O4+3H2sO4=K2so4+2MnSO4+5O21+8H2O(2分)(只要写出HQ2作还原剂的反应给1分,配平给1分)五、本题15分。29.(1)(4分)A:S4N4、B:S4N4H4或S4(NH)4、C:S5N2.D:S4N2⑵(2分)5Ss+40NH3=4S4N4+24NH4HS(3)(2分)S4N4+2SnC12+4C2HsOH=S4N4H4+2Sn(OC2Hs)2cb⑷(2分)8种⑸(1分)此结构式中所有原子的形式电荷为零(1分)⑹上而三个S原子是8电子构型(1分),下而一个S原子是10电子构型(1分)。富电子化合物(1分)。六、本题11分,\n38.解:根据样品与水反应,推测气体A为02和Xe,Xe是稀有气体,,焦性没食子酸吸收的为O2。溶液B为XeO3和HFo53.5Z.n(XeOs)=22400=2.388X103(mol)W(Ba3XeO6)=2.388XW3X639.2=1.526(g)3.981-1.526._因此,n(XeF2)+n(XeF6)=~4.V175.3=3.50XIO3(mol)①根据电子得失平衡:1.492n(XeF2)+6n(XeF6)=22400X4+2388XIO3X6=1.70XIO2(mol)n(XeF2)+3n(XeF6)=8.50XIO3(mol)②[②-①]/2得:n(XeF6)=2.50XlO^mol代入①式得:n(XeF2)=1.00X10-3moI