- 168.71 KB
- 2022-07-25 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
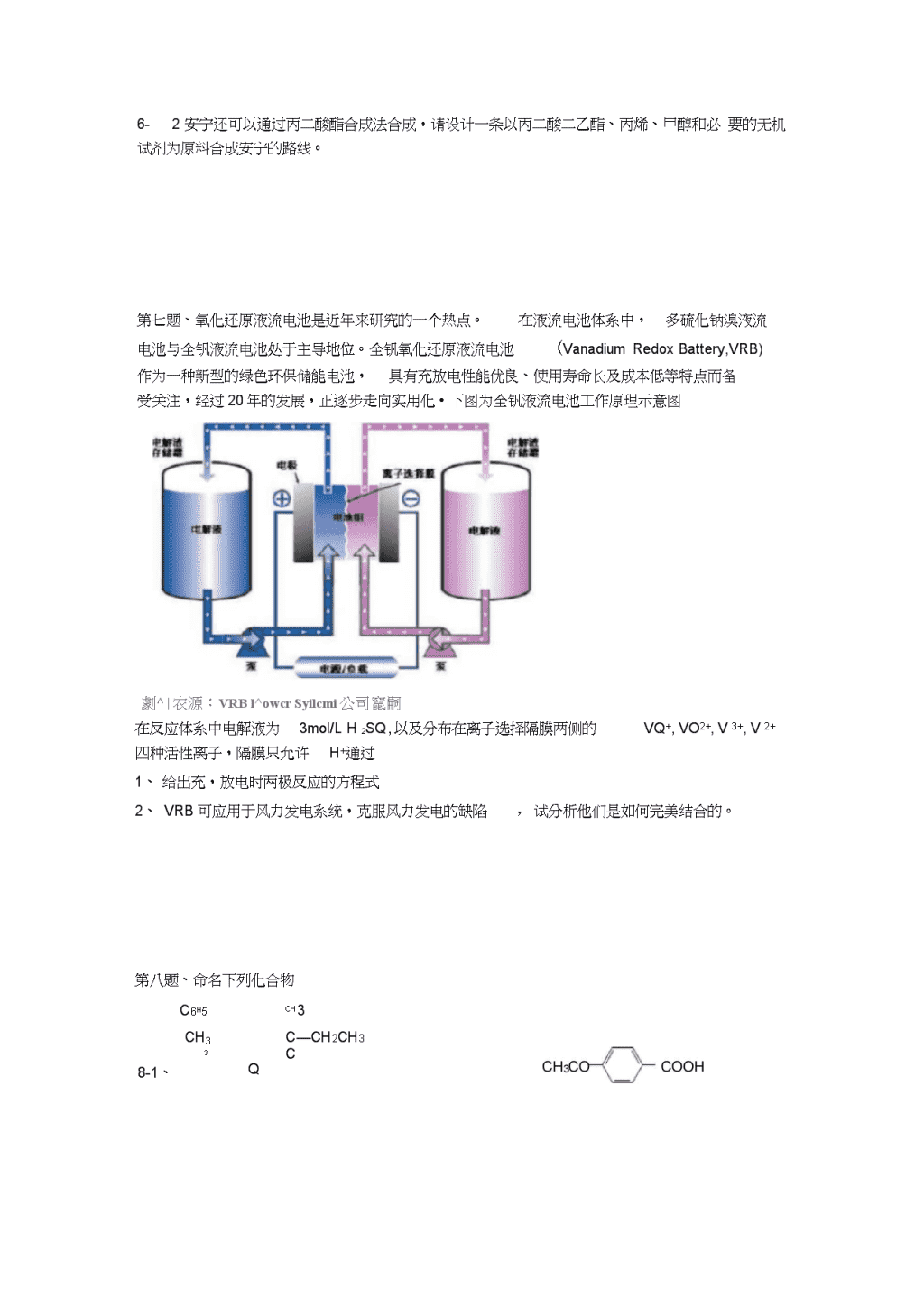
2008年全国高中化学竞赛模拟试题十四H1.008相对原子质量He4.003Li6.941Be9.012B10.81C12.01N14.01Q16.00F19.00Ne20.18Na22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl'35.45Ar39.95K39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br>79.90Kr83.8CRb85.47Sr37.62Y88.91Zr91.22Nb92.91Mo95.94Tc98.91Ru101.1Rh102.SPd106.4Ag107.SCd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs132.9Ba137.3LaLuHf178.5Ta180.9W183.9Re186.2Os190.2Ir192.2Pt195.1Au197.CHg200.6TI204.4Pb207.2Bi209.0Po[210]At[[21100]Rn[222]Fr[223]Ra[226]Ac-LrRfDbSgBhHsMt第一题、联胺和草酸是许多贵金属的提纯常用的还原剂。以下是工业中的两个例子1-1联胺可以从含AgCI的浆料中还原沉积银,写出反应的方程式1-2用NaCIQ-HzSQ-NaCI溶浸金矿得到的浸出液中含一阴离子,含金元素百分比为58.1%,草酸可以从该浸出液中提取金。写出该反应的方程式第二题、试解释下列现象:2-1硅没有类似于石墨的同素异性体。2-2氮没有五卤化氮,却有+5氧化态的N2Q,HNQ及其盐,这两者是否有矛盾?2-3酸性大小:HIO4>HsIQ6第三题、3-1、画出分子式为CH的包含等价氢原子的所有三种可能构型异构体的结构图。指明并论证哪两个预期是不稳定的。用价键理论讨论稳定的异构体及其较低同系物结构和键合情况。3-2、用价键理论讨论(1)C302(线型)(2)C4O42(环状)的结构和键合情况。\n第四题、在无氧的条件下以干燥的钠汞齐(以Na—Hg表示)和干燥的二氧化硫一起振荡,只制得固态化合物A。已知A中钠元素的质量分数为26.41%,氧元素的质量分数为36.76%,其余为S元素。2-1•试确定A的化学式并命名A。写出生成A的化学反应方程式。4-2•若在有氧的条件下,进行上述反应,会有什么样的结果?说明A具有什么样的化学性质?4-3.若将A加热到402K时,质量减轻了18.39%。分析得到的固体残渣,发现是两种物质(记为B和C)组成的混合物。试写出A分解的化学反应方程式。第五题、铬的化学丰富多采,实验结果常出人意料。将过量30%HC2加入(NH4)2CrQ的氨水溶液,热至50C后冷至0C,析出暗棕红色晶体A。元素分析报告:A含Cr31.1%,N25.1%,H5.4%。在极性溶剂中A不导电。红外图谱证实A有N—H键,且与游离氨分子键能相差不太大,还证实A中的铬原子周围有7个配位原子提供孤对电子与铬原子形成配位键,呈五角双锥构型。5-1•以上信息表明A的化学式为:;可能的结构式为:3-2.A中铬的氧化数为:。5-3•预期A最特征的化学性质为:。5-4•生成晶体A的反应是氧化还原反应,方程式是:第六题、安定药安宁可由2-甲基戊醛出发按下列方法合成:HCHOHCHOClCOCl2-甲基戊醛A(C7H14O2)B(C7H16O2)'OHOH"NH3C(C9H14CI2O4)安宁(C9H18N2O4)6-1写出安宁及上述合成步骤中化合物A〜C的结构式。\n2-2安宁还可以通过丙二酸酯合成法合成,请设计一条以丙二酸二乙酯、丙烯、甲醇和必要的无机试剂为原料合成安宁的路线。第七题、氧化还原液流电池是近年来研究的一个热点。在液流电池体系中,多硫化钠溴液流电池与全钒液流电池处于主导地位。全钒氧化还原液流电池(VanadiumRedoxBattery,VRB)作为一种新型的绿色环保储能电池,具有充放电性能优良、使用寿命长及成本低等特点而备受关注,经过20年的发展,正逐步走向实用化•下图为全钒液流电池工作原理示意图劇^|农源:VRBl^owcrSyilcmi公司竄嗣在反应体系中电解液为3mol/LH2SQ,以及分布在离子选择隔膜两侧的VQ+,VO2+,V3+,V2+四种活性离子,隔膜只允许H+通过1、给出充,放电时两极反应的方程式2、VRB可应用于风力发电系统,克服风力发电的缺陷,试分析他们是如何完美结合的。第八题、命名下列化合物C6H5ch3CH3C—CH2CH33C8-1、Q\n8-3、ClClONO2第九题、不稳定的化合物A分子式GH,化合物C,后者经酸性高锰酸钾处理生成式并为A、B、D命名。经三分子聚合得到B。B与丁炔二酸二甲酯共热得D并放出二氧化碳1mol。请给出A、BC的结构简CH3OOC—C三C-COOCH3KMnO4-H+CHsOOCCOOCH3+CO2第十题、化合物A(C7H2),在酸性高锰酸钾溶液中加热回流,反应液中只有环己酮一种有机物,A与氯化氢反应得化合物B,B与乙醇钠-乙醇溶液共热生成化合物C,C能使溴的四氯化碳溶液褪色并生成化合物D,再将D与乙醇钠-乙醇溶液共热则得到化合物E,E与高锰酸钾溶液加热回流得丁二酸和丙酮酸。化合物C若经臭氧解(Q氧化,然后用H2O/Zn处理)则生成6-氧代庚醛。10-1写出化合物A-E的结构式(不考虑化合物的立体异构)。\nOIICH3CCO2HOIICH3CCH2CH2CH2CH2CHO丙酮酸6-氧代庚醛10-2用系统命名法命名化合物B,C,D,E10-3上述化合物中哪个可以由乙烯和2-甲基-1,3-丁二烯经一步反应而制得?请用反应式表示。10-4如何将6-氧代庚醛转化为1,6-庚二醇?请用反应式表示。第十一题、固体电解质是具有与强电解质水溶液的导电性相当的一类无机固体。这类固体通过其中的离子迁移进行电荷传递,因此又称为固体离子导体。固体电解质取代液体电解质,可以做成全固态电池及其它传感器、探测器等,在电化学、分析化学等领域的应用日益广泛。碘化银具有a、卩和y等多种晶型。在水溶液中Ag+与I「沉淀形成的是丫-Agl和卩-Agl的混合物,升温至136C全变为卩-Agl,至146C变为a-Agl。a-Agl是一种固-1-1-3-1-1体电解质,导电率为1.31Q?Cm(注:强电解质水溶液导电率为10〜1Q2m)。y=0y=£ay=*ay=7aY-Agl和卩-Agl晶体的导电性极差。其中y-Agl晶体属立方晶体,其晶胞截面图如上所示。图中实心圆和空心圆分别表示Ag+和l_,a为晶胞边长。11-1试指出和y-Agl晶体的点阵型式和Ag+、I「各自的配位数(已知通常厂,Ag+的半径为100〜150pm)。11-2a-Agl晶体中,I「离子取体心立方堆积,Ag+填充在其空隙中。试指出a-Agl晶体的晶胞中,八面体空隙、四面体空隙各有多少?11-3通常Ag+离子半径有一个变化范围,为什么?11-4实验发现,a-Agl晶体中能够迁移的全是Ag+,试分析Ag+能够发生迁移的可能原因。\n2008年全国高中化学竞赛模拟试题十四参考答案第一题、1-14AgCI+N2円+40H-宀4AgJ+4Cl-+4H20+N2T(有铵离子生成,配平也对)1-2阴离子应为AuCl4—,2HAuCl4+3H2GQ宀2AuJ+8HCl+6CO2T第二题2-1Si是第三周期元素,原子半径比C的大,Si-Si键长大于C-C键长,垂直于键平面的p轨道不易侧向重叠形成n键,所以Si不能形成含有离域n键的类似石墨结构的同素异性体。2-2氮的假电子层有4个价轨道,最大共价键数只能是4,故不能形成含有5个共价键的NX,在NaO,HNO及其盐中,N的共价键数并未超过4,只是代表电荷偏移的氧化态为+5而已。2-3HIO4和H5IO6分子中的非羟基数目不同,前者有三个,后者有一个,故前者是强酸,后者是弱酸。第三题、HHZ\CHC--CHC/HHC=C=C=C(III)(I)不稳定,因为其n电子数=4,不符合4n+2规则;(II)不稳定,其中每个C原子sp3杂化,理应CCG109°28',但三元环中的CCC远小于109°28',环中存在张力,不稳定。(山)中两端的两个碳原子是sp2杂化,中间两个碳原子是sp杂化,成键为:同系物中两端的两个碳原子是sp2杂化,中间碳原子是sp杂化,成键为:H1-2、(1)C3Q(线型):dC=C=C=O,每个碳原子采取sp杂化,每个0原子sp杂化。或可看作C0原子都采取sp杂化,形成两个ICII"・*•-I0CCCI・■■■-I(2)GO2(环状)每个C原子采取sp2杂化,其中两个碳原子未参与杂化的2p轨道分别与两个0原子的2p轨道“肩并肩”形成n键,另外两个碳原子未参与杂化的2p轨道相互“肩并肩”重叠成n键。00c—cIIIW00第四题4-1.A:Na>S2C4;连二亚硫酸钠;2SQ+2Na—Hg=Na2S2Q+2Hg4-2•有Q存在时,A会被氧化(得到NazSQ或NaHSO;说明NS2S2O具有强还原性。\n1-3.2Na2$Q=NazSO+Na^SO+SQf第五题2-1.A的化学式Cr(NH3)3Q4或CrNsHO(写成其他形式也可以)A的可能结构式如下图:1式和/或2式均得满分,但无2个过氧键Q—Q者得零分。(编者注:还可画出其他结构式,但本题强调的是结构中有2个过氧键,并不要求判断它们在结构中的正确位置。)5-2.A中铬的氧化数为+45-3•氧化还原性(或易分解或不稳定等类似表述均得满分)5-4•化学方程式:CrQ42一+3NH+3fQ=Cr(NH3)3Q2)2+Q+2H2Q+2QH第六题3-1ch3ch3ch5ch3CH5CK2CH2CCHOCH3CH2CH2CCHinH匚2虫^£比&匚比0匚06CHH^CH3CCHy3CONHdlhOH尿OH6hsOGOGLABC表宁6-2CH^pH+HICH*——CH;CH^CHa—“印「知r过氧化物化“冋王Gg吧CH3CHjCH3CHCCOaEt)a厂HI3(l)LiAlH,CH无H2H2G(GOqE舫nh3⑺HQH+^=r充魁++VQ2+2H+e2+2++H2Q和一第八题8-1、(E)-4-甲基-8-3、2,4第九题B:1,CH2=C=5-苯基-4-己烯-3-酮8-48-2、4-乙酰基苯甲酸、(2R,3S)-2-甲基-3-氯-1-醇A:丙二烯(1分)2,4—三亚甲基环己烷(4分)第七题4-1、正极反应:VQ负极反应:V3++e2-2、风力发电系统受到气候变化,风力大小等自然条件的影响,电能输出具有不稳定性和间断性的特点,与VRB结合可以将电能储存于电池中,可调节电压大小,保证稳定的电功率输出(意思对即可)D:2,4,6,9,11—四羰基十二碳二酸二甲酯或2,4,6,9,11—四氧代十二碳二酸二甲酯(3分)\n第十题10-1CH2CH3CH310-2B:1-甲基-1-氯环己烷写成1-氯-1-甲基环己烷不给分C:1-甲基环己烯或1-甲基-1-环己烯D:1-甲基-1,2-二溴环己烷写成1,2-二溴-1-甲基环己烷不给分E:2-甲基-1,3-环己二烯10-3化合物C可由乙烯和2-甲基-1,3-丁二烯经一步反应而制得:33OH2,Pd(或Ni,Pt)OHCH3CCH2CH2CH2CH2CHOCH3CHCH2CH2CH2CH2CH2OH或(1)LiAlH4(2)H3O+或(1)NaBH4(2)H3O+第十一题、11-1y=0,指xy平面,I—分布为(顶点、面心有1—);11——y=—a,指xy平面之间的一,I分布为(I都在面心);22•••点阵型式为立方面心,由于Ag+离子占有「离子围成的八个正四面体空隙中四个互不相邻的正四面体空隙,.••正、负离子配位数都为4。11-2八面体空隙=61212146个、四面体空隙=461212个*K耳金属原子?八面体空隙X四面体空隙11-3在不同晶体中,Ag+离子占据不同空隙,按正、负离子相互接触计算的Ag+离子半径自然有一个变化范围。11-4对于立方体(体心)堆积而言:球数:四面体空隙:八面体空隙=2:12:6=1:6:3,•Ag+离子只占空隙的九分之一,这说明a-AgI晶体中有大量空隙存在,有利于Ag+离子迁移,另外在体心立方中,四面体空隙与八面体空隙相连,四面体空隙与四面体空隙通,可以供Ag离子迁移。过三角形中心相连,构成三维骨架结构的开放性“隧道”