- 649.57 KB
- 2022-07-25 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
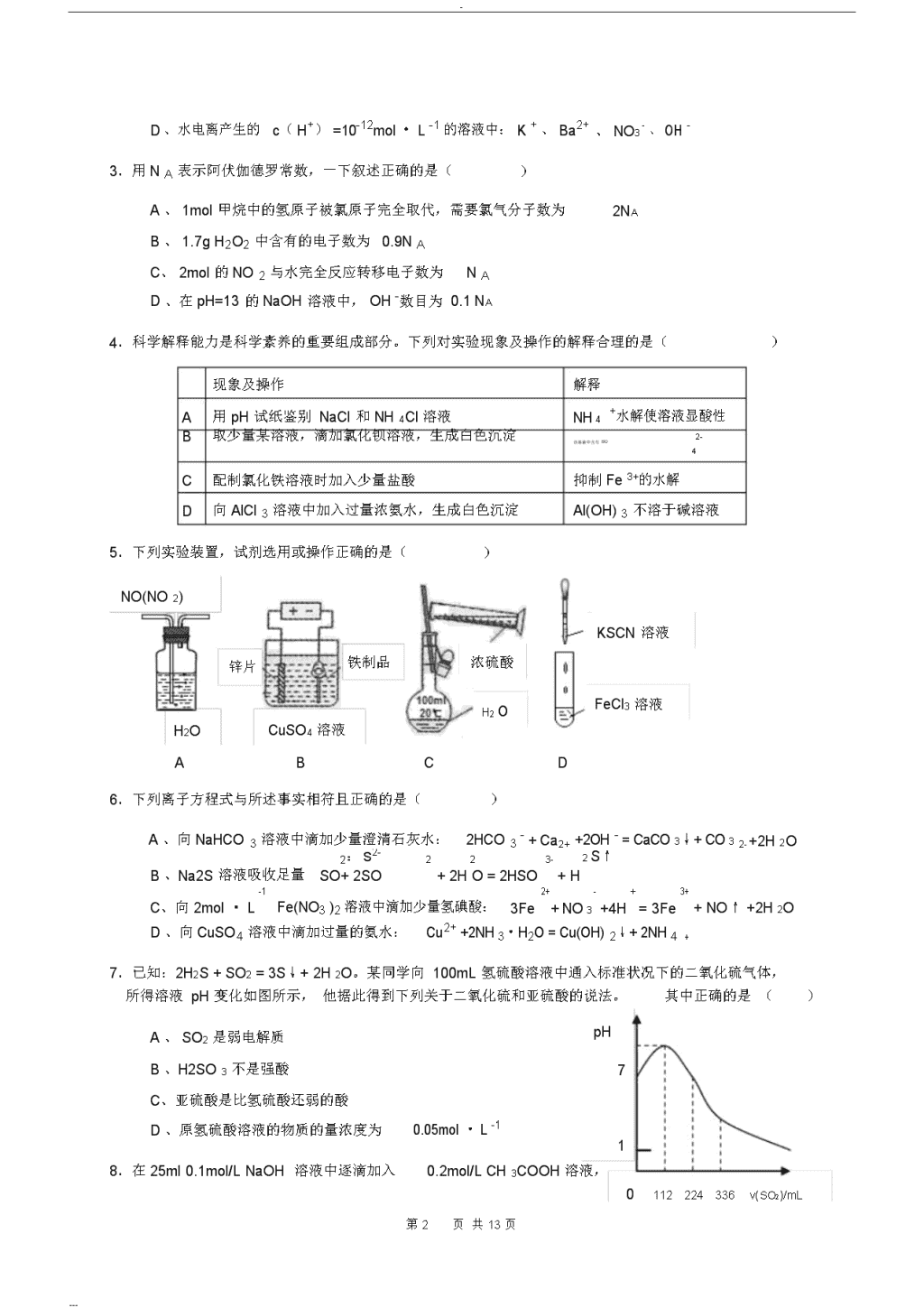
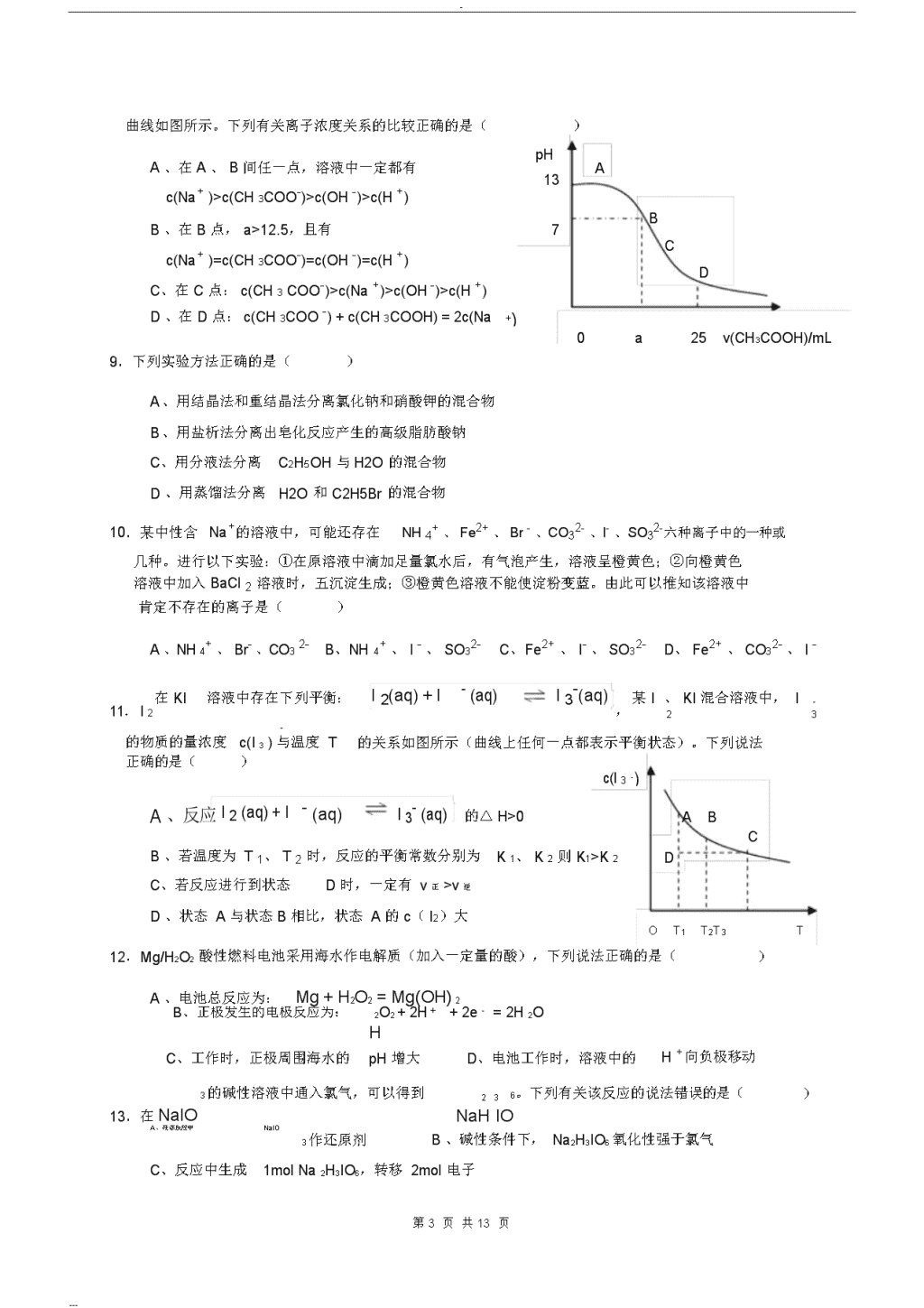
-2010年全国高中学生化学竞赛(安徽赛区)初赛试题题号一二三四总分得分注意:考试时间3小时,满分150分。直接在试卷上答题,允许使用非编程计算器。第一大题(选择题)答案写在下表..中,其余题答案写在试卷上题号12345678910111213答案题号141516171819202122232425答案H元素周期表He1.0084.003LiBeBCNOFNe6.9419.01210.8112.0114.0116.0019.0020.18NaMgAlSiPSClAr22.9924.3126.9828.0930.9732.0735.4539.95KCaScTiVCrMnFeCoNiCuZnGaGeAsSeBrKr39.1040.0844.9647.8850.9452.0054.9455.8558.9358.6963.5565.3969.7272.6174.9278.9679.9083.80RbSrYZrNbMoTcRuRhPdAgCdInSnSbTeIXe85.4787.6288.9191.2292.9195.94[98]101.1102.9106.4107.9112.4114.8118.7121.8127.6126.9131.3CsBaLa-LuHfTaWReOsIrPtAuHgTlPbBiPoAtRn132.9137.3178.5180.9183.8186.2190.2192.2195.1197.0200.6204.4207.2209.0[210][210][222]FrRaAc-Lr[223][226]得分评卷人一、本题包括25小题,每小题2分,共50分。每小题有1个或2个选项符合1个选项符合题意,多选或错选均不得分。若该题有2个选题意,若该题只有项符合题意,选对1个得1分,选对2个得2分;错选1个该题不得分。1.化学作为一门实用性很强的学科与社会、环境等密切相关。下列有关说法中正确的是()A、“低碳经济”主要是指减少对化石能源的依赖B、光导纤维主要成分是晶体硅C、制作航天服的聚酯纤维属于有机高分子化合物D、甲型H1N1流感病毒的蛋白质由C、H、O元素组成2.下列溶液中,一定能大量共存的离子组是()+2+2--A、pH=1的溶液中:Na、Mg、SO4、HCO33+的溶液中:Al3+2+、Cl-2-B、含有大量Fe、Cu、SO4C、加入铝能放出H2的溶液中:K++--、NH4、NO3、Cl----第1页共13页---\n-D、水电离产生的c(H+)=10-12mol·L-1的溶液中:K+、Ba2+、NO3-、OH-3.用NA表示阿伏伽德罗常数,一下叙述正确的是()A、1mol甲烷中的氢原子被氯原子完全取代,需要氯气分子数为2NAB、1.7gH2O2中含有的电子数为0.9NAC、2mol的NO2与水完全反应转移电子数为NAD、在pH=13的NaOH溶液中,OH-数目为0.1NA4.科学解释能力是科学素养的重要组成部分。下列对实验现象及操作的解释合理的是()现象及操作解释A用pH试纸鉴别NaCl和NH4Cl溶液NH4+水解使溶液显酸性B取少量某溶液,滴加氯化钡溶液,生成白色沉淀2-该溶液中含有SO4C配制氯化铁溶液时加入少量盐酸抑制Fe3+的水解D向AlCl3溶液中加入过量浓氨水,生成白色沉淀Al(OH)3不溶于碱溶液5.下列实验装置,试剂选用或操作正确的是()NO(NO2)KSCN溶液锌片铁制品浓硫酸H2OFeCl3溶液H2OCuSO4溶液ABCD6.下列离子方程式与所述事实相符且正确的是()A、向NaHCO3溶液中滴加少量澄清石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2OB、Na2S溶液吸收足量2:S2-223-2S↑SO+2SO+2HO=2HSO+HC、向2mol·L-1Fe(NO3)2溶液中滴加少量氢碘酸:3Fe2+-+=3Fe3++NO↑+2H2O+NO3+4HD、向CuSO4溶液中滴加过量的氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+7.已知:2H2S+SO2=3S↓+2H2O。某同学向100mL氢硫酸溶液中通入标准状况下的二氧化硫气体,所得溶液pH变化如图所示,他据此得到下列关于二氧化硫和亚硫酸的说法。其中正确的是()A、SO2是弱电解质pHB、H2SO3不是强酸7C、亚硫酸是比氢硫酸还弱的酸D、原氢硫酸溶液的物质的量浓度为0.05mol·L-118.在25ml0.1mol/LNaOH溶液中逐滴加入0.2mol/LCH3COOH溶液,0112224336v(SO2)/mL第2页共13页---\n-曲线如图所示。下列有关离子浓度关系的比较正确的是()A、在A、B间任一点,溶液中一定都有pHA13c(Na+)>c(CH3COO-)>c(OH-)>c(H+)B、在B点,a>12.5,且有7BCc(Na+)=c(CH3COO-)=c(OH-)=c(H+)DC、在C点:c(CH3COO-)>c(Na+)>c(OH-)>c(H+)D、在D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)a25v(CH3COOH)/mL09.下列实验方法正确的是()A、用结晶法和重结晶法分离氯化钠和硝酸钾的混合物B、用盐析法分离出皂化反应产生的高级脂肪酸钠C、用分液法分离C2H5OH与H2O的混合物D、用蒸馏法分离H2O和C2H5Br的混合物10.某中性含Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的一种或几种。进行以下实验:①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色溶液中加入BaCl2溶液时,五沉淀生成;③橙黄色溶液不能使淀粉变蓝。由此可以推知该溶液中肯定不存在的离子是()A、NH4+、Br-、CO32-B、NH4+、I-、SO32-C、Fe2+、I-、SO32-D、Fe2+、CO32-、I-11.I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)I3-(aq),某I、KI混合溶液中,I-23-的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法的物质的量浓度c(I3)与温度T正确的是()c(I3-)A、反应I2(aq)+I-(aq)I3-(aq)的△H>0ABB、若温度为T1、T2时,反应的平衡常数分别为K1、K2则K1>K2CDC、若反应进行到状态D时,一定有v正>v逆D、状态A与状态B相比,状态A的c(I2)大OT1T2T3T12.Mg/H2O2酸性燃料电池采用海水作电解质(加入一定量的酸),下列说法正确的是()A、电池总反应为:Mg+H2O2=Mg(OH)2B、正极发生的电极反应为:2O2+2H++2e-=2H2OHC、工作时,正极周围海水的pH增大D、电池工作时,溶液中的H+向负极移动3的碱性溶液中通入氯气,可以得到236。下列有关该反应的说法错误的是()13.在NaIONaHIOA、在该反应中NaIOB、碱性条件下,Na2H3IO6氧化性强于氯气3作还原剂C、反应中生成1molNa2H3IO6,转移2mol电子----第3页共13页---\n-D、反应中氧化产物与还原产物的物质的量之比为2:114.下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是()物质abca选项AAl2O3AlCl3Al(OH)3BCuOCu(OH)2CuCl2bcCSONaSOHSO22323DCONaHCO3Na2CO315.下列有关物质结构的叙述正确的是()A、有键能很大的共价键存在的物质熔沸点一定很高B、由电子定向移动而导电的物质是金属晶体C、只含有共价键的物质不一定是共价化合物D、在离子化合物中不可能存在非极性共价键16.有A、B两种短周期元素,原子半径是:r(A)ClO->I2A、氧化性:SO4B、漂白粉溶液可使淀粉碘化钾试纸变蓝C、向氯水中加入亚硫酸钠溶液,氯水褪色D、次氯酸钠可以与亚硫酸钠共存20.某小组为了证明铁的金属活动性比铜强,他们设计了如下方案,其中合理的是()A、铁片置于硫酸铜溶液中有铜析出B、铁、铜和氯气反应分别生成FeCl3和CuCl2C、足量的铁粉和铜粉分别与浓硫酸反应生成FeSO和CuSO44D、把铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接,铁片上无气泡产生,而铜片上有气泡产生21.下列化合物的沸点高低排列正确的是()①CH3CH2CH2OCH2CH2CH3②(CH3)2CHOCH(CH3)2③(CH3)3CCH2OH④CH3CH2CH2CH2COOHA、①>②>③>④B、②>③>①>④C、③>②>④>①D、④>③>①>②22.下列化合物的酸性强弱排列正确的是()OCHCHCHCOHCHCHCHCOOH3232①Br②Br③CHCHCHCOOH④CHCHCHCHOH3223222A、④>②>③>①B、③>②>④>①C、②>①>④>③D、①>②>③>④23.下列化合物中,有旋光异构的是OOCH3CHCHCHOHHOCCHCHCOHA、22B、2BrCH3CHCCHCOOH3C、HOCH2CH2CH2OHD、CH324.下列化合物中,具有芳香性的是()A、B、C、D、25.下列化合物中,不能形成分子内氢键的是()----第5页共13页---\n-CH3NO22NOOOHA、OHB、CHCCHCHCH323C、OHD、OH得分评卷人二、本题包括8小题,共47分。26.(9分)我省铜陵市有大型的电解铜工厂,在电解铜的阳极泥中含有3~14%X元素,其余为稀有金属及贵金属。X和硫同主族,人体缺少X就会得“克山病”,X也是制光电池的一种原料。从阳极泥中提取X的流程如下:①443~573K②进一步加热混有浓硫酸生成XO2、XO2、SO2的阳极泥焙烧SO2等物质等挥发到773~873K通入水中H2XO3与H2SO3H2XO3、H2SO3生成X↓及SO2或SO2发生反应(1)X的元素符号是________,它的基态原子核外电子排布式为_________________________(2)阳极泥中X以X单质、AgX、CuX等型体存在,则①中X单质与浓硫酸的反应方程式为22___________________________________________________________________________,CuX与浓硫酸的反2应方程式为___________________________________________________________________________。(3)H2XO3与SO2的反应方程式为____________________________________________________________________27.(6分)X、Y、Z为周期表前四周期中的常见元素。X的单质是人体呼吸及新陈代谢中必不可少的气体。Y的单质也为气体,易溶于水,溶液呈浅黄绿色。Z的基态原子外围电子排布为3d64s2。(1)将Z2X3与ZY3按等物质的量放在密闭管中加热使其恰好完全反应,只生成一种产物A,其物质的量是反应物的1.5倍,A为菱形片晶,具有金属光泽。此化学反应方程式为___________________________________________________________________________(2)A不溶于冷水,但在沸水中缓慢水解,生成棕黄色沉淀B,溶液呈酸性,且无气泡产生。取水解后的上层清液,滴入硝酸银溶液,生成白色沉淀,说明Y在A中与_________________________是相连的,所以水解时Y进入水中。B的化学式为_________________________。(3)将A溶于稀盐酸中,滴入硫氰化铵,呈红色,说明A中的Z的氧化数为____________________,A的命名应为__________________________________________________。28.(6分)在固体KHSO4中,有一半是以双聚分子存在,另一半是以链式结构存在,生成这两种空间构型的原因是_________________________键存在,请画出双聚分子的结构:_________________________________________,链式结构为_________________________________________。29.(5分)在CS2溶剂中,加入碘和过量的白磷(P4)反应,只生成四碘化二磷。反应后蒸出CS2,固体物质为四碘化二磷和过量的P4,加入计量水到固体物中反应,生成磷酸和一种碘化物A,A中阳离子为四面体构型,A中既含有离子键,也有共价键,还有配位键。写出四碘化二磷、P4----第6页共13页---\n-和水反应的化学方程式__________________________________________________,四碘化二磷的氧化数为________,磷酸中磷的氧化数为____________________,A中磷的氧化数为____________________。30.(8分)在日光照射下,O2、F2、和AsF5以2:1:2(物质的量比)混合反应,只生成离子化合物X,X中阳离子为O2+,此化学反应方程式为__________________________________________________,其中O2为__________________剂,F2为_________________剂。而阴离子的空间构型为____________构型,其中心原子的杂化轨道类型为_________________________。X是一种强氧化剂,它可氧化Br2,生成离子化合物Y(其中Br的质量分数为55.93%)和一种助燃气。Y也可用Br2、BrF5和AsF5混合后通过化合反应制得,且X与Y的阴离子相同,写出该反应的化学方程式______________________________________________________________________,此反应中Br2是_________________剂,BrF5是_________________剂。Y中阳离子的空间构型为_______________型,其中心原子的杂化轨道类型为_________________________。CH2CH3CH3CHCHC231.(4分)用系统命名法命名:CH2CH个sp3:___________________________________________,该分子中有________________________杂化碳原子、______________________个sp杂化碳原子。23该分子中有________________________个sp2-sp3的δ键、_______________________个sp3-sp3的δ键型。32.(3分)写出符合以下条件的含六个碳原子的烷烃结构式。(1)含有两个三级碳原子的烷烃:__________________________________________________(2)含有一个异丙基的烷烃:__________________________________________________(3)含有一个四级碳原子及一个二级碳原子的烷烃:________________________________________________33.(6分)ICl可作为离子型化合物的溶剂。因此,可用KCl的的ICl溶液滴定SbCl5。用相应的酸碱理论说明:KCl在ICl溶剂中形成的_______________________离子作为碱,而_______________________作为酸,发生的酸碱反应方程式为__________________________________________________。得分评分人三、本题包括2小题,共20分34.(14分)完成下列反应式:KMnO4CH3CH2OH(1)+H+,△H,△Cl2(2)+。-------\n-第7页共13页---\n-Br2KOHCHCHCHO2(3)乙醇△△35.(6分)分子式为C6H10的化合物A和B均能使溴的四氯化碳(CCl4)溶液褪色,并经催化氢化得到相同的产物正己烷,化合物A可与Cu2Cl2的氨溶液作用产生红棕色沉淀而B不发生反应,BHCCH经O3OO,则化合物A的结构简式是氧化后再还原水解得到CH3CHO及_____________________,B的结构简式是_________________________。得分评卷人四、本题包括3小题,共33分。36(.10分)将0.100molAgCl加入到浓度为1.20mol·L-1的1.00L氨水中[Ksp(AgCl)=10-9.75,Ag(NH3)2+生成常数β2=107.05]。(1)计算AgCl沉淀溶解反应的平衡常数K值。(2)判断0.100molAgCl能否全部溶解?(3)计算溶液中Ag+的游离浓度为多少mol·L-1?(假设体积不变)37.(15分)CaCN2曾经直接用作肥料。在自然界中,它与水反应产生肥料,在此过程中会涉及到下面一些步骤:第一步水解,CaCN2与H2O以1:1(物质的量比)反应,生成两种中间体A和B,它们都是含钙的离子化合物,这步反应可以描述为简单的酸碱反应。化合物A和B在热力学上不稳定,受热很容易分解。化合物A热分解生成离子化合物C和共价化合物D,A与CO2反应,生成共价化合物D和新的离子化合物E。E热分解得到化合物C和H2O。化合物B与CO2、H2O反应生成E和新的共价化合物F,F简单水解(以1:1物质的量比),产生共价化合物G,G常用作肥料,G彻底水解生成CO2和另一种气体H。试回答下列问题:(1)试画出CaCN2中阴离子的共振结构式与共轭结构式:_______________________________________________、_______________________________________________(2)试写出字母A~H所代表物质的化学式:A______________、B___________、C_________________、D_______________、E________________、F__________________、G_______________、H_______________(3)写出该问题中描述的下列有关反应的化学方程式:CaCN2与H2O反应:________________________________________________________________________化合物A热分解:___________________________________________________________________________----第8页共13页---\n-化合物B与CO2、H2O反应:__________________________________________________________________G彻底水解生成CO2和另一种气体H:__________________________________________________(4)画出G的Lewis结构式:__________________________________________________(5)F的结构式是_________________________,画出其三种异构体的结构式(不考虑三元环)并命名:_____________________________________________________________________________________38.(8分)锂离子电池的正极材料往往用锂、锰复合氧化物和锂、钴复合氧化物。锂、钴复合氧化物的晶体结构示意图如右。锂、钴、氧原子的堆积方式相同。(1)从图中能看出哪些离子显示了周期性堆积?哪些离子未显示出周期性堆积?说出相应的理由。(2)试画出锂、钴复合氧化物的晶胞。(3)写出锂、钴复合氧化物的化学式。一个晶胞中有几个化学式?(4)若把锂、钴原子看作一种金属原子,该晶体属于什么晶型?试画出该晶型的晶胞。----第9页共13页---\n-第10页共13页---\n-第11页共13页---\n-第12页共13页---\n-第13页共13页---