- 5.06 MB
- 2022-07-25 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
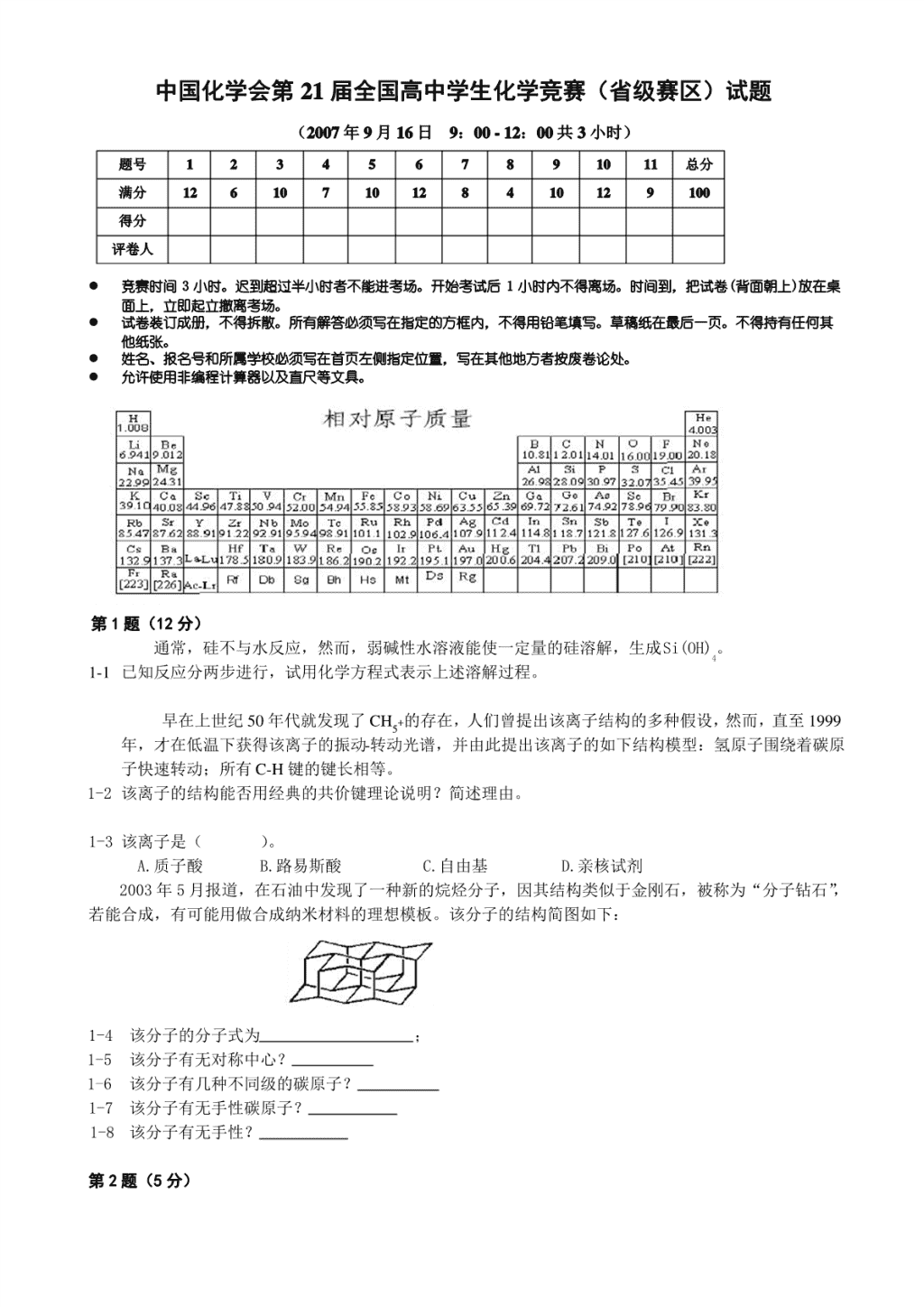
中国化学会第21届全国高中学生化学竞赛(省级赛区)试题(2007年9月16日9:00-12:00共3小时)题号1234567891011总分满分12610710128410129100得分评卷人竞赛时间3小时。迟到超过半小时者不能进考场。开始考试后1小时内不得离场。时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。试卷装订成册,不得拆散。所有解答必须写在指定的方框内,不得用铅笔填写。草稿纸在最后一页。不得持有任何其他纸张。姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。允许使用非编程计算器以及直尺等文具。第1题(12分)通常,硅不与水反应,然而,弱碱性水溶液能使一定量的硅溶解,生成Si(OH)。41-1已知反应分两步进行,试用化学方程式表示上述溶解过程。早在上世纪50年代就发现了CH+的存在,人们曾提出该离子结构的多种假设,然而,直至19995年,才在低温下获得该离子的振动-转动光谱,并由此提出该离子的如下结构模型:氢原子围绕着碳原子快速转动;所有C-H键的键长相等。1-2该离子的结构能否用经典的共价键理论说明?简述理由。1-3该离子是()。A.质子酸B.路易斯酸C.自由基D.亲核试剂2003年5月报道,在石油中发现了一种新的烷烃分子,因其结构类似于金刚石,被称为“分子钻石”,若能合成,有可能用做合成纳米材料的理想模板。该分子的结构简图如下:1-4该分子的分子式为;1-5该分子有无对称中心?1-6该分子有几种不同级的碳原子?1-7该分子有无手性碳原子?1-8该分子有无手性?第2题(5分)\n羟胺和用同位素标记氮原子(N﹡)的亚硝酸在不同介质中发生反应,方程式如下:NHOH+HN﹡O→A+HO222NHOH+HN﹡O→B+HO222A、B脱水都能形成NO,由A得到N﹡NO和NN﹡O,而由B只得到NN﹡O。2请分别写出A和B的路易斯结构式。第3题(8分)X-射线衍射实验表明,某无水MgCl晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积(ccp),2镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下。该晶体的六方晶胞的参数:a=363.63pm,c=1766.63pm;p=2.53g·cm-3。3-1以“”表示空层,A、B、C表示Cl-离子层,a、b、c表示Mg2+离子层,给出三方层型结构的堆积方式。2计算一个六方晶胞中“MgCl”的单元数。23假定将该晶体中所有八面体空隙皆填满Mg2+离子,将是哪种晶体结构类型?第4题(7分)化合物A是一种热稳定性较差的无水的弱酸钠盐。用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表:样品中A的质量分数/%20507090样品的质量损失/%7.418.525.833.3利用上述信息,通过作图,推断化合物A的化学式,并给出计算过程。第5题(10分)甲苯与干燥氯气在光照下反应生成氯化苄,用下列方法分析粗产品的纯度:称取0.255g样品,与25mL4mol·L-1氢氧化钠水溶液在100mL圆底烧瓶中混合,加热回流1小时;冷至室温,加入50mL20%硝酸后,用25.00mL0.1000mol·L-1硝酸银水溶液处理,再用0.1000mol·L-1NHSCN水溶液滴定剩余的硝酸银,以硫4酸铁铵为指示剂,消耗了6.75mL。\n5-1写出分析过程的反应方程式。5-2计算样品中氯化苄的质量分数(%)。5-3通常,上述测定结果高于样品中氯化苄的实际含量,指出原因。5-4上述分析方法是否适用于氯苯的纯度分析?请说明理由。第6题(12分)在给定实验条件下,一元弱酸HA在苯(B)和水(W)的分配系数K=[HA]/[HA]=1.00。已知水相和DBW苯相中HA的分析浓度分别为3.05×10-3和3.96×10-3mol·L-1。在水中,HA按HA⇌H++A-解离,K=1.00×10-4;a在苯中,HA发生二聚:2HA⇌(HA)。26-1计算水相中各物种的浓度及pH。6-2计算化合物HA在苯相中的二聚平衡常数。6-3已知HA中有苯环,1.00gHA含3.85×1021个分子,给出HA的化学名称。6-4解释HA在苯中发生二聚的原因,画出二聚体的结构。第7题(8分)KClO热分解是实验室制取氧气的一种方法。KClO在不同的条件下热分解结果如下:33实验反应体系第一放热温度/℃第二放热温度/℃AKClO4004803BKClO+FeO360390323CKClO+MnO35032已知⑴K(s)+1/2Cl(g)=KCl(s)△H(1)=-437kJ·mol-12⑵K(s)+1/2Cl+3/2O(g)=KClO(s)△H(2)=-398kJ·mol-1223⑶K(s)+1/2Cl+2O(g)=KClO(s)△H(3)=-433kJ·mol-12247-1根据以上数据,写出上述三个体系对应的分解过程的热化学方程式。7-2用写MnO催化KClO分解制得的氧气有轻微的刺激性气味,推测这种气体是什么,并提出确认这种气23体的实验方法。第8题(4分)用下列路线合成化合物C:反应结束后,产物中仍含有未反应的A和B。8-1请给出从混合物中分离出C的操作步骤;简述操作步骤的理论依据。8-2生成C的反应属于哪类基本有机反应类型。第9题(10分)根据文献报道,醛基可和双氧水发生如下反应:为了合成一类新药,选择了下列合成路线:\n9-1请写出A的化学式,画出B、C、D和缩醛G的结构式。9-2由E生成F和F生成G的反应分别属于哪类基本有机反应类型。9-3请画出化合物G的所有光活异构体。第10题(12分)尿素受热生成的主要产物与NaOH反应,得到化合物A(三钠盐)。A与氯气反应,得到化合物B,分子式CNOCl。B是一种大规模生产的化工产品,全球年产达40万吨以上,我国年生产能力达5万吨以3333上。B在水中能持续不断地产生次氯酸和化合物C,因此广泛用于游泳池消毒等。10-1画出化合物A的阴离子的结构式。10-2画出化合物B的结构式并写出它与水反应的化学方程式。10-3化合物C有一个互变异构体,给出C及其互变异构体的结构式。10-4写出上述尿素受热发生反应的配平方程式。第11题(12分)石竹烯(Caryophyllene,CH)是一种含双键的天然产物,其中一个双键的构型是反式的,丁香花气1524味主要是由它引起的,可从下面的反应推断石竹烯及其相关化合物的结构。反应1:反应2:反应3:反应4:石竹烯异构体—异石竹烯在反应1和反应2中也分别得到产物A和B,而在经过反应3后却得到了产物C的异构体,此异构体在经过反应4后仍得到了产物D。11-1在不考虑反应生成手性中心的前提下,画出化合物A、C以及C的异构体的结构式;11-2画出石竹烯和异石竹烯的结构式;11-3指出石竹烯和异石竹烯的结构差别。第1题(12分)\n1-1Si+4OH−=SiO4−+2H(1分)SiO4−+4HO=Si(OH)+4OH−1分)42424(若写成Si+2OH−+HO=SiO2−+2HSiO2−+3HO=Si(OH)+2OH−,也得同样的分。232324但写成Si+4HO=Si(OH)+2H不得分。写不写↓(沉淀)和↑(气体)不影响得分。2421-2不能。(1分)经典共价键理论认为原子之间通过共享电子对而成键。C为第二周期元素,只有4个价层轨道,最多形成4个共价键。(1分)理由部分:答“C原子无2d轨道,不能形成sp3d杂化轨道”,得1分;只答“C原子没有2d轨道”,得0.5分;只答“C原子有4个价电子”,得0.5分;答CH+中有一个三中心二电子键,不得分(因按三中5心二电子键模型,CH+离子的C-H键不等长)。51-3A或质子酸(多选或错选均不得分。)(2分)1-4CH(分子式不全对不得分)(2分)26301-5有(1分)1-63种(答错不得分)(1分)1-7有(1分)1-8无(1分)第2题(6分)(每式3分)对每一式,只写对原子之间的连接顺序,但未标对价电子分布,只得1分;未给出立体结构特征不扣分;未标出同位素符号不扣分,但B中将星号标错位置扣0.5分。第3题(10分)3-1···AcBCbABaCA···(5分)大写字母要体现出Cl-层作立方最密堆积的次序,镁离子与空层的交替排列必须正确,镁离子层与氯离子层之间的相对位置关系(大写字母与小写字母的相对关系)不要求。必须表示出层型结构的完整周期,即至少写出包含6个大写字母、3个小写字母、3个空层的排列。若只写对含4个大写字母的排列,如“···AcBCbA···”,得2.5分。3-2(3分)Z的表达式对,计算过程修约合理,结果正确(Z=3.00—3.02,指出单元数为整数3),得3分。Z的表达式对,但结果错,只得1分。3-3NaCl型或岩盐型(2分)第4题(7分)根据所给数据,作图如下:由图可见,样品的质量损失与其中A的质量分数呈线性关系,由直线外推至A的质量分数为100%,即样品为纯A,可得其质量损失为37.0%。作图正确,外推得纯A质量损失为(37.0±0.5)%,得4分;作图正确,得出线性关系,用比例法求\n出合理结果,也得4分;仅作图正确,只得2分。样品是热稳定性较差的无水弱酸钠盐,在常见的弱酸盐中,首先考虑碳酸氢钠,其分解反应为:2NaHCO3=NaCO+HO↑+CO↑该反应质量损失分数为(44.0+18.0)/(2×84.0)=36.9%,与上述外推所得数2322据吻合。化合物A的化学式是NaHCO。3根据所给条件并通过计算质量损失,答对NaHCO得3分。答出NaHCO但未给出计算过程,只得133分。其他弱酸钠盐通过计算可排除,例如NaCO质量损失分数为41.5%,等等。23第5题(10分)5-1(4分)CHCHCl+NaOH=CHCHOH+NaCl652652NaOH+HNO=NaNO+HO(此式不计分)332AgNO+NaCl=AgCl↓+NaNO33NHSCN+AgNO=AgSCN↓+NHNO4343Fe3++SCN-=Fe(SCN)2+每式1分;写出正确的离子方程式也得满分;最后一个反应式写成Fe3++3SCN-=Fe(SCN)也可。35-2(2分)样品中氯化苄的摩尔数等于AgNO溶液中Ag+的摩尔数与滴定所消耗的NHSCN的摩尔数34的差值,因而,样品中氯化苄的质量分数为M(CHCHCl)×[0.1000×(25.00-6.75)]/255652={126.6×[0.1000×(25.00-6.75)]/255}×100%=91%算式和结果各1分;若答案为90.6%,得1.5分(91%相当于三位有效数字,90.6%相当于四位有效数字)。5-3(2分)测定结果偏高的原因是在甲苯与Cl反应生成氯化苄的过程中,可能生成少量的多氯代物2CHCHCl和CHCCl,反应物Cl及另一个产物HCl在氯化苄中也有一定的溶解,这些杂质在6526532与NaOH反应中均可以产生氯离子,从而导致测定结果偏高。凡答出由以下情况导致测定结果偏高的均得满分:1)多氯代物、Cl和HCl;2)多氯代物和Cl;3)多氯22代物和HCl;4)多氯代物。凡答出以上任何一种情况,但又提到甲苯的,只得1分。若只答Cl和/或HCl2的,只得1分。5-4(2分)不适用。(1分)氯苯中,Cl原子与苯环共轭,结合紧密,难以被OH−交换下来。(1分)氯苯与碱性水溶液的反应须在非常苛刻的条件下进行,而且氯苯的水解也是非定量的。第6题(12分)6-1(4分)HA在水中存在如下电离平衡:HA=H++A−Ka=1.00×10-4据题意,得如下3个关系式:[HA]+[A−]=3.05×10-3mol·L-1①[H+][A−]/[HA]=1.00×10-4②[H+]=[A−][H+]=5.05×10-4mol·L-1③三式联立,解得:[A−]=[H+]=5.05×10-4mol·L-1,[HA]=2.55×10-3mol·L-1,[OH-]=1.98×10-11mol·L-1,pH=−log[H+]=3.297=3.30计算过程合理得1.5分;每个物种的浓度0.5分;pH0.5分。6-2(4分)HA的二聚反应为:2HA=(HA)2平衡常数K=[(HA)]/[HA]2dim2苯相中,HA的分析浓度为2[(HA)]+[HA]=3.96×10-3mol·L-12B根据苯-水分配常数K=[HA]/[HA]=1.00DBW得[HA]=[HA]=2.55×10-3mol·L-1BW[(HA)]=7.05×10-4mol·L-12K=[(HA)]/[HA]2=7.05×10-4/(2.55×10-3)2=1.08×102dim2计算过程合理得2分;单体及二聚体浓度正确各得0.5分;平衡常数正确得1分(带不带单位不影响得分)。6-3(2分)HA的摩尔质量为(1.00×6.02×1023)/(3.85×1021)=156(g/mol),根据所给信息,推断HA是氯代苯甲酸。\n156-77(CH)-45(羧基)=34,苯环上可能有氯,于是有156-76(CH)-45(羧基)=35,因此HA是6564氯代苯甲酸。推算合理和结论各1分。6-4(2分)在苯中,氯代苯甲酸相互作用形成分子间氢键;二聚体结构如下:原因与结构各1分。第7题(8分)7-1(6分)A第一次放热:4KClO(s)=3KClO(s)+KCl(s)ΔHθ=-144kJ/mol34第二次放热:KClO(s)=KCl(s)+2O(g)ΔHθ=-4kJ/mol42每个方程式1分。方程式写错,不得分;未标或标错物态,扣0.5分;未给出ΔHθ或算错,扣0.5分。第一次放热过程,在上述要求的方程式外,还写出2KClO(s)=2KCl(s)+3O(g),不扣分。32B第一次放热、第二次放热反应的热化学方程式均与A相同。(给出此说明,得分同A)若写方程式,评分标准同A。C2KClO(s)=2KCl(s)+3O(g)ΔHθ=-78kJ/mol32方程式2分。方程式写错,不得分;未标或标错物态,扣0.5分;未给出ΔHθ或算错,扣0.5分。7-2(2分)具有轻微刺激性气味的气体可能是Cl。(1分)2实验方案:(1)将气体通入HNO酸化的AgNO溶液,有白色沉淀生成;(0.5分)33(2)使气体接触湿润的KI-淀粉试纸,试纸变蓝色。(0.5分)若答气体为O和/或ClO,得1分;给出合理的确认方案,得1分。32第8题(4分)8-1(3分)操作步骤:第一步:将反应混合物倾入(冰)水中,搅拌均匀,分离水相和有机相;(0.5分)第二步:水相用乙酸乙酯等极性有机溶剂萃取2-3次后,取水相;(0.5分)第三步:浓缩水相,得到C的粗产品。(1分)理论依据:C是季铵盐离子性化合物,易溶于水,而A和B都是脂溶性化合物,不溶于水。(1分)未答出水相用有机溶剂萃取,不得第二步分;未答浓缩水相步骤,不得第三步分;未答出C是季铵盐离子性化合物或未答出A和B都是脂溶性化合物,扣0.5分。8-2(1分)A含叔胺官能团,B为仲卤代烷,生成C的反应是胺对卤代烷的亲核取代反应。(1分)只要答出取代反应即可得1分。第9题(10分)9-1(5分)AKMnO或KCrO或其他合理的氧化剂;MnO、PCC、PDC、Jones试剂等不行。42272A、B、C、D、和G每式1分。化合物B只能是酸酐,画成其他结构均不得分;化合物C画成\n也得1分化合物D只能是二醇,画成其他结构均不得分;化合物G画成或只得0.5分9-2(2分)由E生成F的反应属于加成反应;由F生成G的反应属于缩合反应。(各1分)由E生成F的反应答为其他反应的不得分;由F生成G的反应答为“分子间消除反应”也得满分,答其他反应的不得分。9-3(3分)G的所有光活异构体(3分)应有三个结构式,其中前两个为内消旋体,结构相同,应写等号或只写一式;三个结构式每式1分;如果将结构写成4个,而没有在内消旋体之间写等号的,或认为此内消旋体是二个化合物的扣0.5分;如果用如下结构式画G的异构体,4个全对,得满分。每错1个扣1分,最多共扣3分。第10题(12分)10-1(2分)画成其他结构均不得分。10-2(5分)\n画成其他结构均不得分。B(2分)化合物B与水反应的化学方程式:或CNOCl+3HO=CNOH+3HClO(3分)333323333方程式未配平得1.5分;产物错不得分。10-3(2分)(2分,每个结构式1分)10-4(3分)或3CO(NH)=CNOH+3NH2233333方程式未配平只得1.5分;产物错不得分。第11题(9分)11-1(3分)A的结构式:(1分)A的结构,必须画出四元环并九元环的并环结构形式;未画出并环结构不得分;甲基位置错误不得分。C的结构式:(1分)C的结构,必须画出四元环并九元环的结构形式;未画出并环结构不得分;环内双键的构型画成顺式不得分,取代基位置错误不得分。C的异构体的结构式:(1分)\nC异构体的结构,必须画出四元环并九元环的结构形式;未画出并环结构不得分;环内双键的构型画成反式不得分;取代基位置错误不得分。11-2(4分)石竹烯的结构式:(2分)石竹烯的结构式,必须画出四元环并九元环的结构形式;未画出并环结构不得分;结构中有二个双键,一个在环内,一个在环外;九元环内的双键的构型必须是反式的;双键位置正确得满分;双键位置错误不得分;甲基位置错误不得分。异石竹烯的结构式:(2分)异石竹烯的结构式,必须画出四元环并九元环的结构形式;未画出并环结构不得分;结构中有二个双键,一个在环内,一个在环外;九元环内的双键的构型必须是顺式的;双键位置正确得满分;双键位置错误不得分;甲基位置错误不得分。11-3(2分)环内双键构型不同,石竹烯九元环中的双键构型为反式的,异石竹烯九元环中的双键构型为顺式的。石竹烯和异石竹烯的结构差别:必须指出石竹烯九元环中的双键构型为反式的,异石竹烯九元环中的双键构型为顺式的;主要差别在于环内双键构型的顺反异构;只要指出双键构型的顺反异构就得满分,否则不得分。注:红色字体为答案,蓝色字体为评分说明。\n中国化学会第22届全国高中学生化学竞赛(省级赛区)试题、标准答案及评分细则2008年9月18日题号1234567891011总分满分14541051114971110100评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。2有效数字错误,扣0.5分,但每大题只扣1次。3单位不写或表达错误,扣0.5分,但每大题只扣1次。4只要求1个答案、而给出多个答案,其中有错误的,不得分。5方程式不配平不得分。6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。第1题(14分)1-1EDTA是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。(1)画出EDTA二钠盐水溶液中浓度最高的阴离子的结构简式。OOCCH2HHH22OOCNCCCCNCOOHHH22HC2COO(2分)\nH答(-OOCCH)NCHCHN(CHCOO-)或CHNH(CHCOO-)得2分,质子必须在氮原子上。222222222H2(2)Ca(EDTA)2溶液可用于静脉点滴以排除体内的铅。写出这个排铅反应的化学方程式(用Pb2+表示铅)。Pb2++Ca(EDTA)2=Ca2++Pb(EDTA)2(1分)(3)能否用EDTA二钠盐溶液代替Ca(EDTA)2溶液排铅?为什么?不能。若直接用EDTA二钠盐溶液,EDTA阴离子不仅和Pb2+反应,也和体内的Ca2+结合造成钙的流失。(答案和原因各0.5分,共1分)1-2氨和三氧化硫反应得到一种晶体,熔点205oC,不含结晶水。晶体中的分子有一个三重旋转轴,有极性。画出这种分子的结构式,标出正负极。HOHNSOHO(2分)硫氧键画成双键或画成S→O,氮硫键画成N→S,均不影响得分。结构式1分,正负号1分。答HNSO、33HN-SO等不得分。正确标出了正负号,如+HNSO、+HN-SO得1分。其他符合题设条件(有三重轴,333333有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。1-3Na[Fe(CN)(NO)]的磁矩为零,给出铁原子的氧化态。Na[Fe(CN)(NO)]是鉴定S2的试剂,二者反应2525得到紫色溶液,写出鉴定反应的离子方程式。Fe(II)答II或+2也可(2分)[Fe(CN)(NO)]2+S2=[Fe(CN)(NOS)]4配合物电荷错误不得分(1分)551-4CaSO2HO微溶于水,但在HNO(1molL1)、HClO(1molL1)中可溶。写出能够解释CaSO在42344酸中溶解的反应方程式。CaSO+H+=Ca2++HSO(1分)44写成2CaSO+2HNO=Ca(NO)+Ca(HSO)也得分。高氯酸同。答案若生成HSO不得分。433242241-5取质量相等的2份PbSO(难溶物)粉末,分别加入HNO(3molL1)和HClO(3molL1),充分混合,434PbSO在HNO能全溶,而在HClO中不能全溶。简要解释PbSO在HNO中溶解的原因。43443Pb2+与NO形成络离子(配离子或配合物)。(1分)3写方程式也可,如PbSO+H++NO-=HSO-+Pb(NO)+。若将络离子(配离子或配合物)写成Pb(NO)434332或Pb(NO)也得分,但方程式须配平。331-6X和Y在周期表中相邻。CaCO与X的单质高温反应,生成化合物B和一种气态氧化物;B与Y的单3质反应生成化合物C和X的单质;B水解生成D;C水解生成E,E水解生成尿素。确定B、C、D、E、X和Y。B:CaCC:CaCND:CH或Ca(OH)E:NHCN[C(NH)也可]2222222X:CY:N(各0.5分,共3分)第2题(5分)化合物X是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。年产量达300万吨的氯酸钠是生产X的原料,92%用于生产X—在酸性水溶液中用盐酸、二氧化硫或草酸还原。\n此外,将亚氯酸钠固体装柱,通入用空气稀释的氯气氧化,也可生产X。X有极性和顺磁性,不形成二聚体,在碱性溶液里可发生歧化反应。2-1写出X的分子式和共轭π键(m)。nClO5(各1分,共2分)232-2分别写出上述用草酸还原和用氯气氧化生产X的反应方程式。2ClO+HCO+2H+=2ClO+2CO+2HO(1分)3224222或2NaClO+HCO+HSO=2ClO+2CO+NaSO+2HO322424222422NaClO+Cl=2ClO+2NaCl(1分)222NaClO是固体,写成ClO,不得分。222-3写出上述X歧化反应的化学方程式。2ClO+2NaOH=NaClO+NaClO+HO(1分)2232或2ClO+2OH=ClO+ClO+HO2232第3题(4分)甲醛是一种重要的化工产品,可利用甲醇脱氢制备,反应式如下:催化剂,700oCCHOH(g)CHO(g)+H(g)H=84.2kJmol-1(1)322rm向体系中通入空气,通过以下反应提供反应(1)所需热量:H(g)+½O(g)HO(g)H=–241.8kJmol-1(2)222rm要使反应温度维持在700˚C,计算进料中甲醇与空气的摩尔数之比。已知空气中氧气的体积分数为0.20。要使反应维持在一定温度持续进行,应保证反应(2)放出的热量恰好被反应(1)全部利用,则:甲醇与氧气的摩尔比为:n(CHOH):n(O)=(2241.8)/84.2=5.74(2分)32甲醇与空气的摩尔比为:n(CHOH):n(空气)=5.74/5=1.1(2分)3答成1.15或1.148得1.5分。答(写)成1:0.87也得2分。考虑到实际情况,将上式的等号写成小于或小于等于,得2分。算式合理,结果错误,只得1分。只有结果没有计算过程不得分。第4题(10分)(CN)被称为拟卤素,它的阴离子CN作为配体形成的配合物有重要用途。24-1HgCl和Hg(CN)反应可制得(CN),写出反应方程式。222HgCl+Hg(CN)=HgCl+(CN)(1分)222224-2画出CN、(CN)的路易斯结构式。2[]CNNCCN(各1分,共2分)短线画成电子对同样得分;不画孤对电子不得分。4-3写出(CN)(g)在O(g)中燃烧的反应方程式。22(CN)(g)+2O(g)=2CO(g)+N(g)(1分)2222不标物态也可。4-4298K下,(CN)(g)的标准摩尔燃烧热为1095kJmol1,CH(g)的标准摩尔燃烧热为1300kJ222mol1,CH(g)的标准摩尔生成焓为227kJmol1,HO(l)的标准摩尔生成焓为286kJmol1,计算(CN)2222(g)的标准摩尔生成焓。\n(CN)(g)+2O(g)=2CO(g)+N(g)22222ΔH(CO)ΔH[(CN)]=1095kJmol1fm2fm22ΔH(CO)=1095kJmol1+ΔH[(CN)]fm2fm2CH(g)+2.5O(g)=2CO(g)+HO(l)222222ΔH(CO)+ΔH(HO)ΔH(CH)=1300kJmol-1fm2fm2fm222ΔH(CO)=1300kJmol1+286kJmol1+227kJmol1fm2ΔH[(CN)]=1095kJmol11300kJmol1+286kJmol1+227kJmol1fm2=308kJmol1(2分)计算过程正确计算结果错误只得1分。没有计算过程不得分。ΔH[(CN)]=10951300+286+227=308(kJmol1)也可以。fm2但不加括号只得1.5分。4-5(CN)在300~500oC形成具有一维双链结构的聚合物,画出该聚合物的结构。2NNNNC或CCC(2分)CCCCNnNNN画成NNNNNNNNNNNN也得2分。但画成只得1分。4-6电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN,写出化学方程式(漂白粉用ClO表示)。2CN+5ClO+HO=2HCO+N+5Cl(2分)232产物中写成CO2只要配平,也得分。3第5题(5分)1963年在格陵兰Ika峡湾发现一种水合碳酸钙矿物ikaite。它形成于冷的海水中,温度达到8oC即分解为方解石和水。1994年的文献指出:该矿物晶体中的Ca2+离子被氧原子包围,其中2个氧原子来自同一个碳酸根离子,其余6个氧原子来自6个水分子。它的单斜晶胞的参数为:a=887pm,b=823pm,c=1102pm,β=110.2°,密度d=1.83gcm3,Z=4。5-1通过计算得出这种晶体的化学式。ikaite晶胞体积:V=abcsinβ=(8.878.2311.0210-24cm3)sin110.2°=7.5510-22cm3(0.5分)设晶胞中含有n个水分子,晶胞的质量:m=4(100+18n)/N(g)(0.5分)A晶体密度:d=m/V=4(100+18n)/(6.0210237.5510-22)(gcm3)=1.83gcm-3100+18n=208n=6(0.5分)该晶体的化学式为CaCO6HO(0.5分)32算出6个水分子,未写化学式,得1.5分。5-2研究了这种晶体在加压下受热膨胀体积增大的情形,并与冰及钙离子配位数也是8的二水合石膏晶体(gypsum)作了对比,结果如下图所示(纵坐标为相对体积):\niceikaitegypsum为什么选取冰和二水合石膏作对比?实验结果说明什么?Ikaite在冷水中形成,而且含有大量结晶水,分解温度又接近冰的熔点,可能与冰的结构有相似性,故选取冰作参比物;(0.5分)石膏是带结晶水的钙的含氧酸盐,而且钙的配位数也是8,可能与ikaite结构相似,故选取石膏作参比物。(0.5分)实验结果说明ikaite的结构跟冰相似。(1分)实验结果,说明含水的摩尔分数越大膨胀越大,可以得0.5分。5-3这种晶体属于哪种类型的晶体?简述理由。分子晶体。(0.5分)答混合型晶体不得分。晶体分解温度接近冰的熔点,体积随温度的变化趋势也接近冰,可认为晶体中的化学微粒是CaCO36HO,它们以分子间作用力(氢键和范德华力)构成晶体。(0.5分)2第6题(11分)在900oC的空气中合成出一种含镧、钙和锰(摩尔比2:2:1)的复合氧化物,其中锰可能以+2、+3、+4或者混合价态存在。为确定该复合氧化物的化学式,进行如下分析:6-1准确移取25.00mL0.05301molL1的草酸钠水溶液,放入锥形瓶中,加入25mL蒸馏水和5mL6molL1的HNO溶液,微热至60~70oC,用KMnO溶液滴定,消耗27.75mL。写出滴定过程发生的反应的方34程式;计算KMnO溶液的浓度。42MnO+5CO2+16H+=2Mn2++10CO+8HO(1分)42422KMnO溶液浓度:(2/5)0.0530125.00/27.75=0.01910(molL1)(1分)4反应方程式反应物CO2-写HCO,只要配平,也得1分。下同。242246-2准确称取0.4460g复合氧化物样品,放入锥形瓶中,加25.00mL上述草酸钠溶液和30mL6molL1的HNO溶液,在60~70oC下充分摇动,约半小时后得到无色透明溶液。用上述KMnO溶液滴定,消耗3410.02mL。根据实验结果推算复合氧化物中锰的价态,给出该复合氧化物的化学式,写出样品溶解过程的反应方程式。已知La的原子量为138.9。根据:化合物中金属离子摩尔比为La:Ca:Mn=2:2:1,镧和钙的氧化态分别为+3和+2,锰的氧化态为+2~+4,初步判断复合氧化物的化学式为LaCaMnO,其中x=0~1。(1分)226+x滴定情况:加入CO2总量:25.00mL0.05301molL1=1.3253mmol(0.5分)24样品溶解后,滴定消耗高锰酸钾:10.02mL0.01910molL1=0.1914mmol(0.5分)样品溶解后剩余CO2量:0.1914mmol5/2=0.4785mmol(0.5分)24样品溶解过程所消耗的CO2量:1.3253mmol0.4785mmol=0.8468mmol(0.5分)24若将以上过程合并,推论合理,结果正确,也得2分。在溶样过程中,CO2变为CO给出电子:242\n20.8468mmol=1.694mmol(0.5分)有两种求解x的方法:(1)方程法:复合氧化物(LaCaMnO)样品的物质的量为:226+x0.4460g/[(508.9+16.0x)gmol1](0.5分)LaCaMnO中,锰的价态为:[2(6+x)2322]=(2+2x)(1分)226+x溶样过程中锰的价态变化为:(2+2x2)=2x(0.5分)锰得电子数与CO2给电子数相等:242x0.4460g/[(508.9+16.0x)gmol1]=20.8468103mol(1分)x=1.0121(0.5分)如果将以上步骤合并,推导合理,结果正确,也得3.5分;如果将以上步骤合并,推导合理但结果错误,得2分;推导错误,即便结果吻合,也不得分。(2)尝试法因为溶样过程消耗了相当量的CO2,可见锰的价态肯定不会是+2价。若设锰的价态为+3价,24相应氧化物的化学式为LaCaMnO,此化学式式量为516.9gmol-1,称取样品的物质的量为:226.50.4460g/(516.9gmol-1)=8.628104mol(0.5分)在溶样过程中锰的价态变化为1.689103mol/(8.628104mol)=1.96(0.5分)锰在复合氧化物中的价态为:2+1.96=3.96(0.5分)3.96与3差别很大,+3价假设不成立;(0.5分)而结果提示Mn更接近于+4价。(0.5分)若设Mn为+4价,相应氧化物的化学式为LaCaMnO,此化学式式量为524.9gmol-1。227锰在复合氧化物中的价态为:2+20.8468103/(0.4460/524.9)=3.994(0.5分)假设与结果吻合,可见在复合氧化物中,Mn为+4价。(0.5分)如果将以上步骤合并,推导合理,结果正确,也得3.5分;如果将以上步骤合并,推导合理但结果错误,得2分;推导错误,即便结果吻合,也不得分。该复合氧化物的化学式为LaCaMnO(1分)227溶样过程的反应方程式为:LaCaMnO+CO2+14H+=2La3++2Ca2++Mn2++2CO+7HO(1分)2272422未经计算得出LaCaMnO,方程式正确,只得方程式的1分。227第7题(14分)AX四面体(A为中心原子,如硅、锗;X为配位原子,如氧、硫)在无机化合物中很常见。4四面体T按下图所示方式相连可形成一系列“超四面体”(T、T···):123\nTTT1237-1上图中T、T和T的化学式分别为AX、AX和AX,推出超四面体T的化学式。123441010204T超四面体的化学式为AX(1分)420357-2分别指出超四面体T、T中各有几种环境不同的X原子,每种X原子各连接几个A原子?在上述两34种超四面体中每种X原子的数目各是多少?T超四面体中,有3种不同环境的X原子。(1分)3其中4个X原子在顶点上,所连接A原子数为1;(0.5分)12个X原子在超四面体的边上,所连接A原子数为2;(0.5分)4个原子在超四面体的面上,所连接A原子数为3。(1分)(共3分)T超四面体中有5种不同环境的X原子。(2分)4其中4个X原子在顶点上,所连接A原子数为1;(0.5分)12个X原子在超四面体的边上但不在边的中心,所连接A原子数为2;(0.5分)6个X原子在超四面体的边的中心,所连接A原子数为2;(0.5分)12个原子在超四面体的面上,所连接A原子数为3;(0.5分)1个在超四面体的中心,所连接A原子数为4。(1分)(共5分)7-3若分别以T、T、T、T为结构单元共顶点相连(顶点X原子只连接两个A原子),形成无限三维结1234构,分别写出所得三维骨架的化学式。化学式分别为AX,AX,AX,AX。(每式0.5分,共2分)24810182033答分别为AX,AX,AX,AX也可。225920337-4欲使上述T超四面体连接所得三维骨架的化学式所带电荷分别为+4、0和4,A选Zn2+、In3+或3Ge4+,X取S2-,给出带三种不同电荷的骨架的化学式(各给出一种,结构单元中的离子数成简单整数比)。AX4+只能是GeS4+;(1分)10181018AX可以是ZnGeS,InZnGeS,InGeS;(1分)1018281827184618只要答出其中一种,得1分;AX4可以是1018ZnGeS4,InGeS4,InZnGeS4,InZnGeS4,InZnGeS4;(1分)4618821863184241823518只要答出其中一种,得1分。\n第8题(9分)由烷基镁热分解制得镁的氢化物。实验测定,该氢化物中氢的质量分数为7.6%,氢的密度为0.101gcm3,镁和氢的核间距为194.8pm。已知氢原子的共价半径为37pm,Mg2+的离子半径为72pm。8-1写出该氢化物中氢的存在形式,并简述理由。H(1分)镁-氢间距离为194.8pm,Mg2+离子半径为72pm,则氢的半径为194.8pm-72pm=123pm。此值远大于氢原子的共价半径,这说明H原子以H离子的形式存在。(1分)8-2将上述氢化物与金属镍在一定条件下用球磨机研磨,可制得化学式为MgNiH的化合物。X-射线衍射24分析表明,该化合物的立方晶胞的面心和顶点均被镍原子占据,所有镁原子的配位数都相等。推断镁原子在MgNiH晶胞中的位置(写出推理过程)。24Mg原子与Ni原子数之比为2:1,故每个晶胞中含8个镁原子。所有镁原子的配位数相等,它们只能填入由镍原子形成的四面体空隙。(3分)镁原子的位置用下列坐标参数表示也得3分:14,14,14;14,14,34;34,34,14;34,34,34;14,34,14;14,34,34;34,14,14;34,14,34。坐标错一组,扣0.5分,不得负分。其他答案不得分。8-3实验测定,上述MgNiH晶体的晶胞参数为646.5pm,计算该晶体中镁和镍的核间距。已知镁和镍的24原子半径分别为159.9pm和124.6pm。镁镍间的距离为11d3a3646.5pm279.9pm(2分)Mg-Ni44算式及答案皆正确(包括单位)得2分;算式对但结果错;只得1分;结果中数对但单位错,得1.5分。用原子半径相加计算镁-镍间的距离,不得分。8-4若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,计算MgNiH的储氢能力(假定氢24可全部放出;液氢的密度为0.0708gcm3)。储氢能力=晶体的密度×氢的质量分数÷液氢密度4MMgNiH3.622/10024Na30.0708gcm-3(2分)A4111.34gmol-13.622/1006.0221023mol-1(6.46510-8cm)30.0708gcm-3=1.40=1.4算法及结果皆正确得2分;算法(式)正确但结果错得1分;无过程不得分。只有结果但无算式,不得分。氢的原子量取1不取1.008,算出结果1.39,只得1.5分。第9题(7分)化合物A、B和C互为同分异构体。它们的元素分析数据为:碳92.3%,氢7.7%。1molA在氧气中充分燃烧产生179.2L二氧化碳(标准状况)。A是芳香化合物,分子中所有的原子共平面;B是具有两个支链的链状化合物,分子中只有两种不同化学环境的氢原子,偶极矩等于零;C是烷烃,分子中碳原子的化学环境完全相同。9-1写出A、B和C的分子式。CH(1分)88其他答案不得分。\n9-2画出A、B和C的结构简式。A的结构简式:CHCH2或(2分)HCCH写成H或键线式也得分;苯环画成也可,其他答案不得分。B的结构简式:HCCCH3CCHCC3CH(2分)写成键线式也得分;其他答案不得分。C的结构简式:HCCHHCCHHCCHHCCH(2分)HHHCCHCCHCCHCC写成HH,或写成键线式,其他答案不得分。第10题(11分)化合物A、B、C和D互为同分异构体,分子量为136,分子中只含碳、氢、氧,其中氧的含量为23.5%。实验表明:化合物A、B、C和D均是一取代芳香化合物,其中A、C和D的芳环侧链上只含一个官能团。4个化合物在碱性条件下可以进行如下反应:NaOH溶液酸化AE(CHO)+F762NaOH溶液酸化BG(CHO)+H78NaOH溶液酸化CI(芳香化合物)+JNaOH溶液DK+H2O10-1写出A、B、C和D的分子式。CHO(1分)882\n10-2画出A、B、C和D的结构简式。A的结构简式:OCOOCH3OCH3或(1分)若写成CHCOOCH也得分。653B的结构简式:OCH2OCHCH2OCHO或(1分)若写成CHCHOCHO也得分。652C的结构简式:OOCCH3OCOCH3或(1分)若写成CHOCOCH也得分。653D的结构简式:OHCHCOOH2O或(1分)若写成CHCHCOOH也得分。65210-3A和D分别与NaOH溶液发生了哪类反应?A与NaOH溶液发生了酯的碱性水解反应。(0.5分)答碱性水解反应、酯的水解反应或水解反应、皂化、取代反应也得0.5分。D与NaOH溶液发生了酸碱中和反应。(0.5分)答酸碱反应或中和反应也得0.5分;其他答案不得分。10-4写出H分子中官能团的名称。醛基和羧基。各0.5分(共1分)10-5现有如下溶液:HCl、HNO、NHHO、NaOH、NaHCO、饱和Br水、FeCl和NHCl。从中选择3323234合适试剂,设计一种实验方案,鉴别E、G和I。由题目给出的信息可推出:E是苯甲酸,G是苯甲醇,I是苯酚。根据所给试剂,可采用如下方案鉴定。方案1:取3个试管,各加2mL水,分别将少许E、G、I加入试管中,再各加1-2滴FeCl溶液,呈现蓝紫3色的试管中的化合物为苯酚I。(2分)另取2个试管,各加适量NaOH溶液,分别将E和G加入试管中,充分振荡后,不溶于NaOH溶液的化合物为苯甲醇G,溶于NaOH溶液的化合物为苯甲酸E。(2分)方案2:取3个试管,各加2mL水,分别将少许E、G、I加入试管中,再各加几滴溴水,产生白色沉淀的试管中的化合物为苯酚I;(2分)\n另取2个试管,各加适量NaOH溶液,分别将E和G加入试管中,充分振荡后,不溶于NaOH溶液的为苯甲醇G。溶于NaOH溶液的为苯甲酸E。(2分)方案3:取3个试管,各加2mL水,分别将少许E、G、I加入试管中,再各加1-2滴FeCl溶液,呈现蓝紫3色的试管中的化合物为苯酚I。(2分)另取2个试管,各加适量NaHCO溶液,分别将E和G加到试管中。加热,放出气体的试管中的化3合物为苯甲酸E。(2分)方案4;取3个试管,各加2mL水,分别将少许E、G、I加入试管中,再各加几滴溴水,产生白色沉淀的试管中的化合物为苯酚I;(2分)另取2个试管,各加适量NaHCO溶液,分别将E和G加入试管中。加热,放出气体的试管中的化3合物为苯甲酸E。(2分)方案5:取3个试管,各加适量NaOH溶液,分别将E、G和I加到试管中,充分振荡后,不溶于NaOH溶液的化合物为苯甲醇G,溶于NaOH溶液的化合物为苯甲酸E或苯酚I。(2分)另取2个试管,各加适量NaHCO溶液,分别将E、I加入试管中。加热,放出气体的试管中的化合3物为苯甲酸E。(2分)答出以上5种方案中的任何一种均给分。其他合理方法也得分,但必须使用上列试剂。第11题(10分)1941年从猫薄荷植物中分离出来的荆芥内酯可用作安眠药、抗痉挛药、退热药等。通过荆芥内酯的氢化反应可以得到二氢荆芥内酯,后者是有效的驱虫剂。为研究二氢荆芥内酯的合成和性质,进行如下反应:CHOCrOCHOH,H+3A3BHSO,丙酮,0oC24HBr1.LiOH,CHOHLiAlH4C3DE过氧化物2.H+,无水四氢呋喃写出A、B、C、D和E的结构简式(不考虑立体异构体)。OCOOHCOOCH3COOCH3OOHOHBrABCDE每个结构简式2分(共10分)D画成下面的结构简式得1分。OOHOH\nE答如下结构也可:OH-OOO-中国化学会第23届全国高中学生化学竞赛(省级赛区)试题、标准答案及评分细则2009年9月16日题号12345678910总分满分20654810816815100评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。2有效数字错误,扣0.5分,但每大题只扣1次。3单位不写或表达错误,扣0.5分,但每大题只扣1次。4只要求1个答案、而给出多个答案,其中有错误的,不得分。5方程式不配平不得分。6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。第1题(20分)1-1Lewis酸和Lewis碱可以形成酸碱复合物。根据下列两个反应式判断反应中所涉及Lewis酸的酸性强弱,并由强到弱排序。FSiN(CH)+BFFBN(CH)+SiF;43333334FBN(CH)+BClClBN(CH)+BF33333333BClBFSiF顺序错误不给分(2分)3341-2(1)分别画出BF和N(CH)的分子构型,指出中心原子的杂化轨道类型。333FFBF分子构型为平面三角形,不画成平面形不给分(0.5分)\nsp2(0.5分)NCHHC33CH3分子构型为三角锥形,不画成三角锥形不给分(0.5分)sp3(0.5分)(2)分别画出FBN(CH)和FSiN(CH)的分子构型,并指出分子中Si和B的杂化轨道类型。333433FFFBNHC3CHH3C3B:sp3(1分)+(1分)FFFSiFNHC3CHH3C3Si,sp3d(1分)+(1分)1-3将BCl分别通入吡啶和水中,会发生两种不同类型的反应。写出这两种反应的化学方程式。3BCl+3HO=B(OH)+3HCl不配平不给分(1分)323BCl+CHN=ClB-NCH355355或BCl3+N=Cl3BN(1分)1-4BeCl是共价分子,可以以单体、二聚体和多聚体形式存在。分别画出它们的结构简式,并指出Be的2杂化轨道类型。ClBeClsp结构简式和杂化轨道各0.5分(1分)ClClBeBeClCl结构简式1.5分sp2杂化轨道0.5分(2分)ClClBeBeClCl结构简式1.5分sp3\n杂化轨道0.5分画成ClBeCln也得分(2分)1-5高氧化态Cr的过氧化物大多不稳定,容易分解,但Cr(O)[NH(CHNH)]却是稳定的。这种配合物222422仍保持Cr的过氧化物的结构特点。画出该化合物的结构简式,并指出Cr的氧化态。HN2OOOCrNHOHN2只有画出7配位的结构简式才能得满分,端基氮不配位得0分,二级氮不配位得1分(2分)Cr的氧化态为+4(1分)1-6某些烷基取代的金属羰基化合物可以在其他碱性配体的作用下发生羰基插入反应,生成酰基配合物。画出Mn(CO)(CH)和PPh反应的产物的结构简式,并指出Mn的氧化态。533OCOOCCCH3MnOCPPh3CO(1分)不要求配体的位置Mn的氧化态为+1(1分)第2题(6分)下列各实验中需用浓HCl而不能用稀HCl溶液,写出反应方程式并阐明理由。2-1配制SnCl溶液时,将SnCl(s)溶于浓HCl后再加水冲稀。22SnCl+2HCl=SnCl2-+2H+24不配平不给分(1分)浓HCl的作用是形成SnCl2-,可防止Sn(OH)Cl的形成,抑制SnCl水解。(1分)42写配平的水解方程式,加浓盐酸平衡向左移动,抑制水解也得分2分2-2加热MnO的浓HCl溶液制取氯气。2MnO+4HCl=MnCl+Cl+2HO2222不配平不给分(1分)加浓HCl利于升高MnO的氧化电位,降低Cl-的还原电位,使反应正向进行。2\n表述为提高MnO氧化性,同时提高HCl还原性,也可以。2二个理由各0.5分(1分)2-3需用浓HCl溶液配制王水才能溶解金。Au+HNO+4HCl=HAuCl+NO+2HO342(1分)加浓HCl利于形成AuCl-,降低Au的还原电位,提高硝酸的氧化电位,使反应正向进行。4表述为提高Au的还原性,提高硝酸的氧化性,有利于反应向右进行,也得满分。二个理由各0.5分(1分)第3题(5分)用化学反应方程式表示:3-1用浓氨水检查氯气管道的漏气;(1)2NH+3Cl=N+6HCl322(2)NH+HCl=NHCl(白烟)34每个反应式各1分,不配平不给分(2分)合并成一个反应也得分。得到N得1分,得到NHCl得1分。243-2在酸性介质中用锌粒还原CrO2-离子时,溶液颜色经绿色变成天蓝色,放置后溶液又变为绿色。27(1)3Zn+CrO2-+14H+=3Zn2++2Cr3+(绿)+7HO272(2)Zn+2Cr3+=Zn2++2Cr2+(天蓝)(3)4Cr2++O+4H+=4Cr3+(绿)+2HO22或2Cr2++2H+=2Cr3+(绿)+H2每个反应式各1分,不配平不给分(3分)第4题(4分)我国石油工业一般采用恒电流库伦分析法测定汽油的溴指数。溴指数是指每100克试样消耗溴的毫克数,它反映了试样中C=C的数目。测定时将V(毫升)试样加入库伦分析池中,利用电解产生的溴与不饱和烃反应。当反应完全后,过量溴在指示电极上还原而指示终点。支持电解质为LiBr,溶剂系统仅含5%水,其余为甲醇、苯与醋酸。设d为汽油试样密度,Q为终点时库伦计指示的溴化反应消耗的电量(库伦)。4-1导出溴指数与V、d和Q的关系式(注:关系式中只允许有一个具体的数值)。Q79.90gmol-1×1000mg×g-1溴指数=××100V×d96500Cmol-1Q=×82.8mgC-1V×d(2分)4-2若在溶剂体系中增加苯的比例,说明其优缺点。优点:增加汽油溶解度,有利于烯烃的加成过程;(1分)缺点:降低溶液电导,将使库伦仪输出电压增加。(1分)第5题(8分)皂化当量是指每摩尔氢氧根离子所能皂化的酯(样品)的质量(mg)。可用如下方法测定皂化当量(适用范围:皂化当量100-1000mgmol-1,样品量5-100mg):准确称取X(mg)样品,置于皂化瓶中,加入适量0.5molL-1氢氧化钾醇溶液,接上回流冷凝管和碱石灰管,加热回流0.5~3小时;皂化完成后,用1~2mL乙醇淋洗冷凝管内壁,拆去冷凝管,立即加入5滴酚酞,用0.5molL-1盐酸溶液酸化,使酸稍过量;将酸化后的溶液转移到锥形瓶中,用乙醇淋洗皂化瓶数遍,洗涤完的醇溶液也均移入锥形瓶中;向锥形瓶滴加0.5molL-1氢氧化钾醇溶液,直至溶液显浅红色;然后用0.0250molL-1盐酸溶液滴定至刚好无色,消耗盐酸V(mL);再加入3滴溴酚蓝指示剂,溶液显蓝色,用0.0250molL-1盐酸溶液滴定至刚刚呈现绿1色,即为滴定终点,消耗盐酸V(mL)。2在没有酯存在下重复上述实验步骤,消耗标准盐酸溶液分别为V和V(mL)。34\n5-1碱石灰管起什么作用?防止空气中的二氧化碳进入试样溶液,否则会在溶液中产生碳酸盐,后者不能使酯发生皂化反应却在酚酞无色时以碳酸氢根存在导致滴定结果有正误差。(2分)5-2写出计算皂化当量的公式。X(mg)皂化当量(V-V)(mL)×0.0250(molL-1)24(3分)5-3样品中的游离羧酸将对分析结果有什么影响?如何消除影响?样品中的游离羧酸会降低皂化当量。要消除这种影响,可另取一份样品,不必皂化,其它按上述测定步骤进行操作,然后将第二次滴定所消耗的0.025molL-1盐酸标准溶液的毫升数,自皂化样品滴定时所消耗的0.025molL-1标准盐酸溶液的毫升数中减去,以进行校正。其中空白实验2分(3分)第6题(10分)6-1文献中常用下图表达方解石的晶体结构:图中的平行六面体是不是方解石的一个晶胞?简述理由。不是。(1分)晶体的平移性决定了晶胞的8个顶角必须相同,平行棱的结构必须相同,平行面的结构必须相同,而该平行六面体平行棱上的碳酸根离子的取向是不同的。(1分)6-2文献中常用下图表达六方晶体氟磷灰石的晶体结构:该图是c轴投影图,位于图中心的球是氟,大球是钙,四面体是磷酸根(氧原子未画出)。试以此图为基础用粗线画出氟磷灰石晶胞的c轴投影图,设晶胞顶角为氟原子,其他原子可不补全。\n(2分)6-3某晶体的晶胞参数为:a=250.4pm,c=666.1pm,γ=120o;原子A的原子坐标为0,0,1/2和1/3,2/3,0,原子B的原子坐标为1/3,2/3,1/2和0,0,0。(1)试画出该晶体的晶胞透视图(设晶胞底面即ab面垂直于纸面,A原子用“○”表示,B原子用“●”表示)。或(2分)(2)计算上述晶体中A和B两原子间的最小核间距d(AB)。d(AB)=250.4pm0.5cos30o=144.6pm只要有计算过程,得出正确的核间距(2分)(3)共价晶体的导热是共价键的振动传递的。实验证实,该晶体垂直于c轴的导热性比平行于c轴的导热性高20倍。用上述计算结果说明该晶体的结构与导热性的关系。因为该晶体的c=666.1pm,是AB最短核间距的4.6倍,其间不可能有共价键,只有范德华力,该晶体属层状晶体,难以通过由共价键振动传热。(2分)第7题(8分)1964年,合成大师Woodward提出了利用化合物A(CH)作为前体合成一种特殊的化合1010物B(CH)。化合物A有三种不同化学环境的氢,其数目比为6:3:1;化合物B分子中所有氢的化学环境106相同,B在质谱仪中的自由区场中寿命约为1微秒,在常温下不能分离得到。三十年后化学家们终于由A合成了第一个碗形芳香二价阴离子C,[CH]2-。化合物C中六个氢的化学环境相同,在一定条件下可以106转化为B。化合物A转化为C的过程如下所示:n-BuLi,t-BuOK,n-CHMeLiCH614[CH]2-2K+Me3SnX2-+1010106[C10H6]2LiA(CH3)2NCH2CH2N(CH3)2C2H5OC2H5CH3OCH2CH2OCH3n-CH-78oCC2Li+6147-1A的结构简式:其他答案不得分。(2分)7-2B的结构简式:\n或只要答出其中一种,得2分;(2分)7-3C的结构简式:2-只要答出其中一种,得2分;(2分)2-得1分7-4B是否具有芳香性?为什么?B不具有芳香性。(1分)因为不符合4n+2规则。(1分)第8题(16分)8-1化合物A是一种重要化工产品,用于生产染料、光电材料和治疗疣的药物等。A由第一、二周期元素组成,白色晶体,摩尔质量114.06g/mol,熔点293oC,酸常数pK=1.5,pK=3.4;酸根离子a1a2A2中同种化学键是等长的,存在一根四重旋转轴。(1)画出A的结构简式。HOOHOOA其他答案不得分。(2分)(2)为什么A2离子中同种化学键是等长的?A2-环内的π电子数为2,符合4n+2规则,具有芳香性,π电子是离域的,可记为10,因而同8种化学键是等长的。(2分)(3)A2离子有几个镜面?5(2分)\n8-2顺反丁烯二酸的四个酸常数为1.17x102,9.3x104,2.9x105和2.60x107。指出这些常数分别是哪个酸的几级酸常数,并从结构与性质的角度简述你做出判断的理由。HOOCHOOCCOOHCOOHK=1.17×10-2K=9.3×10-411K=2.60×10-7K=2.9×10-522共4个酸常数,每个0.5分(2分)顺式丁烯二酸发生一级电离后形成具有对称氢键的环状结构,十分稳定,既使一级电离更容易,又使二级电离更困难了,因而其K最大,K最小。(2分)128-3氨基磺酸是一种重要的无机酸,用途广泛,全球年产量逾40万吨,分子量为97.09。晶体结构测定证实分子中有三种化学键,键长分别为102、144和176pm。氨基磺酸易溶于水,在水中的酸常数K=1.01ax101,其酸根离子中也有三种键长,分别为100、146和167pm。(1)计算0.10molL-1氨基磺酸水溶液的pH值;c/K=0.1/10-1<500,K=[H+]2/(c-[H+]),[H+]=0.062molL-1pH=1.21(2分)(2)从结构与性质的关系解释为什么氨基磺酸是强酸?N-S键中的电子由于磺酸根强大的吸电子效应使H-N键极性大大增大,而且去质子后N-S缩短,导致H-N很容易电离出氢离子。(2分)(3)氨基磺酸可用作游泳池消毒剂氯水的稳定剂,这是因为氨基磺酸与Cl的反应产物一氯代物能缓慢2释放次氯酸。写出形成一氯代物以及一氯代物与水反应的方程式。HNSO+Cl=HClNSO+HClHClNSO+HO=HClO+HNSO3322323233每个方程式1分(2分)第9题(8分)请根据以下转换填空:(1)(2)ABC光照D9-1(1)的反应条件(1)的反应类别(2)的反应类别加热狄尔斯-阿尔德(Diels-Alder)反应还原反应其他答案不得分。答环加成反应、二聚反应也给分;答催化氢化、加成反应也给分;(0.5分)(0.5分)(0.5分)\n9-2分子A中有个一级碳原子,有个二级碳原子,有个三级碳原子,有个四级碳原子,至少有个氢原子共平面。2,0,4,1,4.每空0.5分(2.5分)9-3B的同分异构体D的结构简式是:只要正确表达出双键加成就可得分。其他答案不得分。(2分)9-4E是A的一种同分异构体,E含有sp、sp2、sp3杂化的碳原子,分子中没有甲基,E的结构简式是:CH2CHCCCHCCH2CCH2CH2C答出1个就得满分。错1个扣0.5分。(2分)第10题(15分)高效低毒杀虫剂氯菊酯(I)可通过下列合成路线制备:OHCH3OHCHHCSOH3AlCl33A(CH)+B(CHOCl)3ClCCHCHC=CHClCCHCH=CCH482332233CDClCHCOOCHCH323CHC(OCH)CHCHONa3253ClC=CHCHCCHCOOCHCH32Cl2223CHOH25ClCH3EFClClCOONaHCOOCH2+N(CHCH)+NaClNaOH233ClClCHOHO25CH3GI10-1(1)化合物A能使溴的四氯化碳溶液褪色且不存在几何异构体。A的结构简式HC3CCH2HC3其他答案不得分。(1分)B的结构简式\nHCOClC3其他答案不得分。(1分)10-2化合物E的系统名称3,3-二甲基-4,6,6-三氯-5-己烯酸乙酯。其他答案不得分。(2分)化合物I中官能团的名称卤原子、碳碳双键、酯基、醚键。共4种官能团,每个0.5分。写错1个扣0.5分。(2分)10-3由化合物E生成化合物F经历了步反应,每步反应的反应类别分别是。2其他答案不得分。(1分)酸碱反应(亲核)取代反应。共2个反应类别,每个0.5分。(1分)10-4在化合物E转化成化合物F的反应中,能否用NaOH/CHOH代替CHONa/CHOH252525溶液?为什么?不能其他答案不得分。(1分)因为酯会发生皂化反应、NaOH的碱性不够强(不能在酯的位生成碳负离子)、烯丙位的氯会被取代、双键可能重排等等。答出二种或二种以上给满分。(2分)10-5(1)化合物G和H反应生成化合物I、N(CHCH)和NaCl,由此可推断:233H的结构简式+CHN(CHCH)2233OCl-其他答案不得分。(1分)H分子中氧原子至少与个原子共平面。11其他答案不得分。(1分)10-6芳香化合物J比F少两个氢,J中有三种不同化学环境的氢,它们的数目比是921,则J可能的结构为(用结构简式表示):\nC(CH)C(CH)C(CH)C(CH)33333333ClClHOOHClClHOOHClClClClOOHOOHOC(CH)OC(CH)3333ClClOOC(CH)OOC(CH)3333ClClClClOHOHClCl答出1个就得2分,答错1个扣0.5分(2分)中国化学会第24届全国高中学生化学竞赛(省级赛区)试卷、答案及评分标准(2010年9月15日)\n题号1234567891011总分满分155781181361179100评分通则1.凡要求计算或推导的,必须示出计算或推导过程。没有计算或推导过程,即使结果正确也不得分。2.有效数字错误,扣0.5分,但每一大题只扣1次。3.单位不写或表达错误,扣0.5分,但每一大题只扣1次。4.只要求1个答案、而给出多个答案,其中有错误的,不得分。5.方程式(不是反应式!)不配平不得分。6.用铅笔解答(包括作图)无效。7.使用涂改液涂改的解答无效。8.不包括在标准答案的0.5分的题,可由省、市、自治区评分组讨论决定是否给分。9.答案中红色字为标准答案,而蓝字体(加下划线)为注释语不属于答案。元素周期表HHe1.0084.003LiBeBCNOFNe6.9419.01210.8112.0114.0116.0019.0020.18NaMgAlSiPSClAr22.9924.3126.9828.0930.9732.0735.4539.95KCaScTiVCrMnFeCoNiCuZnGaGeAsSeBrKr39.1040.0844.9647.8850.9452.0054.9455.8558.9358.6963.5565.3969.7272.6174.9278.9679.9083.80RbSrYZrNbMoTcRuRhPdAgCdInSnSbTeIXe85.4787.6288.9191.2292.9195.9498.91101.1102.9106.4107.9112.4114.8118.7121.8127.6126.9131.3CsBa-HfTaWReOsIrPtAuHgTlPbBiPoAtRn132.9137.3LaLu178.5180.9183.9186.2190.2192.2195.1197.0200.6204.4207.2209.0[210][210][210][222]FrRa[223][226]Ac-LrRfDbSgBhHsMtDsRgCnUutUuqUupUuhUusUuoLaCePrNdPmSmEuGdTbDyHoErTmYbLuAcThPaUNpPuAmCmBkCfEsFmMdNoLr气体常数R=8.31447JK1mol1法拉第常数F=96485Cmol1阿佛加德罗常数N=6.022142×1023mol1A第1题(15分)1-12009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。117号元素是用249Bk轰击48Ca靶合成的,总共得到6个117号元素的原子,其中1个原子经p次α衰变得到270Db后发生裂变;5个原子则经q次α衰变得到281Rg后发生裂变。用元素周期表上的117号元素符号,写出得到117号元素的核反应方程式(在元素符号的左上角和左下角分别标出质量数和原子序数)。48Ca249Bk294Uus3n48Ca249Bk293Uus4n20971172097117每式1分,画箭头也得1分。两式合并为648Ca+6249Bk=294Uns+5293Uns+23n也得满分。(2分)2097117971-2写出下列结构的中心原子的杂化轨道类型:\nI+XeFFFIFF[(CH)IF](CH)Xe[I(CH)]+655652652sp3d3(1分)sp3d(1分)sp3(1分)其他答案不得分。其他答案不得分。其他答案不得分。(3分)1-3一氯一溴二(氨基乙酸根)合钴(III)酸根离子有多种异构体,其中之一可用如下简式表示。请依样画出其他所有八面体构型的异构体。ClClClONNONNONNOOOBrBrBrNNOOONNONOONOOClClClNNClBrBrBrBrOONNNNNNOOOOOOClClNNClClBrBrBrBr每式1分。正确画出5个几何异构体,未画对映体但指明都有对映异构体,各得1.5分。(10分)第2题(5分)最近我国有人报道,将0.1molL1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1molL1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得混浊。2-1设此装置中发生的是铜离子和硫离子直接相遇的反应,已知φӨ(Cu2+/Cu)和φӨ(S/S2)分别为0.345V和0.476V,nFEӨ=RTlnK,EӨ表示反应的标准电动势,n为该反应得失电子数。计算25oC下硫离子和铜离子反应得到铜的反应平衡常数,写出平衡常数表达式。Cu2++S2=Cu+Sn=2,lnK=2x96485Cmol1x(0.345+0.476)V/(8.314JK1mol1x298.15K)K=5.82×1027;(1分)代入计算式的数值因约化导致计算结果(K)值不同,K值的指前因子在5.606.93范围内均得满分。K=[Cu2+]1[S2-]1;严格的表达式为K=([Cu2+]1[S2]1)Xc2(1分)o2-2金属铜和混浊现象均出现在蛋壳外,这意味着什么?硫离子可从蛋壳内通过蛋壳上的微孔向蛋壳外扩散并与铜离子反应生成铜和硫,而铜离子不能通过蛋壳微孔向蛋壳内扩散。两个要点各0.5分。(1分)2-3该报道未提及硫离子与铜离子相遇时溶液的pH。现设pH=6,写出反应的离子方程式。\nCu2++HS=Cu+S+2H+(1分)2将方程式中的HS写成HS或S2,即使方程配平了,也不得分。22-4请对此实验结果作一简短评论。开放式。只要写出了有一定合理性的评论均可得分。(1分)第3题(7分)早在19世纪人们就用金属硼化物和碳反应得到了碳化硼。它是迄今已知的除金刚石和氮化硼外最硬的固体。1930年确定了它的理想化学式。左下图是2007年发表的一篇研究论文给出的碳化硼晶胞简图。3-1该图给出了晶胞中的所有原子,除“三原子”(中心原子和与其相连的2个原子)外,晶胞的其余原子都是B多面体中的1个原子,B多面体的其1212他原子都不在晶胞内,均未画出。图中原子旁的短棍表示该原子与其他原子相连。若上述“三原子”都是碳原子,写出碳化硼的化学式。BC或CB答BC得0.5分。(1分)441233-2该图有什么旋转轴?有无对称中心和镜面?若有,指出个数及它们在图中的位置(未指出位置不得分)。有一根3重旋转轴(过上述“三原子”的直线)。(1分)有对称中心,在晶胞中心。(1分)有3个镜面。镜面之一垂直于纸面并通过上述“三原子”;3个镜面的面间角为60o,其交线为三重轴。(1.5分)有3根2重旋转轴,通过镜面角平分面,与三重轴垂直,交点为对称中心。(1.5分)(共计5分)3-3该晶胞的形状属于国际晶体学联合会在1983年定义的布拉维系七种晶胞中的哪一种?(注:国际晶体学联合会已于2002年改称Bravaissystems为latticesystems,后者尚无中文译名。)标准答案是菱方或“菱面体”(rhombohedral),答“三方”(trigonal),虽不符合国际晶体学联合会的推荐性规定,但考虑到国内许多教科书的现状,仍给0.5分。只答“素晶胞”不得分,答“菱方素晶胞”不扣分。(1分)第4题(8分)4-1分别将O、KO、BaO和O[AsF]填入与O—O键长相对应的空格中。22226O—O键长112pm121pm128pm149pm化学式O[AsF]OKOBaO26222每空0.5分。(2分)4-2在配合物A和B中,O为配体与中心金属离子配位。A的化学式为[CoO(NH)]4+,其O—O的键222310长为147pm;B的化学式为Co(bzacen)PyO,其O—O的键长为126pm,Py是吡啶(CHN),bzacen是四255齿配体[CH−C(O)=CH−C(CH)=NCH−]。B具有室温吸氧,加热脱氧的功能,可作为人工载氧体。画出65322A和B的结构简图(图中必须明确表明O—O与金属离子间的空间关系),并分别指出A和B中Co的氧化态。配合物AB4+OHCCH33HN3NHONH3NNHN33O结构简图CoOCoNH3CoH3NNHOONH3NH3Py3NHPhPh3\nCo的氧化态+3+3结构简图第1空2分,第2空3分,O-O-Co画成直线扣0.5分,氧化态每空0.5分。(6分)第5题(11分)把红热的玻棒插入橙红色固体A中,A受热后喷射出灰绿色粉末B和无色无味气体C。镁在C中加热生成灰色固体D。B在过量的NaOH溶液中加热溶解,得到绿色溶液E。将适量HO加入E22中,加热,得到黄色溶液F。F酸化后变为橙色溶液G。向G中加入Pb(NO)溶液,得到黄色沉淀H。325-1写出A、B、C、D、E、F、G和H的化学式。A(NH)CrOBCrOCNDMgN422723232ENaCr(OH)FNaCrOGNaCrOHPbCrO4242274每个化学式0.5分E写NaCrO也得满分。(4分)25-2写出由E转变为F,F转变为G,G转变为H的离子方程式。E转变为F2CrOH+3HO2OH-2CrO2+8HO42242F转变为G2CrO2-2H+CrO2HO4272G转变为H2Pb2++CrO2-+HO2PbCrO+2H+2724每个方程式1分。E转变为F,写CrO-配平,也得满分。(3分)25-3A中的金属元素M可以形成MO和ZnMO,它们均为磁性材料,广泛用于制作磁带和磁盘。分别写出224MO和ZnMO中M的价电子组态。2243d2,3d3(1分)5-4A中的金属元素M可以形成不同形式的羰基化合物或者羰基阴离子,按照18电子规则画出Na[M(CO)]的阴离子结构,指出M的氧化态。22102-OCCOOCCOOCCrCrCOOCCOOCCOCr的氧化态-1结构式2分,氧化态1分(3分)第6题(8分)在我国青海、西藏等地有许多干涸盐湖盛产一种钠盐Q。Q为一种易溶于水的白色固体。Q的水溶液用硫酸酸化,得到弱酸X。X为无色小片状透明晶体。X和甲醇在浓硫酸存在下生成易挥发的E。E在空气中点燃呈现绿色火焰。E和NaH反应得到易溶于水的白色固态化合物Z(分子量37.83)。6-1写出由Q得到X的离子方程式。BO(OH)2+3HO+2H+=4HBO写BO2-配平的方程式也得满分。(1分)454233476-2写出X在水中的电离方程式。B(OH)+HO=B(OH)+H+(1分)3246-3写出X和甲醇在浓硫酸存在下生成E的化学方程式。B(OH)+3CHOH=B(OCH)+3HO(1分)333326-4写出E燃烧反应的化学方程式。2B(OCH)+9O=BO+6CO+9HO(1分)33223226-5写出由E和NaH制备Z的化学反应方程式。\nB(OCH)+4NaH=NaBH+3NaOCH(1分)33436-6Z在水溶液里的稳定性与溶液pH有关,pH越大越稳定。为什么?水溶液的pH越大,[HO+]越低,BH和HO+的反应越难,因而NaBH越稳定。(1分)34346-7近年来,用Z和过氧化氢构建一种新型碱性电池已成为热门的研究课题。该电池放电时,每摩尔Z释放8摩尔电子,标准电动势大于2V。写出这种电池放电反应的离子方程式。BH+4HO=B(OH)+4HO(2分)42242第7题(13分)分子筛是一种天然或人工合成的泡沸石型水合铝硅酸盐晶体。人工合成的分子筛有几十种,皆为骨架型结构,其中最常用的是A型、X型、Y型和丝光沸石型分子筛,化学组成可表示为M[AlSiO]·xHO。mpqn(p+q)27-1Si4+、Al3+和O2的离子半径分别为41pm、50pm和140pm,通过计算说明在水合铝硅酸盐晶体中Si4+和Al3+各占据由氧构成的何种类型的多面体空隙。Si4+Al3+r41pmr50pmSi4+0.29Al3+0.36r140pmr140pmO2-O2-介于0.225和0.414间,四面体介于0.225和0.414间,四面体每个多面体1分;只答四面体而无正确的计算和说明,不得分。(2分)根据多面体几何学计算得出结论,只要正确,亦各得1分。7-2上述化学式中的n等于多少?说明理由。若M为2价离子,写出m与p的关系式。n=2;理由:由7-1结果知,Si(Al)O为骨架型结构,氧原子被2个四面体共用4(p+q)/n(p+q)=0.5,n=2m=1/2pn值和理由各1分;m与p的关系1分(3分)通过其他途径推算,结果正确,也得满分。7-3X光衍射测得Si-O键键长为160pm。此数据说明什么?如何理解?实测Si-O键键长(160pm)远小于Si4+和O2的离子半径之和(181pm),表明Si-O键中已有较大的共价成分(1分)。Si4+电价高、半径小,极化力较大,导致了键型变异(离子键向共价键过渡)(1分)(2分)7-4说明以下事实的原因:①硅铝比(有时用SiO/AlO表示)越高,分子筛越稳定;②最小硅铝比不小于1。223硅氧四面体和铝氧四面体无序地按硅铝原子比交替排列。①硅-氧键强于铝-氧键;②若Al3+数超过Si4+数,必出现铝氧四面体直接相连的情况,结构中引入不稳定因素,导致骨架强度削弱。各1分(2分)\n7-5人工合成的A型分子筛钠盐,属于立方晶系,正当晶胞参数a=2464pm,晶胞组成为Na[AlSiO]·xHO。将811.5克该分子筛在1.01325×105Pa、700℃加热6小时将结晶水完全除去,得9696963842到798.6升水蒸气(视为理想气体)。计算该分子筛的密度D。生成66.48mL氢气需2.717mmol×2=5.434mmol电子,电解所需时间为5.434103mol96485Cmol1t1.250104s3.472h0.04193A811.5g分子筛含水量为pV1.01325105Pa798.6103m3n10.00molRT8.3144JK-1mol-1973.15K一个晶胞的质量为(2207+2590+2697+6144+18.02x)1.364104+18.02x=(g)6.02210236.022102313638+18.016x811.5:6.0221024:xx2166.0221023分子筛密度为1.364104+18.02x1.36410418.02216D=1.946(gcm3)6.0221023a36.0221023(24641010)3n=10.00mol1分;x=2161分;D=1.946gcm32分。(4分)用另外的算法,算式与结果皆正确(包括有效数字和单位),亦得满分。\n阳极反应:Cu(s)→Cu2++2e阴极反应:HO+e→1/2H(g)+OH-22电池反应:Cu(s)+2HO→Cu2++H(g)+2OH-22第8题(6分)在25℃和101.325kPa下,向电解池通入0.04193A的恒定电流,阴极(Pt,0.1molL1HNO)3放出氢气,阳极(Cu,0.1molL1NaCl)得到Cu2+。用0.05115molL1的EDTA标准溶液滴定产生的Cu2+,消耗了53.12mL。8-1计算从阴极放出的氢气的体积。Cu2+与EDTA按1:1络合,因此,阴极放出的氢气的摩尔数等于阳极产生的Cu2+的摩尔数,即等于消耗的EDTA的摩尔数:nnMV0.05115molL-153.12mL2.717103molHEDTAEDTA22Cu给定条件下的体积为nRT2.717103mol8.314JK1mol1298.2KVH266.48mLHp1.01325105Pa2整式计算,算式和结果全对,得满分。分步计算:氢的摩尔数算式正确得1分;氢体积的算式正确得1分,结果正确(含单位和有效数字)各得1分。(4分)8-2计算电解所需的时间(以小时为单位)。计算过程与结果各1分。(2分)\n第9题(11分)9-1画出下列转换中A、B、C和D的结构简式(不要求标出手性)。1.Mg/苯1.LiAlH4回流无水醚A(C14H26O4)2.HOB(C12H22O2)2.HC(C12H24O2)D(C12H22Br2)2O2ABCDOOHBrCOOCH3COOCH3OHOHBr每个结构简式1分,其他答案不得分。(4分)9-2画出下列两个转换中产物1、2和3的结构简式,并简述在相同条件下反应,对羟基苯甲醛只得到一种产物,而间羟基苯甲醛却得到两种产物的原因。CHOCH(CH)Br,KCO321123丙酮,回流OH1CHOCH(CH)Br,KCO321123+丙酮,回流OH23123CHOCHOOO(CH)CH2113O(CH)CH2113O(CH)CH2113结构简式1和2各1分;结构简式3,3分(没有烷氧基只得1分,β-羟基酮只得1分)。若2,3对换,则得分也对换。其它答案不得分,例如丙酮自身缩合不得分。(5分)原因:连在苯环的烷氧基对苯环的对位比对苯环的间位有更强的给电子共轭效应(0.5分)和更弱的吸电子诱导效应(0.5分),致使羟基间位的醛基比对位的醛基有更强的亲电性(0.5分),所以在碳酸钾的弱碱条件下,对羟基苯甲醛与丙酮不发生缩合反应而间位羟基苯甲醛可与丙酮发生羟醛缩合反应(0.5分)。(2分)\n第10题(7分)灰黄霉素是一种抗真菌药,可由A和B在三级丁醇钾/三级丁醇体系中合成,反应式如下:OCHOCH3O3OOOCH3(CH)COK/(CH)COH+HCOCCCCHCHCH3333CH3O33HCOOHCOO33HClClAB灰黄霉素10-1在下面灰黄霉素结构式中标出不对称碳原子的构型。OCH3OOCH3SCH3OHCOOR3HCl每个构型1分,构型错误不得分。(2分)10-2写出所有符合下列两个条件的B的同分异构体的结构简式:①苯环上只有两种化学环境不同的氢;②分子中只有一种官能团。B的同分异构体:HOOHHCHCHOHCOHHCOOH3323HOOH每个结构简式1分。(4分)10-3写出由A和B生成灰黄霉素的反应名称。麦克尔加成。答1,4-共轭加成或共轭加成都得满分,答加成只得0.5分。(1分)第11题(9分)化合物A由碳、氢、氧三种元素组成,分子量72,碳的质量分数大于60%。A分子中的碳原子均为sp3杂化。A与2-苯基乙基溴化镁在适当条件下反应后经水解生成B。B在质子酸的催化作用下生成C。经测定B分子只含1个不对称碳原子,其构型为R。请根据上述信息回答下列问题:11-1写出A的分子式。CHO其它答案不得分。(1分)4811-2画出A、B和C的结构简式(列出所有可能的答案)。ABCOCH25CH25HH()Ph(HC)23OHCH25CH3CH3OHHPh(HC)()24OHH3C\n每个结构简式1分。未正确标明手性化合物A和B的构型,每个只得0.5分。C为外消旋体,没有表示出外消旋体,每个只得0.5分。(6分)11-3简述由手性化合物B合成C时手性能否被保留下来的理由。B在质子酸的催化作用下生成平面型的碳正离子(1分),它的两侧均可与苯环反应,从而生成一对外消旋体,所以B的手性不能完全被保留下来(1分)。(2分)中国化学会第24届全国高中学生化学竞赛(省级赛区)试卷第1题(15分)1-12009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。117号元素是用249Bk轰击48Ca靶合成的,总共得到6个117号元素的原子,其中1个原子经p次α衰变得到270Db后发生裂变;5个原子则经q次α衰变得到281Rg后发生裂变。用元素周期表上的117号元素符号,写出得到117号元素的核反应方程式(在元素符号的左上角和左下角分别标出质量数和原子序数)。1-2写出下列结构的中心原子的杂化轨道类型:[(CH)IF]-(CH)Xe[I(CH)]+655652652\n1-3一氯一溴二(氨基乙酸根)合钴(III)酸根离子有多种异构体,其中之一可用如下简式表示。请依样画出其他所有八面体构型的异构体。第2题(5分)最近我国有人报道,将0.1molL-1的硫化钠溶液装进一只掏空洗净的鸡蛋壳里,将蛋壳开口朝上,部分浸入盛有0.1molL-1的氯化铜溶液的烧杯中,在静置一周的过程中,蛋壳外表面逐渐出现金属铜,同时烧杯中的溶液渐渐褪色,并变得混浊。2-1设此装置中发生的是铜离子和硫离子直接相遇的反应,已知φӨ(Cu2+/Cu)和φӨ(S/S2-)分别为0.345V和-0.476V,nFEӨ=RTlnK,EӨ表示反应的标准电动势,n为该反应得失电子数。计算25oC下硫离子和铜离子反应得到铜的反应平衡常数,写出平衡常数表达式。2-2金属铜和混浊现象均出现在蛋壳外,这意味着什么?2-3该报道未提及硫离子与铜离子相遇时溶液的pH。现设pH=6,写出反应的离子方程式。2-4请对此实验结果作一简短评论。第3题(7分)早在19世纪人们就用金属硼化物和碳反应得到了碳化硼。它是迄今已知的除金刚石和氮化硼外最硬的固体。1930年确定了它的理想化学式。左下图是2007年发表的一篇研究论文给出的碳化硼晶胞简图。\n第4题(8分)4-1分别将O、KO、BaO和O[AsF]填入与O—O键长相对应的空格中。222264-2在配合物A和B中,O为配体与中心金属离子配位。A的化学式为[CoO(NH)]4+,其O—O的键长为147pm;B的化222310学式为Co(bzacen)PyO,其O—O的键长为126pm,Py是吡啶(CHN),bzacen是四齿配体255[CH−C(O-)=CH−C(CH)=NCH−]。B具有室温吸氧,加热脱氧的功能,可作为人工载氧体。画出A和B的结65322构简图(图中必须明确表明O—O与金属离子间的空间关系),并分别指出A和B中Co的氧化态。配合AB物结构简图Co的+3+3氧化态第5题(11分)把红热的玻棒插入橙红色固体A中,A受热后喷射出灰绿色粉末B和无色无味气体C。镁在C中加热生成灰色固体D。B在过量的NaOH溶液中加热溶解,得到绿色溶液E。将适量HO加入E中,22加热,得到黄色溶液F。F酸化后变为橙色溶液G。向G中加入Pb(NO)溶液,得到黄色沉淀H。32\n5-3A中的金属元素M可以形成MO和ZnMO,它们均为磁性材料,广泛用于制作磁带和磁盘。分别写出MO和ZnMO中M224224的价电子组态。5-4A中的金属元素M可以形成不同形式的羰基化合物或者羰基阴离子,按照18电子规则画出Na[M(CO)]2210的阴离子结构,指出M的氧化态。第6题(8分)在我国青海、西藏等地有许多干涸盐湖盛产一种钠盐Q。Q为一种易溶于水的白色固体。Q的水溶液用硫酸酸化,得到弱酸X。X为无色小片状透明晶体。X和甲醇在浓硫酸存在下生成易挥发的E。E在空气中点燃呈现绿色火焰。E和NaH反应得到易溶于水的白色固态化合物Z(分子量37.83)。第7题(13分)分子筛是一种天然或人工合成的泡沸石型水合铝硅酸盐晶体。人工合成的分子筛有几十种,皆为骨架型结\n构,其中最常用的是A型、X型、Y型和丝光沸石型分子筛,化学组成可表示为M[AlSiO]·xHOmpqn(p+q)2。7-1Si4+、Al3+和O2-的离子半径分别为41pm、50pm和140pm,通过计算说明在水合铝硅酸盐晶体中Si4+和Al3+各占据由氧构成的何种类型的多面体空隙。Si4+Al3+7-2上述化学式中的n等于多少?说明理由。若M为2价离子,写出m与p的关系式。7-3X光衍射测得Si-O键键长为160pm。此数据说明什么?如何理解?7-4说明以下事实的原因:①硅铝比(有时用SiO/AlO表示)越高,分子筛越稳定;②最小硅铝比不小于1。2237-5人工合成的A型分子筛钠盐,属于立方晶系,正当晶胞参数a=2464pm,晶胞组成为Na[AlSiO]·xHO。将811.5克该分子筛在1.01325×105Pa、700oC加热6小时将结晶水完全9696963842除去,得到798.6升水蒸气(视为理想气体)。计算该分子筛的密度D。\n第8题(6分)在25℃和101.325kPa下,向电解池通入0.04193A的恒定电流,阴极(Pt,0.1molL-1HNO)3放出氢气,阳极(Cu,0.1molL-1NaCl)得到Cu2+。用0.05115molL-1的EDTA标准溶液滴定产生的Cu2+,消耗了53.12mL。8-1计算从阴极放出的氢气的体积。8-2计算电解所需的时间(以小时为单位)。第9题(11分)9-1画出下列转换中A、B、C和D的结构简式(不要求标出手性)。\n9-2画出下列两个转换中产物1、2和3的结构简式,并简述在相同条件下反应,对羟基苯甲醛只得到一种产物,而间羟基苯甲醛却得到两种产物的原因。第10题(7分)灰黄霉素是一种抗真菌药,可由A和B在三级丁醇钾/三级丁醇体系中合成,反应式如下:\n10-1在下面灰黄霉素结构式中标出不对称碳原子的构型。10-2写出所有符合下列两个条件的B的同分异构体的结构简式:①苯环上只有两种化学环境不同的氢;②分子中只有一种官能团。B的同分异构体:10-3写出由A和B生成灰黄霉素的反应名称。第11题(9分)化合物A由碳、氢、氧三种元素组成,分子量72,碳的质量分数大于60%。A分子中的碳原子均为sp3杂化。A与2-苯基乙基溴化镁在适当条件下反应后经水解生成B。B在质子酸的催化作用下生成C。经测定B分子只含1个不对称碳原子,其构型为R。请根据上述信息回答下列问题:11-1写出A的分子式。11-2画出A、B和C的结构简式(列出所有可能的答案)。\n