- 359.00 KB
- 2022-07-25 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
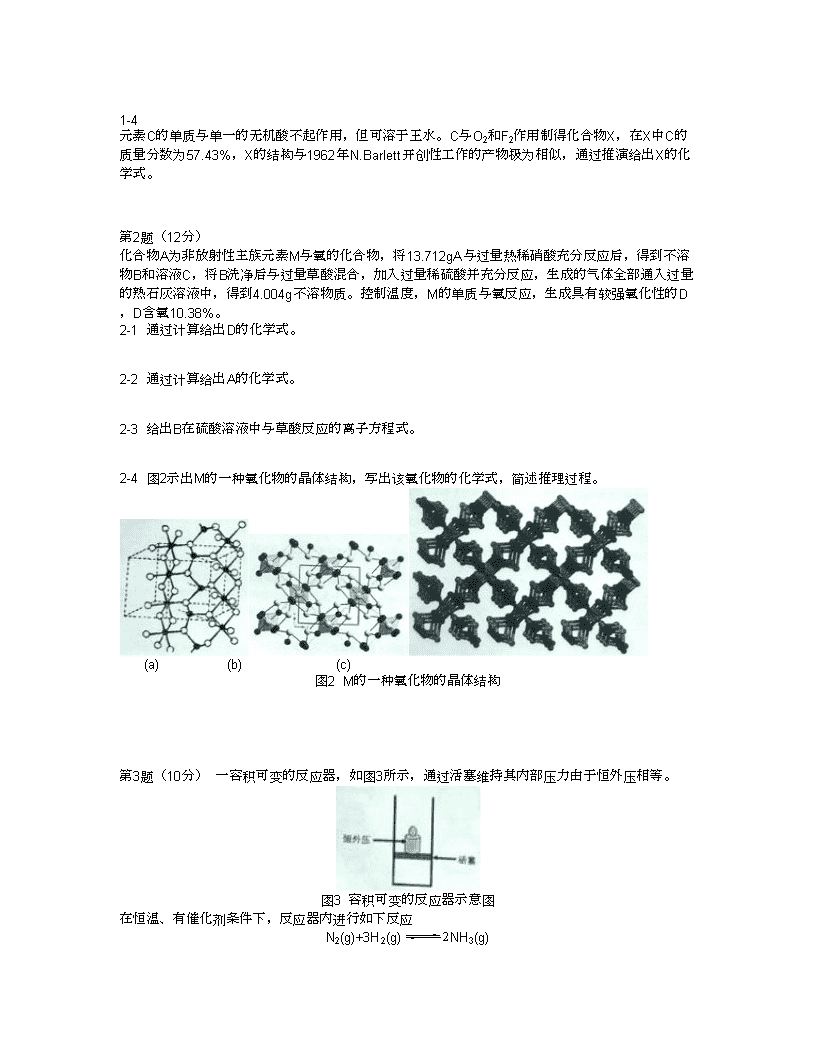
第25届全国高中学生化学竞赛理论试题2011年12月3日长春·竞赛时间4小时,迟到超过30分钟者不能进考场。开始考试后30分钟内不得离场。时间到,把试卷和答卷装入信封,放在桌面上,听到指令后方可离开考场。·试卷已装订成册,不得拆散。所有解答必须写在答卷上指定的方框内,写在试卷上无效。·用黑色墨水笔或黑色圆珠笔答题,不得携带任何其他纸张进入考场。若需要草稿纸,可举手向监考老师索取。·将营号写在试卷首页和每页答卷指定位置,否则无效。·允许使用非编程计算器以及直尺等文具。不得携带铅笔盒、通讯工具入场。H1.008相对原子质量He4.003Li6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]第1题(13分)同族金属A,B,C具有优良的导热、导电性能,若以I表示电离能,I1最低的是B,(I1+I2)最低的是A,(I1+I2+I3)最低的是C。1-1同族元素D,E,F(均为非放射性副族元素)基态原子的价层电子组态符合同一个通式,在元素周期表中,位置在A、B、C所在族之前,请给出D、E、F的元素符号及价层电子组态的通式。1-2元素A存在于动物的血蓝蛋白中,人对A元素代谢紊乱可导致Wilson病。(1)A2+硫酸盐在碱性溶液中加入缩二脲HN(CONH2)2会得到特征的紫色物质,该物质为-2价的配位阴离子,具有对称中心和不通过A的二重旋转轴,无金属—金属键,请画出该阴离子的结构(A必须写元素符号,下同)。(2)通过A2+与过量的丁二酮肟形成二聚配合物,实现了A2+的平面正方形配位向A2+的四方锥形配位转化,请画出该配合物的结构(丁二酮肟用表示)。1-3用B+的标准溶液滴定KCl和KSCN的中性溶液,得到电位滴定曲线,其拐点依次位于M、N、P处。(1)请分别写出在M、N、P处达到滴定终点的离子反应方程式。(2)在N处的物质是无支链的聚合物,请至少画出三个单元表示其结构。\n1-4元素C的单质与单一的无机酸不起作用,但可溶于王水。C与O2和F2作用制得化合物X,在X中C的质量分数为57.43%,X的结构与1962年N.Barlett开创性工作的产物极为相似,通过推演给出X的化学式。第2题(12分)化合物A为非放射性主族元素M与氧的化合物,将13.712gA与过量热稀硝酸充分反应后,得到不溶物B和溶液C,将B洗净后与过量草酸混合,加入过量稀硫酸并充分反应,生成的气体全部通入过量的熟石灰溶液中,得到4.004g不溶物质。控制温度,M的单质与氧反应,生成具有较强氧化性的D,D含氧10.38%。2-1通过计算给出D的化学式。2-2通过计算给出A的化学式。2-3给出B在硫酸溶液中与草酸反应的离子方程式。2-4图2示出M的一种氧化物的晶体结构,写出该氧化物的化学式,简述推理过程。(a)(b)(c)图2M的一种氧化物的晶体结构第3题(10分)一容积可变的反应器,如图3所示,通过活塞维持其内部压力由于恒外压相等。图3容积可变的反应器示意图在恒温、有催化剂条件下,反应器内进行如下反应N2(g)+3H2(g)2NH3(g)\n3-1若平衡时,反应器的容积为1.0L,各物质的浓度如下:物质N2H2NH3c/(mol·l-1)0.110.140.75现向平衡体系中注入4.0molN2。试计算反应的平衡常数Kc和反应商Qc,并由此判断反应将向什么方向进行。3-2若平衡时,反应器的容积为V,各物质的浓度分别为c(N2),c(H2)和c(NH3),现向平衡体系中注入体积为xV的N2(同温同压)。设此条件下1mol气体的体积为V0,试推导出Qc的表达式,并判断反应方向。第4题(13分)4-1硅酸根基本结构单元是硅氧四面体(SiO4),可以用三角形表示硅氧四面体的平面投影图形,三角形的顶点代表一个O原子,中心是Si和一个顶角O的重叠。若干硅氧四面体可以连接成层型结构,如图4-1(a)所示,两个硅氧四面体共用一个氧原子,又可以将其简单地表示为图4-1(b)。每一种层型结构可以用交于一点的n元环及环的数目来描述,例如图4-1(b)可以描述为63。图4-1(c)至(h)给出在沸石分子筛中经常见到的二维三连接层结构,图4-1(c)和图4-1(d)可分别描述为4.82和(4.6.8)(6.82)。试将对图4-1(e)至(h)的描述分别写答卷上。\n图4-1几种层型硅酸根结构的图示方法4-2分子筛骨架中存在一些特征的笼型结构,见图4-2.笼型结构是根据构成它们的多面体的各种n元环进行描述的。例如图4-2(a)所示的笼可以描述为45.52;而图4-2(b)的笼可以描述为46.62.63。试将对图4-2(c)至图4-2(h)的描述写在答卷上。\n图4-2分子筛骨架中存在的一些特征笼型结构4-3分子筛骨架中的笼型结构可以采用下述方法画出:将最上一层放在平面图的最内圈,下一层放在次内圈,依此类推,直到最底层放在平面图的最外圈。图中各原子之间的连接关系、各种环及其位置当然要与笼型结构中保持一致。例如图4-3(a)所示的笼,可以表示为图4-3(a′)。图4-3(b)至图4-3(d)结构不完整地图示在图4-3(b′)至图4-3(d′),即只给出了结构的最上层和最下层的图示,试在答卷上画出完整的平面图。图4-3几种笼型结构及图示(或不完整图示)第5题(14分)高温条件下反应机理的研究一直是化学反应动力学的基本课题,1956年的诺贝尔化学奖获得者在该领域做出过杰出的贡献。科研工作者研究了1000K下丙酮的热分解反应并提出了如下反应历程:CH3COCH3CH3·+CH3CO·(1)Ea(1)=351KJ·mol-1CH3CO·CH3·+CO(2)Ea(2)=42KJ·mol-1CH3·+CH3COCH3CH4+CH3COCH2·(3)Ea(3)=63KJ·mol-1CH3COCH2·CH3·+CH2CO(4)Ea(1)=200KJ·mol-1CH3·+CH3COCH2·C2H5COCH3(5)Ea(5)=21KJ·mol-1\n5-1上述历程是根据两个平行反应而提出的,请写出反应方程式。5-2实验测得1000K下热分解反应对丙酮为一级反应,试推出反应的速率方程。提示:①消耗丙酮的主要基元步骤是反应(3);②可忽略各基元反应指前因子的影响。5-3根据5-2推出的速率方程,计算表观活化能。5-4分解产物中CH4可以和水蒸气反应制备H2:CH4(g)+H2O(g)3H2(g)+CO(g)试根据下表数据计算该反应在298K时和平衡常数,并指出平衡常数随温度的变化趋势。相关物质热力学数据(298K)物质/KJ·mol-1/J·mol-1·K-1CH4(g)-74.4186.3H2O(g)-241.8188.8H2(g)0130.7CO(g)-110.5197.7H2O(l)-285.869.9第6题(8分)甲酸和乙酸都是重要的化工原料。移取20.00ml甲酸和乙酸的混合溶液,以0.1000mol·l-1NaOH标准溶液滴定至终点,消耗25.00ml。另取20.00ml上述混合溶液,加入50.00ml0.02500mol·l-1KMnO4强碱性溶液,反应完全后,调节至酸性,加入40.00ml0.02000mol·l-1Fe2+标准溶液,用上述KMnO4标准溶液滴定至终点,消耗24.00ml。6-1计算混合溶液中甲酸和乙酸的总量。6-2写出氧化还原滴定反应的化学方程式。6-3计算混合酸溶液中甲酸和乙酸的浓度。第7题(18分)2002年,Scott等人首次完成了的C60化学全合成,该成果为今后合成更多和更丰富的C60衍生物带来了可能。下面是其全合成的路线(无机产物及副产物已略去)。\n7-1写出上述合成路线中a、b、c和d所对应的试剂或反应条件。7-2画出上述合成路线中中间体A~I的结构简式。7-3写出中间体J的对称元素。7-4给出从中间体I到J的反应机理。第8题(12分)最近的研究表明,某种新型的胍盐离子液体(GIL)对Michael加成反应有很好的催化活性,进一步的研究表明GIL还具有一定的碱性。以下是某研究小组利用GIL为催化剂,合成多官能团化合物H的路线:8-1画出A和C的结构简式。8-2画出B、D、F和G的结构简式。\n8-1给出从中间体E到F的反应机理。8-4从周环反应的角度看,反应中间体G转化为目标产物需经过一次迁移,其驱动力为。\n初三化学酸碱盐测试题一、选择题(以下各题只有一个符合要求的答案,每题1分,共15分)1.为合理利用“垃圾’’资源,提倡垃圾分类回收,生活中废弃的铁锅、铝制易拉罐以归为一类加以回收,它们属于()A.有机物B.无机盐C.金属或合金D.难溶性碱2.将铁钉置于下列四种环境中,容易生锈的是()A.置于潮湿的空气中B.置于干操的空气中C.浸没于煮沸的水中D.浸没于油中3.能一次性鉴别NaCl、BaCl2、Na2CO3,三种无色溶液的试剂是()A.稀硫酸B.盐酸C.石灰水D.硝酸银溶液4.—些食物的近似pH如下:葡萄3.5——4.5,苹果2.9,——3.3,牛奶6.3,——6.6,鸡蛋清7.6——8.0。下列说法错误的是()A.胃酸过多的人不应多食苹果B.苹果汁的酸性比葡萄汁强C.鸡蛋清是碱性食物D.葡萄汁能使紫色石蕊试液变蓝5.下列药品未经密封保存,敞口放置一段时间后,质量增加并发生化学反应的是()①苛性②碳酸⑧浓盐酸④浓硫酸⑤熟石灰\nA.①⑧B.②④C.①⑤D.④⑤6.我国著名化学家侯德榜先生作出的重大贡献是()A.发明黑火药B.创造湿法冶金C.改进纯碱的生产D.发现了新元素7.现有①Ba(NO3)2:溶液、②KCI溶液、⑧K2SO4溶液、④CuSO4溶液,不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是()A.①②⑧④B.①④⑧②C.④⑧②①D.④①⑧②8.向盛有Fe、Cu的烧杯中加入过量稀硫酸,所得溶液中的溶质有()A.1种B.2种C3种D4种9.CuCI2和MgCl2的混合溶液中加入过量锌粉,充分反应后过滤,留在滤纸上的物质是()A.ZnB.CuC.Zn和CuD.Cu和Mg10.不符合“酸和盐反应生成另一种酸和另一种盐”的反应是()A.盐酸和硝酸钠溶液B.稀硫酸和氯化钡溶液C.稀盐酸和硝酸银溶液D.硝酸和碳酸钙11.某工厂排放的五色废水经测定PH=2,为治理废水,需将此废水的PH调至7~8,为达此目的,并采用经济可行的方法,需在此废水中加入()A.生石灰B.氢氧化钠C.铁粉D.盐酸12.以铁矿石(含Fe203)为原料炼铁时,一氧化碳是()A.氧化剂B.还原剂C.催化剂D.燃料\n13.某溶液中含Fe3+,Mg2+,S042-,NO3-,其中Fe3+,Mg2+,S042-的个数比为3:3:1,可推知溶液中Fe3+,S042-,N03-的个数比是()A.3:2:1B.1:2:1C.3:1:15D.3:1:1314.分别取少量下列各组物质同时加到足量水中,得到无色透明溶液的是()A.FeCI3、Ba(OH)2、KNO3,B.Na2CO3、CaCl2、Zn(NO3)2C.CuS04、KCI、NaCID.MgCl2、NaN03、Na2S0415.欲除去括号内的少量杂质,选用试剂不正确的是()A.NaOH溶液(Na2CO3)选用稀盐酸·B.C(CuO)选用稀硫酸