- 367.30 KB
- 2022-07-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
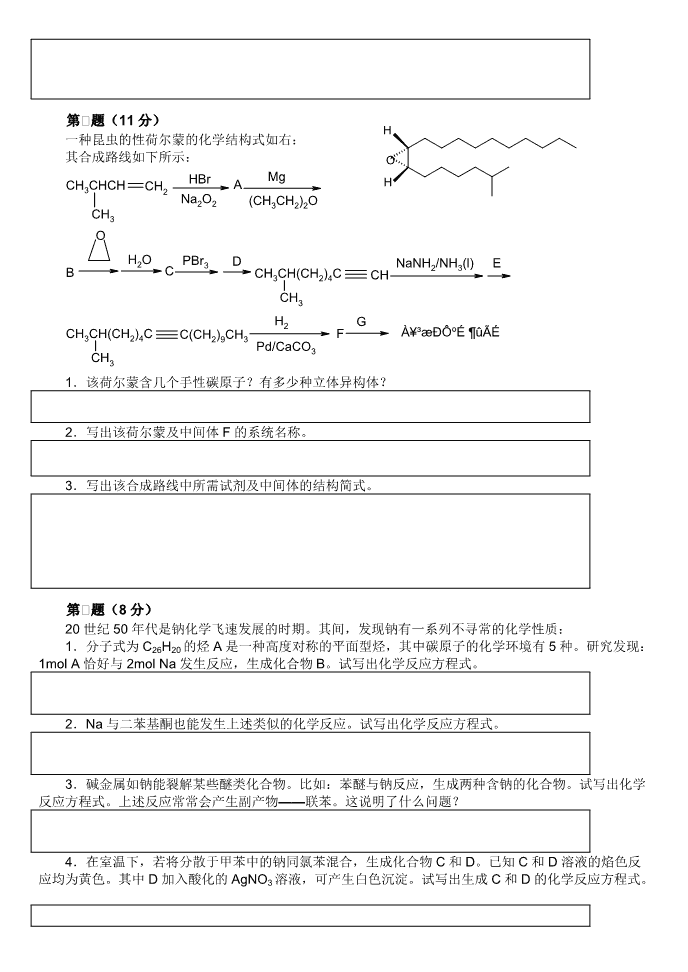
全国高中生化学竞赛初赛模拟试题(04)(时间:3小时满分:100分)题号123456789101112满分866871188715117HHe相对原子质量1.0084.003LiBeBCNOFNe6.9419.01210.8112.0114.0116.0019.0020.18NaMgAlSiPSClAr22.9924.3126.9828.0930.9732.0735.4539.95KCaScTiVCrMnFeCoNiCuZnGaGeAsSeBrKr39.1040.0844.9647.8850.9452.0054.9455.8558.9358.6963.5565.3969.7272.6174.9278.9679.9083.80RbSrYZrNbMoTcRuRhPdAgCdInSnSbTeIXe85.4787.6288.9191.2292.9195.94[98]101.1102.9106.4107.9112.4114.8118.7121.8127.6126.9131.3CsBaLa-HfTaWReOsIrPtAuHgTlPbBiPoAtRn132.9137.3Lu178.5180.9183.8186.2190.2192.2195.1197.0200.6204.4207.2209.0[210][210][222]FrRaAc-RfDbSgBhHsMtDsRg[223][226]Lr第一题(8分)Somepropertiesof8elementsbelongingtotheshortperiodsarelistedinthefollowingtable.ElementNo.①②③④⑤⑥⑦⑧Atomic0.741.521.601.100.990.751.860.82radius(10-10m)+1+2+5+7+5+1+3Highest/lowestvalence-2-3-1-31.8种元素中位于同主族的有对;2.8种元素中位于第二周期的有种;3.号元素最高氧化物的水化物的酸性比其他7种元素的相应化合物都强;4.⑧号元素基态原子核外电子构型为;5.号元素和号元素最易形成含非极性共价键的化合物6.写出上述元素形成原子晶体的物质的化学式;7.列举由上述元素形成的4种非极性化合物分子的化学式。第一题(6分)锂离子电池的正极材料是锂过渡金属氧化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负极材料是可插入锂的碳负极。充、放电时电池中的变化简单表示为:LiCoO2xLi++(Li0.5CoO2)+e-LixC6。1.写出a、b、c、d所表示的电极变化;2.写出放电时两极的电极反应式。3.充电时Li+如何移动;\n4.电池放电时若转移1mole-,计算消耗负极材料的质量(用x的式子)第一题(6分)回答下面2个问题:1.生物学家发现生活在南极冰天雪地内的鱼类,其血液内含有相当浓度的丙二醇,这种现象与其维持生命有关。请解释这种现象;2.某些科学家发布消息,认为现在地球上的温室效应的主要元凶之一是“牛”。依你的看法,牛是如何造成温室效应?第一题(8分)加热钠盐A,生成物质的量为2︰1的钠盐B和钠盐C,电解B的水溶液生成钠盐D和氢气。另有气态化合物E(沸点284K)是一种强氧化剂,它跟氢氧化钠的水溶液反应生成A、B和水。E臭氧化将生成化合物F(式量约为167),F跟氢氧化钠的水溶液反应生成化合物B、D和水。1.E具有(“顺”或“反”)磁性。2.将钠盐A、B、C、D中钠元素的质量分数从高到低排列;3.写出化合物A~F的化学式;第一题(7分)Polyazides家族化合物是一种高能量密度的材料,Tetraazidomethane是其中成员之一,美国化学会的Chemical&EngineeringNews在2006年报道了通过理论计算得到的Tetraazidomethane结构。虽然这种二元化合物(只含两种元素)的高度不稳定性可能排除了它在真实世界的有力发展,但它可以控制分解形成有趣的不同氮化物。该物质的一种制备方法可由含锑盐A与一种钠盐B在一定条件下发生复分解反应制得:盐A的阳离子为正三角形,含氮质量分数约为91.30%;阴离子为SbCl6-。钠盐B的阴离子和CO2是等电子体。A和B反应得到的Tetraazidomethane是一种高沸点的液体,含氮质量分数约为93.33%,有一定危险性。虽然这种方法生成率较高,但起始反应材料A既昂贵又有爆炸性。1.写出与Tetraazidomethane含有相同元素的最简单的二元固态化合物的化学式;2.判断A、B的阴离子的空间构型;3.Tetraazidomethane分子中有三种不同化学环境的N,请画出Tetraazidomethane的结构简式,并判断中心原子的杂化类型。\n第一题(11分)H一种昆虫的性荷尔蒙的化学结构式如右:其合成路线如下所示:OHBrAMgHCHCHCHCH32Na2O2(CH3CH2)2OCH3OH2OPBr3DNaNH2/NH3(l)EBCCHCH(CH)CCH324CH3H2GCH3CH(CH2)4CC(CH2)9CH3FÀ¥³æÐԺɶûÃÉPd/CaCO3CH31.该荷尔蒙含几个手性碳原子?有多少种立体异构体?2.写出该荷尔蒙及中间体F的系统名称。3.写出该合成路线中所需试剂及中间体的结构简式。第一题(8分)20世纪50年代是钠化学飞速发展的时期。其间,发现钠有一系列不寻常的化学性质:1.分子式为C26H20的烃A是一种高度对称的平面型烃,其中碳原子的化学环境有5种。研究发现:1molA恰好与2molNa发生反应,生成化合物B。试写出化学反应方程式。2.Na与二苯基酮也能发生上述类似的化学反应。试写出化学反应方程式。3.碱金属如钠能裂解某些醚类化合物。比如:苯醚与钠反应,生成两种含钠的化合物。试写出化学反应方程式。上述反应常常会产生副产物——联苯。这说明了什么问题?4.在室温下,若将分散于甲苯中的钠同氯苯混合,生成化合物C和D。已知C和D溶液的焰色反应均为黄色。其中D加入酸化的AgNO3溶液,可产生白色沉淀。试写出生成C和D的化学反应方程式。\n5.C与上述溶液中的甲苯可以继续发生置换反应。试写出化学反应方程式。第一题(8分)向NiCl2溶液中加入KCN,可以得到灰蓝色化合物A的沉淀,向A中继续加入过量的KCN溶液,可以生成杏黄色物质B,B的阴离子为平面四边形。1.确定A和B的化学式,并说明B分子中Ni原子的杂化形态。2.在有氨存在下,A可以生成一种分子间化合物。当用苯与A在氨水中的溶液一起摇荡时,产生一种淡紫色沉淀物,其结构如右:(1)推导出此化合物的化学计量式;(2)简单描述它的结构;(3)当用吡啶(C5H5N)和萘分别代替苯时,会得到相似的化合物吗?为什么?第一题(7分)有色物质溶液颜色的深浅与溶液中有色物质的浓度有一定关系,利用比较颜色深浅来测定溶液中某种组分的含量的分析方法称为比色分析法。可以是目视比色,或是利用分光光度计测试仪器,目前很多中学已经采用传感器技术中的色度计进行测量。其原理基于朗伯-比尔定律,简单地说就是在吸光物质的性质、入射光波长及温度等因素一定的情况下,溶液对光的吸收程度与吸光物质浓度及吸收层厚度成正比。如果你的学校没有传感器,也可以用以下比色法进行测定“平衡常数”:①取口径大小相同的干净试管2支,贴上标签A、B号,分别加入0.0020mol/L的KSCN溶液5.0mL,并在A号试管内加入0.20mol/L的Fe(NO3)3溶液5.0mL,将此混合液作为标准液(所有的SCN-离子几乎完全变成Fe(SCN)2+离子,当作标准溶液)。②另取10.0mL0.20mol/L的Fe(NO3)3溶液,加入蒸馏水到总体积为25.0mL,然后将此溶液充分混合,再取出5.0mL该溶液加入①中的B号试管内。然后进行比色,测定其平衡常数值。回答下列问题:1.计算B号试管内Fe(NO3)3的初浓度;2.比色时,所见溶液的颜色深浅,随着管内溶液的高度与溶液的浓度而改变。欲调整两试管溶液的色度直至相等,具体操作是以滴管从色度较深的A号试管中,抽出过量的溶液,放在干净的小烧杯中,然后再滴回A号试管中,由试管口上方向下俯视,直至所呈色度相等为止。量取两试管溶液的深度,得A号试管为6.4cm,B号试管为8cm;求B号试管内的[Fe(SCN)2+]的浓度;3.求此反应的平衡常数。\n第一题(15分)芳香族有机物A由三种元素组成,其中碳元素的质量分数是80.7%;A是平面型非极性分子,具有多种顺反异构体;A在无水条件下与Cl2反应,得到含氯元素的质量分数为25.6%的有机物B;A在有少量水存在下与Cl2反应生成C,C是平面型不含Cl的极性分子,红外光谱检测到苯甲酰基的存在;A、B、C的相对分子质量都不足300。1.通过推理确定A、B的化学式;2.写出A的结构式;A的顺反异构体共有多少种(包括A);3.写出B的结构;A→B的反应类型是什么?4.写出C的结构;A→C的反应历程。5.已知C的晶体结构参数为:a=878pm、b=1046pm、c=1312pm,α=β=γ=90°,ρ=1.236g/cm3,计算C的晶胞内的原子个数。6.虽然B的式量大于C,但沸点却要比C低,解释原因(尽可能详细)。第一一题(11分)1.在CuSO4的碱性溶液中加入双缩脲(C2H5N3O2),呈现特征的紫色。已知显紫色的配离子A含铜元素42.2%,具有良好的对称性,其中Cu(Ⅱ)的配位数是4,且带有2单位的负电荷,画出A的结构。\n2.解释下面2个问题(1)(Cu2+/Cu+)=0.159V(I2/I-)=0.535V,但Cu2+却能氧化I-;(2)向Cu(NH3)42+逐滴加HCl溶液的过程中有淡蓝色沉淀生成3.已知:K稳[Cu(NH3)42+]=[Cu(NH3)42+]/[Cu2+][NH3]4=4.8×10-12,Ksp[Cu(OH)2]=2.2×10-20,Kb(NH3)=1.77×10-5。现有一溶液含有0.100mol/L的自由NH3、0.0100mol/LNH4Cl和0.15mol/L[Cu(NH3)42+],问此溶液中能否生成Cu(OH)2沉淀?第一一题(7分)写出字母代表的化合物的结构:COOMeOMeONaCH2OAAB(CHO)C(CHO)1084-19126OHOCH3已知A的结构中有2个六元环;C结构中有4个六元环,其中3个并联(类似“菲”的骨架);红外光谱显示C结构中有1个羟基、2个酯基和1个酮羰基。\n参考答案(0803)第一题(8分)1.22.43.⑤4.1s22s22p15.①⑦6.BN(各1分)7.P4O6、P4O10、PCl5、BCl3、N2O4(各0.5分,答出4个即可)第一题(分)1.a:充电阳极变化、b:放电正极变化、c:充电阴极变化、d:放电负极变化(各0.5分)2.负极:LixC6→C6+xLi++xe-正极:Li0.5CoO2+0.5Li++0.5e-→LiCoO2(各1分)3.Li+从阳极→阴极移动(1分)4.6.9+72/x(1分)第一题(6分)1.根据溶液的依数性质(colligativeproperty),因为鱼体内的血液有丙二醇,所以血液会因凝固点下降,不会因为血液内的水冻结而死亡。(2分)2.牛放屁的而排泄出来的甲烷,是一种比CO2更有效的温室气体,加剧了温室效应。(2分)第一题(8分)1.顺(1分)2.CABD(1分)3.A:NaClO2B:NaClO3C:NaClD:NaClO4E:ClO2F:Cl2O6(各1分)第一题(7分)1.C3N4(1.5分)2.正八面体,直线形(各1分)3.(3分)sp3(0.5分)第一题(11分)1.2个手性碳原子(0.5分)4种立体异构体(1分)2.F:Z-2-甲基-7-十八烯(1分);荷尔蒙:(7S,8R)-2-甲基-7,8-环氧十八烷(1.5分)3.A:CH3CH(CH3)CH2CH2Br;B:CH3CH(CH3)CH2CH2MgBr;C:CH3CH(CH3)CH2CH2CH2CH2OH;D:CH≡CNa;E:CH3(CH2)8CH2Br;HHF:;G:RCOOOH(各1分)第一题(8分)(H5C6)2CC(C6H5)21.(C6H5)2C=C(C6H5)2+2NaNaNa(2分)\nNaC6H5CC6H52.C6H5COC6H5+2NaONa(1分)3.C6H5OC6H5+2NaC6H5Na+C6H5ONa(1.5分)说明该反应中有游离基中间体生成(0.5分)甲苯4.C6H5Cl+2NaC6H5Na+NaCl(1.5分)5.C6H5Na+C6H5CH3C6H6+C6H5CH2Na(1.5分)第一题(8分)1.A:Ni(CN)2;B:K2[Ni(CN)4];Ni:dsp2(各1分)2.(1)Ni(CN)2·NH3·C6H6(2分)根据笼型包合物的晶胞,该化合物的化学计量式很容易推出来:Ni原子个数:8×1/8+2×1/2=2;NH3分子个数=8×1/4=2;C6H6分子个数=4×1/2=2;CN-离子个数=8×1/2=4,因此Ni︰NH3︰C6H6︰CN-=2︰2︰2︰4=1︰1︰1︰2。(2)描述其结构不很容易,但把该结构分成两部分来看就容易了。上下底(即每一层)是由镍原子与氰根(CN-)连接成的二维平面网状结构。一半的镍原子与CN-中的C原子配位,另一半镍原子与CN-中的N原子配位,与N原子配位的镍原子还键合着二个氨,分别在其上、下方,正是由于该镍原子配位了两个氨,使其在与CN-配位时,选择了CN-中的N原子,这可能是与氨分子配位的Ni更显示硬酸的性质的缘故。层与层之间就是靠氨分子连接起来的,苯环在两层之间。(2分,答出要点即可)(3)结构分析清楚了,关于用吡啶N(C5H5N)和萘(C10H8)分别能否取代该结构中的苯也就很清楚了。由于层与层之间的大小是一定的,所以吡啶能取代苯而萘不能取代苯,因为吡啶大小与苯相似。而萘比苯大多了。第一题(7分)1.c[Fe(NO3)3]=0.20mol/L×5.0/25.0=0.04mol·L-1(1分)2.由于所有的SCN离子几乎完全变成Fe(SCN)2+离子,Fe(NO3)3溶液过量,所以产物FeSCN2+浓度需要根据KSCN溶液求算A号试管内的Fe(SCN)2+浓度c1=0.002×5.0/10.0=0.001mol/l(1分)比色法中当颜色相同时,原来浓度与其高度成反比:c1h1=c2h2所以B号试管内的[FeSCN2+]=c2=c1h1/h2=0.001×6.4/8=8.0×10-4mol/L(1.5分)3.平衡时,c(SCN-)=0.0020/2-8.0×10-4=2.0×10-4mol/L(1分)c(Fe3+)=0.04-8.0×10-4=3.92×10-2mol/L(1分)K=c(FeSCN2+)/c(Fe3+)c(SCN-)=8.0×10-4/3.92×10-2×2.0×10-4=102(1.5分)第一题(15分)1.B中C、Cl的个数比比约为C︰Cl≈(1-0.256)×0.807/12.01︰0.256/35.45=7︰1(1分)A中7个C时式量为104,化学式为C7H6N(1分)由于A是有顺反异构体的非极性分子,且式量<300,因此A只能是C14H12N2(1分)不难确定B的化学式为C14H10N2Cl2(1分)\nNNNN2.或(1.5分)NNN8种(1.5分,、N、2个双键顺式还有4种)ClNNCl3.(1分)取代(0.5分)ONNH4.(1.5分)ClNNNNCl2H2OOHONNNN重排H(1.5分)5.V=1.205nm3Z=ρVNA/M=4(1分)1个晶胞内原子总数116(1分)6.C分子间存在氢键(1分)羰基O和亚氨基H间存在氢键(0.5分)参考:第一一题(11分)OO2-HNHOHNHNCuCuNHNHOHNH1.OO(3.5分)2.(1)2Cu2++4I-=2CuI↓+I2(1分),由于=+0.0592lg[Cu2+/Cu+],而[Cu+]很小,使Cu2+/Cu+>I2/I-(1分,不要求能斯特方程)(2)Cu(NH3)42++2H2OCu(OH)2+2NH4++2NH3,加酸平行右移(2分)3.[OH-]=Kb×[NH3]/[NH4Cl]=1.77×10-5×0.100/0.0100=1.77×10-4mol/L(1分)\n[Cu2+]=[Cu(NH3)42+]/{K稳×[NH3]4}=0.15/{4.8×10-12×(0.100)4}=3.13×10-10mol/LQsp[Cu(OH)2]=(3.13×10-10)×(1.77×10-4)2=9.8×10-18>Ksp(1分)(1分)因此,该溶液有Cu(OH)2沉淀生成。(0.5分)第一一题(7分)HOOOOCH2OHOOA:OO(2分)B:OO(2分)C:OO(3分)