- 1.06 MB
- 2022-07-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
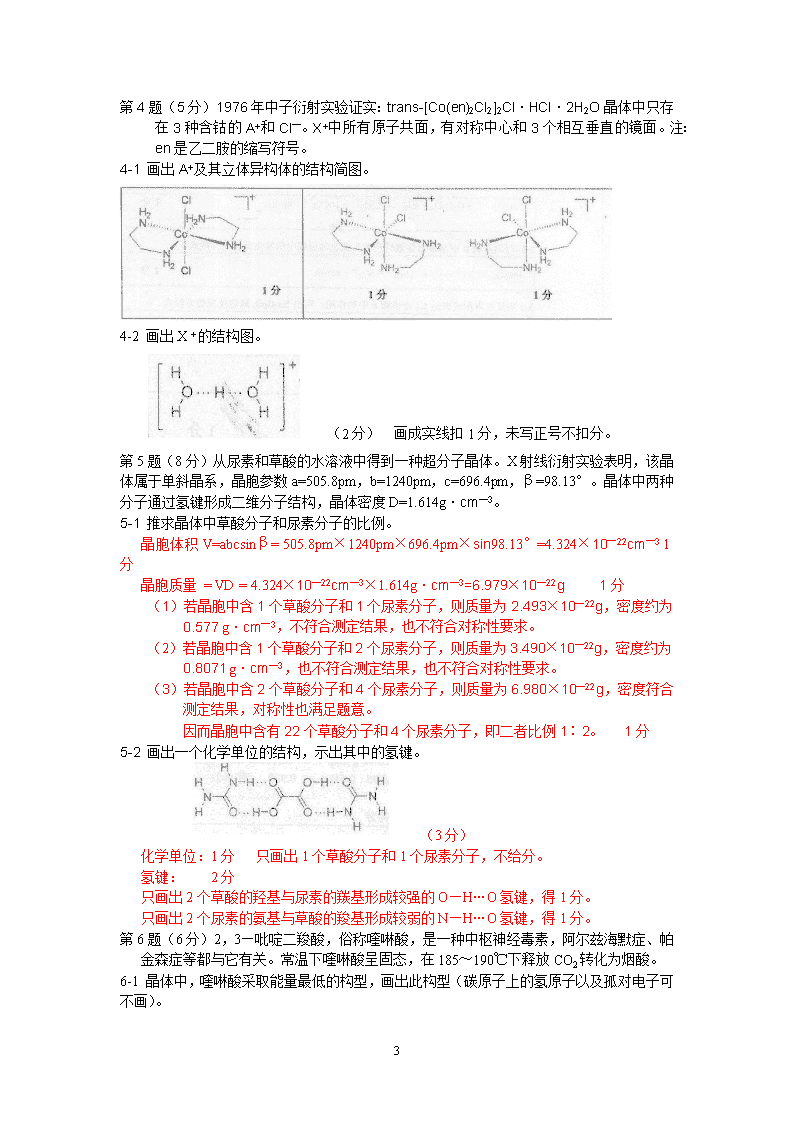
中国化学会第26届全国高中学生化学竞赛(省级赛区)试卷(2012年9月2日9︰00-12︰00共计3小时)l竞赛时间3小时。迟到超过30分钟者不能进考场。开始考试后1小时内不得离场。时间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。l试卷装订成册,不得拆散。所有解答必须写在站定的方框内,不得用铅笔填写。草稿纸在最后一页。不得持有任何其他纸张。l姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。允许使用非编程计算器以及直尺等文具第1题(7分)1-1向硫酸锌水溶液中滴加适当浓度的氨水至过量,发生两步主要反应。简述实验现象并写出两步主要反应的离子方程式。无色溶液产生白色沉淀,后逐渐溶解(1分,如只写白色沉淀溶解不扣分,未表明白色,扣0.5分)(1)Zn2++2NH3+2H2O=Zn(OH)2↓+2NH4+(1分)写成如下形式均给分:Zn2++2NH3·H2O=Zn(OH)2↓+2NH4+[Zn(H2O)6]2++2NH3·H2O=Zn(OH)2↓+2NH4++6H2O[Zn(H2O)6]2++2NH3=Zn(OH)2↓+2NH4++2H2O(2)Zn(OH)2+2NH4++2NH3=[Zn(NH3)4]2++2H2O如写成Zn(OH)2+4NH3=[Zn(NH3)4]2++2OH—也对,如产物写成[Zn(NH3)6]2+扣0.5分,因主要产物是[Zn(NH3)4]2+1-2化合物[Cu(Pydc)(amp)]·3H2O]的组成为C11H14CuN4O7,热重分析曲线表明,该化合物受热分解发生两步失重,第一个失重峰在200~250℃,失重的质量分数为15.2%。第二个失重峰在400~500℃,失重后的固态残渣质量为原化合物质量的20.0%。Pydc和amp是含有芳环的有机配体。通过计算回答:(1)第一步失重失去的组分。水分子或H2O3个水分子或3H2OC11H14CuN4O7的式量约377.8,失去3个水分子,失重质量分数理论值为14.3%。1分(2)第二步失重后的固态残渣是什么,解释理由。CuO或Cu2O的混合物(2分)理由:CuO、Cu2O及C11H14CuN4O7的式量分别为79.55、143.1和377.8。若残渣为CuO,则失重质量分数为79.55/377.8=21.1%;若残渣为Cu2O,则质量分数为143.1/(377.8×2)=18.9%,实验值为20%介于两者之间,故残渣是两者的混合物。(1分)只答CuO或只答Cu2O,只得1分。答CuO和Cu混合物,计算正确,理由表述清晰,也可得3分。虽然计算正确,但物质在题设条件下不存在(如乙炔铜、氢化铜等),也可得1分(计算分)。第2题(7分)A和X是两种常见的非金属元素,其核外电子数之和为22,价电子数之和为10。在一定条件下可生成AX、AX3(常见的Lewis酸)、A2X4和A4X4,反应如下:Hg,放电A(s)+3/2X2(g)AX3(g)AX3(g)AX(g)+2X(g)2Hg+2X(g)Hg2X2(g)AX(g)+AX3(g)A2X4(g)4AX(g)A4X4(s)7\n2-1指出A和X各是什么元素。A:BX:Cl共3分各1.5分2-2A4X4具有4个三重旋转轴,每个A原子周围都有4个原子,画出A4X4的结构示意图。(2分)2-3写出AX3与CH3MgBr按计量数比为1∶3反应的方程式。BCl3+3CH3MgBr——>B(CH3)3+3MgBrCl(1分)AX3+3CH3MgBr——>B(CH3)3+3MgBrCl写成BCl3+3CH3MgBr——>B(CH3)3+3/2MgBr2+3/2MgCl2也可2-4写出A2X4与乙醇发生醇解反应的方程式。B2Cl4+4C2H5OH—>B2(OC2H5)4+4HCl(1分)A2X4+4C2H5OH—>A2(OC2H5)4+4HX第3题(10分)CuSO4溶液与K2C2O4溶液反应,得到一种蓝色晶体。通过下述实验确定该晶体的组成:(a)称取0.2073g样品,放入锥形瓶,加入40mL2mol·L—1的H2SO4,微热使样品溶解,加入30mL水,加热近沸,用0.02054mol·L—1KMnO4溶液滴定至终点,消耗24.18mL。(b)接着将溶液充分加热,使浅紫红色变为蓝色,冷却后加入2gKI固体和适量Na2CO3,溶液变为棕色并生成沉淀。用0.04826mol·L—1的Na2S2O3溶液滴定,近终点时加入淀粉指示剂,至终点,消耗12.69mL。3-1写出步骤a中滴定反应的方程式。2MnO4—+5H2C2O4+6H+==2Mn2+10CO2↑+8H2O(1分)3-2写出步骤b中溶液由淡紫色变为蓝色的过程中所发生反应的方程式。4MnO4—+12H+==Mn2++5O2↑+6H2O(2分)3-3用反应方程式表达KI在步骤b中的作用:写出Na2S2O3滴定反应的方程式。KI与Cu2+作用:2Cu2++5I—==2CuI↓+I3—(1分)3-4通过计算写出蓝色晶体的化学式(原子数取整数)。根据3-1中的反应式和步骤a中的数据,得:n(C2O42—)=0.02054mol·L—1×24.18mL×5/2==1.241mmol(1分)根据3-3中的反应式和步骤b中的数据,可得:n(Cu2+)==0.04826mol·L—1×12.69mL==0.6124mmol(1分)n(Cu2+)∶n(C2O42—)==0.6124mmol∶1.2416mmol==0.4933≈0.5配离子组成为[Cu(C2O4)2]2—。(1分)由电荷守恒,晶体的化学式为K2[Cu(C2O4)2]·xH2O结晶水的质量为:0.2073g—0.6124×10—3mol×M[K2Cu(C2O4)2]==0.2073g—0.6124×10—3mol×317.8g·mol—1=0.0127gn(H2O)=0.0127g/(18.02g·mol—1)=0.000705mol=0.705mmoln(H2O)∶n(Cu2+)=0.705∶0.6124=1.15x≈1或用n(C2O42—)和n(Cu2+)实验数据的均值0.6180mmol计算水的质量:0.2073g—0.6180×10—3mol×M[K2Cu(C2O4)2]=0.0109gn(H2O)=0.0109g/(18.02g·mol—1)=0.000605mol=0.605mmoln(H2O)∶n(Cu2+)=0.605∶0.6124=0.989x≈1其他合理的方式,均给分。7\n第4题(5分)1976年中子衍射实验证实:trans-[Co(en)2Cl2]2Cl·HCl·2H2O晶体中只存在3种含钴的A+和Cl—。X+中所有原子共面,有对称中心和3个相互垂直的镜面。注:en是乙二胺的缩写符号。4-1画出A+及其立体异构体的结构简图。4-2画出X + 的结构图。(2分)画成实线扣1分,未写正号不扣分。第5题(8分)从尿素和草酸的水溶液中得到一种超分子晶体。X射线衍射实验表明,该晶体属于单斜晶系,晶胞参数a=505.8pm,b=1240pm,c=696.4pm,β=98.13°。晶体中两种分子通过氢键形成二维分子结构,晶体密度D=1.614g·cm—3。5-1推求晶体中草酸分子和尿素分子的比例。晶胞体积V=abcsinβ=505.8pm×1240pm×696.4pm×sin98.13°=4.324×10—22cm—31分晶胞质量=VD=4.324×10—22cm—3×1.614g·cm—3=6.979×10—22g1分(1)若晶胞中含1个草酸分子和1个尿素分子,则质量为2.493×10 —22g,密度约为0.577g·cm—3,不符合测定结果,也不符合对称性要求。(2)若晶胞中含1个草酸分子和2个尿素分子,则质量为3.490×10 —22g,密度约为0.8071g·cm—3,也不符合测定结果,也不符合对称性要求。(3)若晶胞中含2个草酸分子和4个尿素分子,则质量为6.980×10 —22g,密度符合测定结果,对称性也满足题意。因而晶胞中含有22个草酸分子和4个尿素分子,即二者比例1∶2。1分5-2画出一个化学单位的结构,示出其中的氢键。(3分)化学单位:1分只画出1个草酸分子和1个尿素分子,不给分。氢键:2分只画出2个草酸的羟基与尿素的羰基形成较强的O—H…O氢键,得1分。只画出2个尿素的氨基与草酸的羧基形成较弱的N—H…O氢键,得1分。第6题(6分)2,3—吡啶二羧酸,俗称喹啉酸,是一种中枢神经毒素,阿尔兹海默症、帕金森症等都与它有关。常温下喹啉酸呈固态,在185~190℃下释放CO2转化为烟酸。6-1晶体中,喹啉酸采取能量最低的构型,画出此构型(碳原子上的氢原子以及孤对电子可不画)。7\n3分其他答案不得分。一个氢必须在氮原子上,氮原子必须带正电荷,另一个氢原子必须在两个氧原子之间,但不要求氢键的键角,该键是否对称也不要求,2位的取代基必须是羧酸根负离子。6-2喹啉酸在水溶液中的pKa1=2.41,写出其一级电离的方程式(共轭酸碱用结构简式表示)。6-3画出烟酸的结构。2分若画成也给2分。第7题(10分)硼的总浓度≥0.4mol·mol—1的硼酸及其盐的水溶液中不仅存在四硼酸根离子B4还存在电荷为—1的五硼酸根离子以及电荷为—1和—2的两种三硼酸根离子。这些多硼酸根离子和B(OH)4—缩合而成,结构中硼原子以B—O—B的方式连接成环。7-1上述五硼酸根离子中,所有三配位硼原子的化学环境完全相同,画出其结构示意图(不画孤对电子,羟基用—OH表达)(4分)未标负号扣1分。7-2右图示出硼酸—硼酸盐体系在硼的总浓度为0.4mol·mol—1时,其存在形式与pH的关系。1、2、3、4分别为4种多硼酸根离子存在的区域。推出1、2、3、4分别对应的多硼酸根离子的化学式。注:以B4O5(OH)42—为范例,书写其他3种多硼酸根离子的化学式;形成这些物种的缩合反应速率几乎相同,其排列顺序不受反应速率制约;本体系中缩合反应不改变硼原子的配位数。1:B5O6(OH)44—1分2:B3O3(OH)4—2分3:B4O5(OH)42—1分4:B3O3(OH)52—2分1:五硼酸根,B5O6(OH)44—,三配位硼原子和四配位硼原子的比例4∶12:三硼酸根,B3O3(OH)4—,三配位硼原子和四配位硼原子的比例2∶13:四硼酸根,B4O5(OH)42—,三配位硼原子和四配位硼原子的比例2∶24:三硼酸根,B3O3(OH)52—,三配位硼原子和四配位硼原子的比例1∶27\n第8题(16分)右图示出在碳酸—碳酸盐体系(CO32—的分析浓度为1.0×10—2mol·L—1)中,铀的存在物种及相关电极电势随pH的变化关系(E—pH图,以标准氢电极为参比电极)。作为比较,虚线示出H+/H2和O2/H2O两电对的E—pH关系。8-1计算在pH分别为4.0和6.0的条件下碳酸—碳酸盐体系中主要物种的浓度。H2CO3:Ka1=4.5×10—7,Ka2=4.7×10—11溶液中存在如下平衡:H2CO3==H++HCO3—Ka1=c(H+)c(HCO3—)/c(H2CO3)=4.5×10—70.5分HCO3—==H++CO32—Ka2=c(H+)c(CO32—)/c(HCO3—)=4.7×10—110.5分pH=4.4,c(H+)=1.0×10—4mol·L—1c(H2CO3)=c(H+)c(HCO3—)/4.5×10—7=2.2×10—7c(HCO3—)c(CO32—)=c(HCO3—)×4.7×10—11/c(H+)=4.7×10—7c(HCO3—)溶液中以H2CO3为主,c(H2CO3)=1.0×10—2mol·L—11分pH=4.4,c(H+)=1.0×10—6mol·L—1c(H2CO3)=c(H+)c(HCO3—)/4.5×10—7=2.2c(HCO3—)c(CO32—)=c(HCO3—)×4.7×10—11/c(H+)=4.7×10—5c(HCO3—)1分溶液中以H2CO3和HCO3—形成缓冲溶液。c(HCO3—)=1.0×10—2mol·L—1/3.2=3.1×10—5mol·L—10.5分c(H2CO3)=2.2c(HCO3—)=6.8×10—3mol·L—10.5分其他计算方法合理,答案正确,也得满分。8-2图中a和b分别是pH=4.4和6.1的两条直线,分别写出与a和b相对应的轴的物种发生转化的方程式。a:UO22—+H2CO3—>UO2CO3+2H+1分b:UO2CO3+2HCO3——>UO2(CO3)22—+H2CO31分8-3分别写出与直线c和d相对应的电极反应,说明其斜率为正或负的原因。c:4UO22—+H2O+6e——>U4O9+2H+1分该半反应消耗H+,pH增大,H+浓度减小,不利于反应进行,故电极电势随pH增大而降低,即E—pH线的斜率为负。8-4在pH=4.0的缓冲体系中加入UCl3,写出反应方程式。d:U3++2H2O—>UO2+1/2H2+3H+2分由图左下部分的E(UO2/U3+)—pH关系推出,在pH=4.0时,E(UO2/U3+)远小于E(H+/H2),故UCl3加入水中,会发生上述氧化还原反应。8-5在pH=8.0~12之间,体系中UO2(CO3)34—和U4O9(s)能否共存?说明理由;UO2(CO3)34—和UO2(s)能否共存?说明理由。UO2(CO3)34—和U4O9能共存1分理由:E(UO2(CO3)34—/U4O9)低于E(O2/H2O)而高于E(H+/H2),因此,其氧化形态UO2(CO3)34—不能氧化水而生成O2,其还原形态U4O9(s)也不能还原水产生H2。1分若只答UO2(CO3)34—和U4O9(s)二者不反应,只得0.5分UO2(CO3)34—和UO2(s)不能共存1分理由:E(UO2(CO3)34—/U4O9)高于E(U4O9/UO2),当UO2(CO3)34—和UO2(s)相遇时,会发生反应:UO2(CO3)34—+3UO2+H2O==U4O9+2HCO3—+CO32—1分7\n第9题(12分)Knoevenagel反应是一类有用的缩合反应。如下图所示,丙二酸二乙酯与苯甲醛在六氢吡啶催化下生成2-苯亚甲基丙二酸二乙酯。9-1指出该反应中的亲核试剂。9-2简述催化剂六氢吡啶在反应中的具体作用。六氢吡啶与苯甲醛反应生成亚胺正离子,增加其亲电性。或:与丙二酸二乙酯的α-氢反应生成碳负离子(1分)或烯醇负离子,增强其亲核性(1分)。2分写出以上两种作用的,也得满分。丙二酸二乙酯(写结构简式也可以)写给1分答丙二酸二乙酯和六氢吡啶也得2分;只答六氢吡啶而未答出丙二酸二乙酯不得分。若笼统答丙二酸二乙酯负离子不得分。9-3化合物A是合成抗痉挛药物D(gabapentin)的前体。根据上述反应式,写出合成A的2个起始原料的结构简式。:和9-4画出由A制备D过程中中间体B、C和产物D的结构简式。第10题(6分)辣椒的味道主要来自辣椒素类化合物。辣椒素F的合成路线如下:画出化合物A、B、C、D、E和F的结构简式。7\n第11题(12分)11-1烯烃羟汞化反应的过程与烯烃的溴化相似。现有如下两个反应:4-戊烯-1-醇在相同条件下反应的主要产物为B。画出化合物A和B的结构简式。11-2下列有机化合物中具有芳香性的是2和5。共2分;各1分有错误选项不给分化合物A经过如下两步反应后生成化合物D,回答如下问题:11-3写出化合物B的名称臭氧,O3。1分答臭氧化物也可以的1分,其他答案不给分11-4圈出C中来自原料A中的氧原子。11-5画出化合物D的结构简式。1分其他答案不得分其他答案不给分7