- 1.75 MB
- 2022-07-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
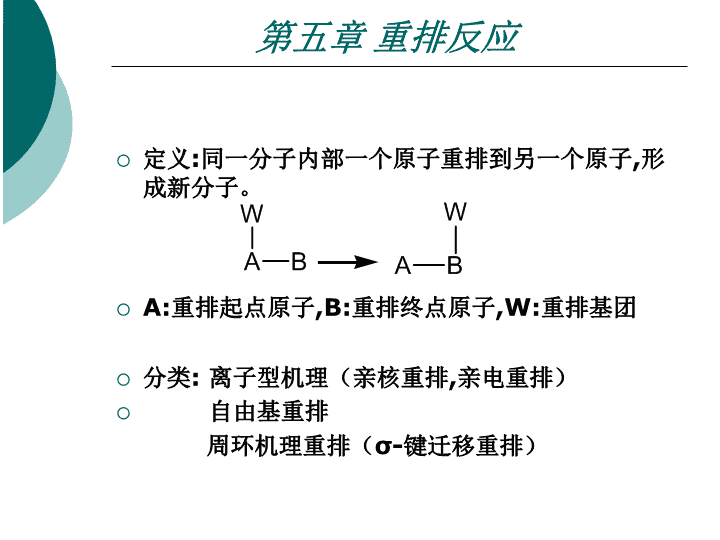
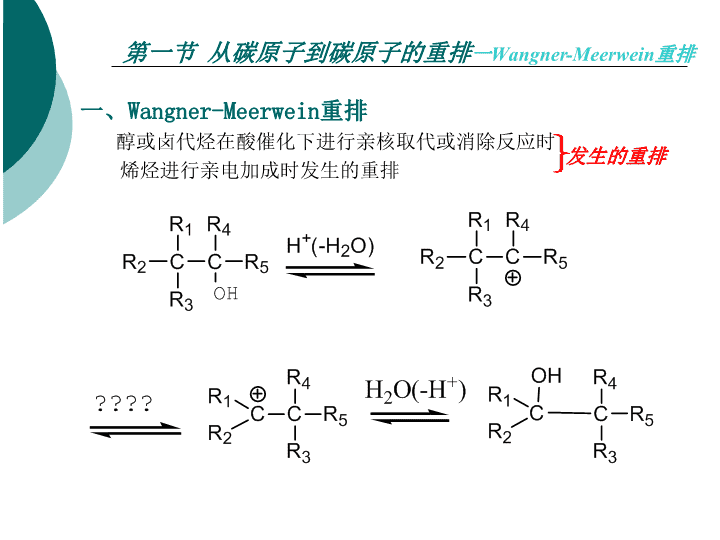
第五章重排反应Chapter5:RearrangementReaction\n第五章重排反应定义:同一分子内部一个原子重排到另一个原子,形成新分子。A:重排起点原子,B:重排终点原子,W:重排基团分类:离子型机理(亲核重排,亲电重排)自由基重排周环机理重排(σ-键迁移重排)\n第一节从碳原子到碳原子的重排一Wangner-Meerwein重排一、Wangner-Meerwein重排醇或卤代烃在酸催化下进行亲核取代或消除反应时烯烃进行亲电加成时发生的重排发生的重排\n第一节从碳原子到碳原子的重排一Wangner-Meerwein重排1形成C+形式(a)卤代烃Ag+AlCl3(b)含-NH2,重氮化放氮(c)-OH,加H+(-H2O)\n第一节从碳原子到碳原子的重排一Wangner-Meerwein重排2迁移基团迁移顺序\n第一节从碳原子到碳原子的重排一Wangner-Meerwein重排苯的迁移速度为甲基的3000倍\n第一节从碳原子到碳原子的重排一Wangner-Meerwein重排反应实例\n第一节从碳原子到碳原子的重排一Wangner-Meerwein重排\n第一节从碳原子到碳原子的重排二频纳醇重排(Pinacol)二Pinacol邻二醇(或邻二官能团)合成酮的方法机理:\n第一节从碳原子到碳原子的重排二频纳醇重排(Pinacol)1四取代乙二醇(a)四个取代基相同,单一产物(b)对称得单一产物\n第一节从碳原子到碳原子的重排二频纳醇重排(Pinacol)(C)\n第一节从碳原子到碳原子的重排二频纳醇重排(Pinacol)(d)\n第一节从碳原子到碳原子的重排二频纳醇重排(Pinacol)(e)羟基位于脂环上的连乙二醇\n第一节从碳原子到碳原子的重排二频纳醇重排(Pinacol)Semipinacol重排\n第一节从碳原子到碳原子的重排三、二苯基乙二酮——二苯乙醇酸型重排三、二苯基乙二酮——二苯乙醇酸型重排机理:\n第一节从碳原子到碳原子的重排三、二苯基乙二酮-二苯乙醇酸型重排特点:①碱(无机碱醇溶液),若有机碱(CH3ONa,t-BuOK)得酯②酮的结构\n第一节从碳原子到碳原子的重排三、二苯基乙二酮-二苯乙醇酸型重排应用实例:\n第一节从碳原子到碳原子的重排三、二苯基乙二酮-二苯乙醇酸型重排应用实例:\n第一节从碳原子到碳原子的重排四Favorski重排四Favorski(法沃尔斯基)重排α-基团迁移到卤素位置\n第一节从碳原子到碳原子的重排四Favorskii重排四Favorskii重排机理:\n第一节从碳原子到碳原子的重排四Favorski重排\n第一节从碳原子到碳原子的重排四Favorski重排\n第一节从碳原子到碳原子的重排五Wolff重排和Arndt-EistertWolff(沃尔夫)重排Arndt-Eistertα-重氮酮重排成乙烯酮\n第一节从碳原子到碳原子的重排五Wolff重排和Arndt-Eistert阿恩特-埃斯特尔特(Arndt-Eistert)合成\n第一节从碳原子到碳原子的重排五Wolff重排Arndt-Eistert\n第一节从碳原子到碳原子的重排五Wolff重排Arndt-Eistert\nCurtius(库尔悌斯)反应酰基叠氮化物在惰性溶剂中加热分解生成异氰酸酯异氰酸酯水解则得到胺:\nCurtius反应实例\nSchmidt(施密特)反应羧酸、醛或酮分别与等摩尔的叠氮酸(HN3)在强酸(硫酸、聚磷酸、三氯乙酸等)存在下发生分子内重排分别得到胺、腈及酰胺:其中以羧酸和叠氮酸作用直接得到胺的反应最为重要。羧酸可以是直链脂肪族的一元或二元羧酸、脂环酸、芳香酸等;与Hofmann重排、Curtius反应和相比,本反应胺的收率较高。\nSchmidt反应当R为手性碳原子时,重排后手性碳原子的构型不变:\n第二节由碳原子到杂原子的重排1Beckmann重排1Beckmann重排醛肟或酮肟在酸性催化剂作用下重排生成取代酰胺的反应机理:\n第二节由碳原子到杂原子的重排1Beckmann重排(1)催化剂:质子酸H+,H2SO4,HCl,H3PO4非质子酸PCl5,SOCl2,TsCl,AlCl3用质子酸(极性溶剂中)催化时存在异构化问题\n第二节由碳原子到杂原子的重排1Beckmann重排(2)肟的结构脂环酮肟发生扩环反应生成内酰胺芳酯酮肟不易发生异构化,得芳胺重派产物\n第二节由碳原子到杂原子的重排1Beckmann重排应用\n第二节由碳原子到杂原子的重排2Hofmann重排2Hofmann重排酰胺在次卤酸盐(如Br2/NaOH)的作用下,重派后继而水解生成少一个碳原子的伯胺。又叫霍夫曼降级。\n第二节由碳原子到杂原子的重排2Hofmann重排机理:\n第二节由碳原子到杂原子的重排2Hofmann重排当酰胺基的α-碳上有羟基、氨基、卤素、烯键时\n第二节由碳原子到杂原子的重排2Hofmann重排当酰胺基的α-碳上有手性,重派后,构型不变\n第二节由碳原子到杂原子的重排2Hofmann重排当酰胺分子的适当位置有羟基、氨基存在时,可以成环\n第二节由碳原子到杂原子的重排2Hofmann重排二元酸的酰亚胺:\n第三节丛杂原子到碳原子的重排一Stevens重排一、Stevens重排季铵盐(α-位有吸电子基)在碱催化条件下,重排生成叔胺的反应(连有活泼亚甲基的季铵盐的重排)机理:\n第三节丛杂原子到碳原子的重排一Stevens重排\n第三节丛杂原子到碳原子的重排一Stevens重排\n第三节丛杂原子到碳原子的重排二Witting重排二Witting重排醚类化合物在烃基锂或氨基钠等强碱的作用下醚分子中的一个烷基发生位移生成醇的反应\n第三节丛杂原子到碳原子的重排二Witting重排\n第四节δ键迁移重排σ键迁移反应叫σ重排反应。是指共轭体系:σ键从一端迁移到另一端\n第四节δ键迁移重排一、Claisen重排一、Claisen重排烯丙基乙烯基醚生成羰基\n第四节δ键迁移重排一、Claisen重排①烯丙醇+乙烯醚反应\n第四节δ键迁移重排一、Claisen重排②烯丙醇与原甲酸酯羧酮(醛)反应\n第四节δ键迁移重排一、Claisen重排\n第四节δ键迁移重排一、Claisen重排③羧酸烯丙酯与烯醇硅醚\n第四节δ键迁移重排二、芳香族Claisen重排二、芳香族Claisen重排\n第四节δ键迁移重排三Cope重排三Cope重排例\nCurtius(库尔悌斯)反应酰基叠氮化物在惰性溶剂中加热分解生成异氰酸酯异氰酸酯水解则得到胺:\nCurtius反应反应机理\nCurtius反应实例\nSchmidt(施密特)反应羧酸、醛或酮分别与等摩尔的叠氮酸(HN3)在强酸(硫酸、聚磷酸、三氯乙酸等)存在下发生分子内重排分别得到胺、腈及酰胺:其中以羧酸和叠氮酸作用直接得到胺的反应最为重要。羧酸可以是直链脂肪族的一元或二元羧酸、脂环酸、芳香酸等;与Hofmann重排、Curtius反应和相比,本反应胺的收率较高。\nSchmidt反应反应机理本反应的机理与Hofmann重排、Curtius反应和Lossen反应机理相似,也是形成异氰酸酯中间体\nSchmidt反应当R为手性碳原子时,重排后手性碳原子的构型不变:\nSchmidt反应实例\nSchmidt反应\nCurtius反应\nCurtius反应酰基叠氮化物在惰性溶剂中加热分解生成异氰酸酯异氰酸酯水解则得到胺:\nCurtius反应酰基叠氮化物在惰性溶剂中加热分解生成异氰酸酯异氰酸酯水解则得到胺:\n第三节丛杂原子到碳原子的重排一Stevens重排\n第一节从碳原子到碳原子的重排四Favorski重排