- 1.85 MB
- 2022-07-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
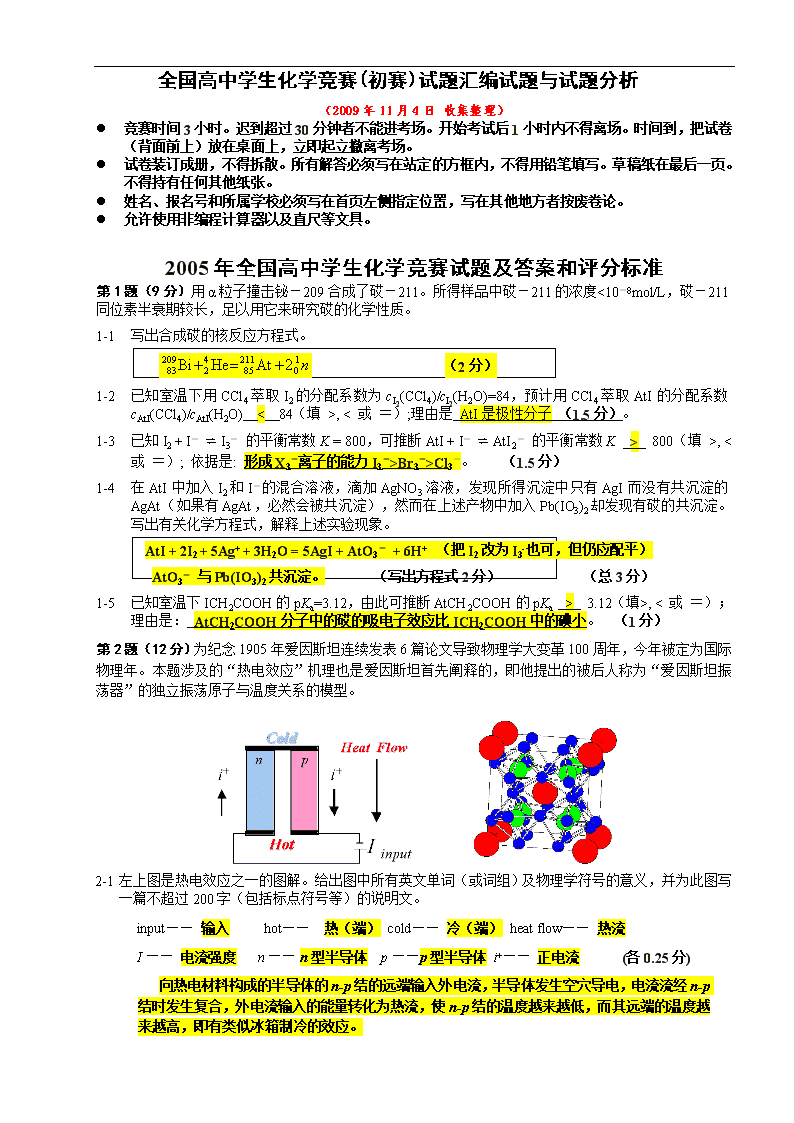
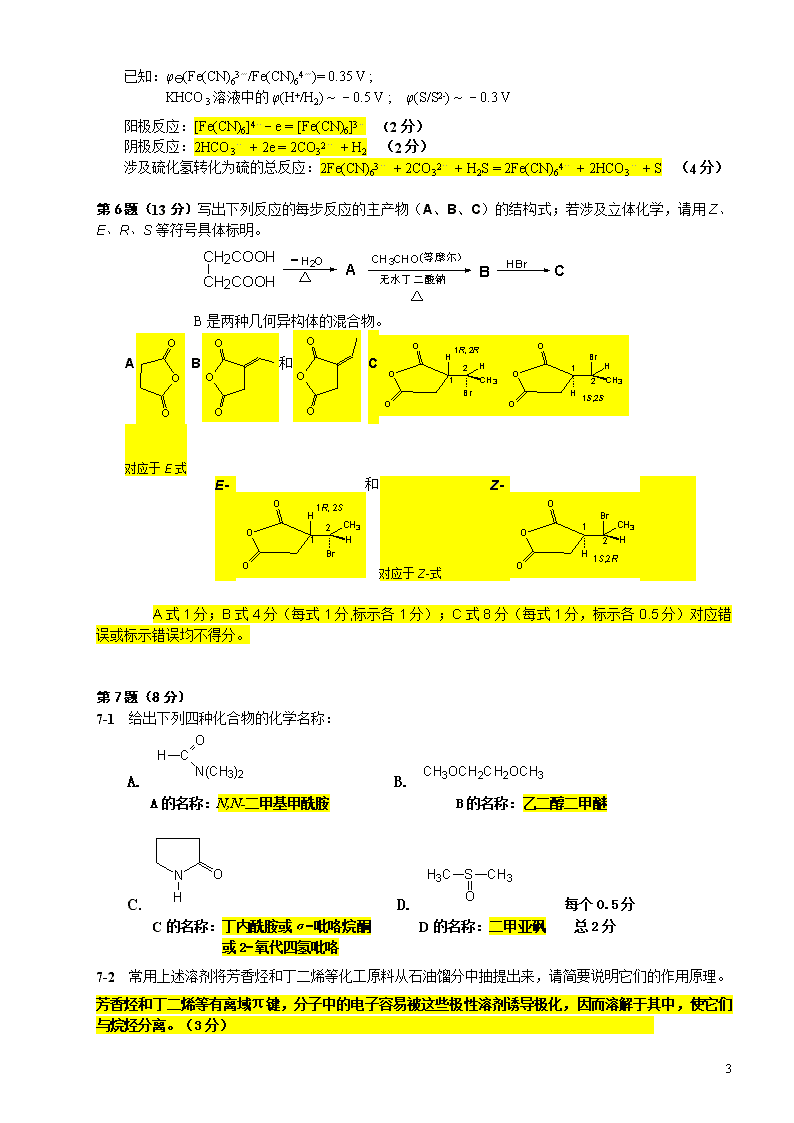
全国高中学生化学竞赛(初赛)试题汇编试题与试题分析(2009年11月4日收集整理)l竞赛时间3小时。迟到超过30分钟者不能进考场。开始考试后1小时内不得离场。时间到,把试卷(背面前上)放在桌面上,立即起立撤离考场。l试卷装订成册,不得拆散。所有解答必须写在站定的方框内,不得用铅笔填写。草稿纸在最后一页。不得持有任何其他纸张。l姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论。l允许使用非编程计算器以及直尺等文具。2005年全国高中学生化学竞赛试题及答案和评分标准第1题(9分)用α粒子撞击铋-209合成了砹-211。所得样品中砹-211的浓度<10-8mol/L,砹-211同位素半衰期较长,足以用它来研究砹的化学性质。1-1写出合成砹的核反应方程式。(2分)1-2已知室温下用CCl4萃取I2的分配系数为cI2(CCl4)/cI2(H2O)=84,预计用CCl4萃取AtI的分配系数cAtI(CCl4)/cAtI(H2O)<84(填>,<或=);理由是AtI是极性分子(1.5分)。1-3已知I2+I-⇌I3-的平衡常数K=800,可推断AtI+I-⇌AtI2-的平衡常数K>800(填>,<或=);依据是:形成X3-离子的能力I3->Br3->Cl3-。(1.5分)1-4在AtI中加入I2和I-的混合溶液,滴加AgNO3溶液,发现所得沉淀中只有AgI而没有共沉淀的AgAt(如果有AgAt,必然会被共沉淀),然而在上述产物中加入Pb(IO3)2却发现有砹的共沉淀。写出有关化学方程式,解释上述实验现象。AtI+2I2+5Ag++3H2O=5AgI+AtO3-+6H+(把I2改为I3-也可,但仍应配平)AtO3-与Pb(IO3)2共沉淀。(写出方程式2分)(总3分)1-5已知室温下ICH2COOH的pKa=3.12,由此可推断AtCH2COOH的pKa>3.12(填>,<或=);理由是:AtCH2COOH分子中的砹的吸电子效应比ICH2COOH中的碘小。(1分)第2题(12分)为纪念1905年爱因斯坦连续发表6篇论文导致物理学大变革100周年,今年被定为国际物理年。本题涉及的“热电效应”机理也是爱因斯坦首先阐释的,即他提出的被后人称为“爱因斯坦振荡器”的独立振荡原子与温度关系的模型。2-1左上图是热电效应之一的图解。给出图中所有英文单词(或词组)及物理学符号的意义,并为此图写一篇不超过200字(包括标点符号等)的说明文。input——输入hot——热(端)cold——冷(端)heatflow——热流I——电流强度n——n型半导体p——p型半导体i+——正电流(各0.25分)向热电材料构成的半导体的n-p结的远端输入外电流,半导体发生空穴导电,电流流经n-p结时发生复合,外电流输入的能量转化为热流,使n-p结的温度越来越低,而其远端的温度越来越高,即有类似冰箱制冷的效应。31\n(4分)2-1右上图是化学家合成的能实现热电效应的一种晶体的晶胞模型。图中的大原子是稀土原子,如镧;小原子是周期系第五主族元素,如锑;中等大小的原子是周期系VIII族元素,如铁。按如上结构图写出这种热电晶体的化学式。给出计算过程。提示:晶胞的6个面的原子数相同。设晶体中锑的氧化态为-1,镧的氧化态为+3,问:铁的平均氧化态多大?化学式LaFe4Sb12(2分)(写La2Fe8Sb24扣1分)铁的氧化态9/4=2.25(1分)计算化学式的过程如下:晶胞里有2个La原子(处于晶胞的顶角和体心);有8个Fe原子(处于锑形成的八面体的中心);锑八面体是共顶角相连的,平均每个八面体有6/2=3个锑原子,晶胞中共有8个八面体,8x3=24个锑原子;即:La2Fe8Sb24。其他合理过程也可。(3分)第3题(10分)等摩尔的丙酮和过氧化氢混合,在盐酸催化下生成白色粉末A和水,反应进行完全,产物分子总数是反应物分子总数的2/3。A在撞击、摩擦和加热时发生爆炸,被称为熵炸弹。3-1A分子中氧的化学环境相同。画出A的立体结构(H原子不必画出)。3-2A发生爆炸生成丙酮等物质,并不燃烧起火。写出爆炸的反应方程式。3-3为什么A被称为“熵炸弹”?3-4合成A是十分危险的,不慎会在合成时瞬即发生爆炸,例如,温度稍高,反应将生成A的同系物B,B的相对分子质量为A的2/3。画出B的结构;B比A更容易爆炸,应如何从结构上理解?(注:在H2O2分子中的H—O—O夹角约95oC,面夹角约112oC。)3-1参考图:(注:分子中C-O-O-C不在一个平面上)(4分)3-2C9H18O6=3+O3(或3/2O2)(2分)3-3爆炸反应不是燃烧反应,能量改变不大,是由于生成大量气态小分子导致的熵增加效应,因而称为“熵炸弹”。(1分)3-4参考图:B是双聚分子,分子的六元环不能满足过氧团的正常键角(C-O-O-C面间角和C-O-O键角)的需要,导致分子张力太大而不稳定。(3分)第4题(6分)本题涉及3种组成不同的铂配合物,它们都是八面体的单核配合物,配体为OH-和/或Cl-。4-1PtCl4·5H2O的水溶液与等摩尔NH3反应,生成两种铂配合物,反应式为:2H2[PtCl4(OH)2]+2NH3=(NH4)2[PtCl6]+H2[PtCl2(OH)4]或H2[PtCl6]+(NH4)2[PtCl2(OH)4]或NH4H[PtCl6]+NH4H[PtCl2(OH)4](3分)4-2BaCl2·PtCl4和Ba(OH)2反应(摩尔比2:5),生成两种产物,其中一种为配合物,该反应的化学方程式为:2Ba[PtCl6]+5Ba(OH)2=2Ba[PtCl(OH)5]+5BaCl2(3分)翻印无效第5题(8分)气态废弃物中的硫化氢可用下法转化为可利用的硫:配制一份电解质溶液,主要成分为:K4[Fe(CN)6](200g/L)和KHCO3(60g/L);通电电解,控制电解池的电流密度和槽电压,通入H2S气体。写出相应的反应式。31\n已知:φy(Fe(CN)63-/Fe(CN)64-)=0.35V;KHCO3溶液中的φ(H+/H2)~-0.5V;φ(S/S2-)~-0.3V阳极反应:[Fe(CN)6]4--e=[Fe(CN)6]3-(2分)阴极反应:2HCO3-+2e=2CO32-+H2(2分)涉及硫化氢转化为硫的总反应:2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S(4分)第6题(13分)写出下列反应的每步反应的主产物(A、B、C)的结构式;若涉及立体化学,请用Z、E、R、S等符号具体标明。B是两种几何异构体的混合物。AB和C对应于E式E-和对应于Z-式Z-A式1分;B式4分(每式1分,标示各1分);C式8分(每式1分,标示各0.5分)对应错误或标示错误均不得分。第7题(8分)7-1给出下列四种化合物的化学名称:A.B.A的名称:N,N-二甲基甲酰胺B的名称:乙二醇二甲醚C.D.每个0.5分C的名称:丁内酰胺或α−吡咯烷酮D的名称:二甲亚砜总2分或2−氧代四氢吡咯7-2常用上述溶剂将芳香烃和丁二烯等化工原料从石油馏分中抽提出来,请简要说明它们的作用原理。芳香烃和丁二烯等有离域π键,分子中的电子容易被这些极性溶剂诱导极化,因而溶解于其中,使它们与烷烃分离。(3分)31\n7-3选出下列顺磁性物种(用物种前面的字母表示):A.Cr(H2O)62+B.Fe(CO)5C.N2O-ON2D.[N(C6H4OCH3)3]+顺磁性物种是:A;D.(3分)第8题(12分)LiCl和KCl同属NaCl型晶体,其熔点分别为614℃和776℃。Li+、K+和Cl-的半径分别为76pm、133pm和181pm。在电解熔盐LiCl以制取金属锂的生产工艺中,加入适量的KCl晶体,可使电解槽温度下降至400℃,从而使生产条件得以改善。8-1简要说明加入熔点高的KCl反而使电解温度大大下降的原因;熔点降低效应;或形成有低共熔点的二元体系;或固相不互溶,而在液相中产生混合熵。(2分:三者中答出任一者可得2分)8-2有人认为,LiCl和KCl可形成固溶体(并画出了“固溶体的晶胞”)。但实验表明,液相LiCl和KCl能以任意比例混溶而它们的固相完全不混溶(即不能生成固溶体!)。请解释在固相中完全不混溶的主要原因。在固相中,离子呈周期性排列,对“相似相溶”的“相似条件”的要求比液相中严格得多。LiCl和KCl的结构型式相同,Li+和K+的电价相等,Li和K的电负性差别也有限。显然,两个组分在固相中完全不互溶源于Li+和K+的半径差别太大。(2分,关键要回答出最后一句话)8-3写出计算LiCl和KCl两种晶体密度之比的表达式(须包含离子半径的符号);(2分)只写出最后的表达式也可8-4在KCl晶体中,K+离子占据由Cl-离子围成的八面体空隙,计算相距最近的八面体空隙中心之间的距离。==(133+181)×2pm=444pm(2分;方法正确但结果算错扣0.5分)8-5实验证明,即使产生了阳离子空位,KCl晶体在室温下也不导电。请通过计算加以说明。可按如下思路说明:离子晶体能够导电是由于离子离开原位而迁移到距离最近的空位所致。迁移中必须经过由异号离子围成的最小窗孔。比较离子半径和窗孔的大小,可判断能否发生迁移,即能否成为快离子导体。取体积为KCl正当晶胞体积1/8的小立方体(见图)来考虑。三个分布在正当晶胞0,0,0;1/2,0,1/2;0,1/2,1/2位置的Cl-围成的三角形半径为:该半径远小于K+的半径,K+不能穿过此窗口,因而KCl晶体不能成为固体离子导体。大白球为Cl-,黑球为K+,虚线球为空位(4分;思路和方法正确但计算结果错误可得2分)。31\n第9题(12分)一种鲜花保存剂(preservativeofcutflowers)B可按以下方法制备:把丙酮肟、溴乙酸、氢氧化钾混合在1,4-二氧六环(溶剂)中反应,酸化后用乙醚提取,蒸去乙醚后经减压蒸馏析离出中间产物A,A用1:1盐酸水溶液水解,水解液浓缩后加入异丙醇(降低溶解度),冷却,即得到晶态目标产物B,B的熔点152~153oC(分解),可溶於水,与AgNO3溶液形成AgCl沉淀。 用银定量法以回滴方式(用NH4SCN回滴过量的AgNO3)测定目标产物B的相对分子质量,实验过程及实验数据如下: (1)用250毫升容量瓶配制约0.05mol/L的AgNO3溶液,同时配置250mL浓度相近的NH4SCN溶液。 (2)准确称量烘干的NaCl207.9mg,用100毫升容量瓶定容。 (3)用10毫升移液管移取上述 AgNO3溶液到50毫升锥瓶中,加入4mL4mol/LHNO3和1mL饱和铁铵矾溶液,用NH4SCN溶液滴定,粉红色保持不褪色时为滴定终点,三次实验的平均值为6.30mL。 (4)用10毫升移液管移取NaCl溶液到50毫升锥瓶中,加入10mLAgNO3溶液、4mL4mol/LHNO3和1mL饱和铁铵矾溶液,用NH4SCN 溶液回滴过量的AgNO3,三次实验结果平均为1.95mL。 (5)准确称量84.0mg产品B,转移到50毫升锥瓶中,加适量水使其溶解,加入10mLAgNO3溶液、4mL4mol/LHNO3和1mL饱和铁铵矾溶液,用NH4SCN溶液回滴,消耗了1.65mL。 (6)重复操作步骤(5),称量的B为81.6mg,消耗的NH4SCN溶液为1.77mL;称量的B为76.8mg,消耗的NH4SCN溶液为2.02mL。 9-1按以上实验数据计算出产物B的平均相对分子质量。 用质谱方法测得液相中B的最大正离子的相对式量为183。 9-2 试写出中间产物A和目标产物B的结构式。 9-1计算过程:先计算体积比;然后标定硝酸银的浓度;用标定的硝酸银计算目标产物的摩尔质量。结果:AgNO3的浓度为0.0515mol/LB的相对分子质量:220(近似值)6分9-2O-羧甲基丙酮肟,二聚氨氧乙酸一盐酸盐A2分B4分第10题(10分)据世界卫生组织统计,全球约有8000万妇女使用避孕环。常用避孕环都是含金属铜的。据认为,金属铜的避孕机理之一是,铜与子宫分泌物中的盐酸以及子宫内的空气反应,生成两种产物,一种是白色难溶物S,另一种是酸A。酸A含未成对电子,是一种自由基,具有极高的活性,能杀死精子。10-1写出铜环产生A的化学方程式。10-2画出A分子的立体结构。10-3给出难溶物S和酸A的化学名称。10-4A是一种弱酸,pK=4.8问:在pH=6.8时,A主要以什么形态存在?10-1.Cu+HCl+O2=CuCl+HO23分10-231\n注:画O-O单键不扣分,但分子不画成角型不得分。3分10-3.A:超氧酸2分10-4.几乎完全电离为超氧离子。2分2006年全国高中学生化学竞赛试题及答案和评分标准第1题(4分)2006年3月有人预言,未知超重元素第126号元素有可能与氟形成稳定的化合物。按元素周期系的已知规律,该元素应位于第八周期,它未填满电子的能级应是5g,在该能级上有8个电子,而这个能级总共可填充18个电子。(各1分)第2题(5分)下列反应在100oC时能顺利进行:III2-1给出两种产物的系统命名。(4分)2-2这两种产物互为下列哪一种异构体?(1分)A旋光异构体B立体异构体C非对映异构体D几何异构体2-1I(7S,3Z,5Z)-3-甲基-7-氘代-3,5-辛二烯或(7S,3Z,5Z)-3-甲基-3,5-辛二烯-7-d或(7S,3Z,5Z)-3-甲基-7-2H-3,5-辛二烯(注:只要标出氘的位置即可)(2分)II(7R,3E,5Z)-3-甲基-7-氘代-3,5-辛二烯或(7R,3E,5Z)-3-甲基-3,5-辛二烯-7-d或(7R,3E,5Z)-3-甲基-7-2H-3,5-辛二烯(注:只要标出氘的位置即可)用cis-、trans-代替Z-、E-得分相同(下同)(2分)2-2B(立体异构体)(1分)第3题(8分)下面四张图是用计算机制作的在密闭容器里,在不同条件下进行的异构化反应X⇌Y的进程图解。图中的“”是X,“”是Y。ABCD3-1图中的纵坐标表示(填入物理量,下同);横坐标表示。3-2平衡常数K最小的图是。3-3平衡常数K最大的图是。3-4平衡常数K=1的图是。答案:3-1A和B的摩尔百分数(或答:物质的量的分数或物质的量的百分数);时间,分(或答:以分为单位的反应进程)(2分)3-2A(2分)3-3B(2分)3-4C(2分)31\n第4题(7分)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的菱锰矿(贫矿)转化为高品位“菱锰矿砂”的绿色工艺。该工艺首先将矿砂与硫酸铵一起焙烧,较佳条件是:投料比m[(NH4)2SO4]/m[MnCO3]=1.5;焙烧温度450oC;焙烧时间1.5小时。4-1写出焙烧反应方程式:(NH4)2SO4+MnCO3=MnSO4+2NH3↑+CO2↑+H2O↑ (1分)4-2其次,将焙烧产物转化为高品位的“菱锰矿砂”,写出反应方程式:MnSO4+2NH3+CO2+H2O=(NH4)2SO4+MnCO3↓ (2分)4-3若焙烧温度过高或时间过长,将导致什么结果?MnSO4,MnCO3分解生成高价锰的氧化物而导致锰浸出率下降。 (2分)4-4从物料平衡角度看,生产过程中是否需要添加(NH4)2SO4?说明理由。不需加。开始投料时(NH4)2SO4(132g﹒mol-1)过量(MnCO3,115g﹒mol-1),反应生成的NH3、CO2以及(NH4)2SO4可循环利用。 (2分)第5题(6分)配制KI(0.100mol·L-1)–I2的水溶液,用0.100mol·L-1Na2S2O3标准溶液测得c(I2)=4.85×10-3mol·L-1。量取50.0mLKI-I2溶液和50.0mLCCl4置于分液漏斗中振荡达平衡,分液后测知CCl4相中c(I2)=2.60×10-3mol·L-1。已知实验温度下CCl4从水溶液中萃取I2的分配比为85:1。求水溶液中I2+I¯=I¯3的平衡常数。设萃取平衡时,水溶液中c(I2)为xc(I2,CCl4)/c(I2,H2O)=2.60x10-3mol·L-1/x=85x=2.60x10-3mol·L-1/85=3.06×10-5mol·L-1(2分)水溶液中I2+I¯=I3¯平衡浓度(mol·L-1):I2:3.06×10-5;I¯:0.100-3.06×10-5=0.100(1分)I¯3:(4.85-2.60)×10-3-3.06×10-5=2.22×10-3(1分)K=2.22×10-3mol·L-1/0.100mol·L-1×3.06×10-5mol·L-1=7.3×102L·mol-1(不写单位不扣分)(1分)第6题(9分)潜在储氢材料——化合物A是第二周期两种氢化物形成的路易斯酸碱对,是乙烷的等电子体,相对分子质量30.87,常温下为白色晶体,稳定而无毒。刚刚融化的A缓慢释放氢气,转变为化合物B(乙烯的等电子体)。B不稳定,易聚合成聚合物C(聚乙烯的等电子体)。C在155oC释放氢气转变为聚乙炔的等电子体,其中聚合度为3的化合物D是苯的等电子体。高于500oC时D释放氢气,转变为化合物E,E有多种晶型。6-1写出A、B、C、D、E的化学式。AH3B:NH3(或BNH6)BH2B=NH2(或BNH4)C—H2B-NH2—nDB3N3H6EBN(5分)6-2化合物A转变为E各步释放的氢所占的质量分数以及总共释放的氢气所占的质量分数多大?A→B2.016/30.87=6.531%(或0.06531)B→D2.016/28.85=6.988%(或0.06988)D→E6.048/26.84=7.511%(或0.07511)A→E6.048/30.87=19.59%(或0.1959)(2分)6-3为使A再生,有人设计了化合物D在水蒸气存在下与甲烷反应,写出化学方程式。3CH4+2(HBNH)3+6H2O=3CO2+6H3BNH3(2分)第7题(11分)化合物A是近十年开始采用的锅炉水添加剂。A的相对分子质量90.10,可形成无色晶体,能除去锅炉水中溶解氧,并可使锅炉壁钝化。7-1A是用碳酸二甲酯和一水合肼在70oC下合成的,收率80%。画出A的结构式。注:C-N-N角必须不是直线。(2分)31\n7-2写出合成A的反应方程式。O=C(OCH3)2+2H2NNH2·H2O=O=C(NHNH2)2+2CH3OH+2H2O(1分)7-3低于135oC时,A直接与溶解氧反应,生成三种产物。写出化学方程式。(N2H 3)2CO+2O2=2N2+CO2+3H2O(1分)7-4高于135oC时,A先发生水解,水解产物再与氧反应。写出化学方程式。(N2H 3)2CO+H2O=2N2H4+CO2N2H4+O2=N2+2H2O(1分)7-5化合物A能使锅炉壁钝化是基于它能将氧化铁转化为致密的四氧化三铁。写出化学方程式。(N2H 3)2CO+12Fe2O3=8Fe3O4+2N2+CO2+3H2O(2分)7-6化合物A与许多金属离子形成八面体配合物,例如[Mn(A)3]2+。结构分析证实该配合物中的A和游离态的A相比,分子中原本等长的两个键不再等长。画出这种配合物的结构简图(氢原子不需画出),讨论异构现象。(2分)有一对经式、面式异构体(几何异构体)(1分)它们分别有一对对映异构体(手性异构体)(1分)(画不画异构体的结构不影响得分。)第8题(9分)超硬材料氮化铂是近年来的一个研究热点。它是在高温、超高压条件下合成的(50GPa、2000K)。由于相对于铂,氮原子的电子太少,衍射强度太弱,单靠X-射线衍射实验难以确定氮化铂晶体中氮原子数和原子坐标,2004年以来,先后提出过氮化铂的晶体结构有闪锌矿型、岩盐型(NaCl)和萤石型,2006年4月11日又有人认为氮化铂的晶胞如下图所示(图中的白球表示氮原子,为便于观察,该图省略了一些氮原子)。结构分析证实,氮是四配位的,而铂是六配位的;Pt—N键长均为209.6pm,N—N键长均为142.0pm(对比:N2分子的键长为110.0pm)。备用图8-1氮化铂的上述四种立方晶体在结构上有什么共同点?铂原子面心立方最密堆积。(2分)8-2分别给出上述四种氮化铂结构的化学式。依次为PtN、PtN、PtN2、PtN2(2分)8-3试在图上挑选一个氮原子,不添加原子,用粗线画出所选氮原子的配位多面体。31\n(3分)8-4请在本题的附图上添加六个氮原子(添加的氮请尽可能靠前)。(2分)第9题(10分)环磷酰胺是目前临床上常用的抗肿瘤药物,国内学者近年打破常规,合成了类似化合物,其毒性比环磷酰胺小,若形成新药,可改善病人的生活质量,其中有一个化合物的合成路线如下,请完成反应,写出试剂或中间体的结构。(C16H25N5O4PCl)注:NBS即N-溴代丁二酰亚胺。答案:ABC(1分)(1分)(1分)DE31\n(1分)(二氯改为二溴也可)(2分)FG(3分)F·HCl(1分)第10题(10分)以氯苯为起始原料,用最佳方法合成1-溴-3-氯苯(限用具有高产率的各反应,标明合成的各个步骤)。6个中间物每个1分,共6分;每步的试剂0.5分,共4分(用C2H5OH代替H3PO2得分相同)第11题(11分)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。11-1.写出合成磷化硼的化学反应方程式。BBr3+PBr3+3H2=BP+6HBr(1分)11-2.分别画出三溴化硼分子和三溴化磷分子的结构。(画不画磷上的孤对电子不影响得分)平面三角形三角锥(2分)11-3磷化硼晶体中磷原子作立方最密堆积,硼原子填入四面体空隙中。画出磷化硼的正当晶胞示意图。31\n(注:填入另外四个四面体空隙也可,但不能一层空一层填)(2分)11-4已知磷化硼的晶胞参数a=478pm,计算晶体中硼原子和磷原子的核间距(dB-P)。dB-P=或dB-P=pm(2分)11-5画出磷化硼正当晶胞沿着体对角线方向的投影(用实线圆圈表示P原子的投影,用虚线圆圈表示B原子的投影)。(4分)第12题(10分)有人设计了如下甲醇(methanol)合成工艺:其中,①为甲烷气源,压强250.0kPa,温度25oC,流速55.0m3﹒s-1。②为水蒸气源,压强200.0kPa,温度150oC,流速150.0m3﹒s-1。合成气和剩余反应物的混合物经管路③进入25oC的冷凝器(condenser),冷凝物由管路⑤流出。在B中合成的甲醇和剩余反应物的混合物经⑥进入25oC的冷凝器,甲醇冷凝后经管路⑦流出,其密度为0.791g﹒mL-1。12-1.分别写出在步骤A和步骤B中所发生的化学反应的方程式。CH4(g)+H2O(g)=CO(g)+3H2(g)(1分)CO(g)+2H2(g)=CH3OH(g)(1分)12-2.假定:所有气体皆为理想气体,在步骤A和B中完全转化,气液在冷凝器中完全分离,计算经步骤A和步骤B后,在一秒钟内剩余物的量。n(CH4)=(250.0×103×55.0)/(8.314×298)=5.55×103(mol)n[H2O(g)]=(200.0×103×150.0)/(8.314×423)=8.53×103(mol)经步骤A后在③中过量的H2O(g)=(8.53×103-5.55×103)mol=2.98×103mol(1分)在步骤A中生成的CO和H2的摩尔比为1:3,而在步骤B中消耗的CO和H2的摩尔比为1:2,故经步骤B后剩余的H2为5.55×103mol(1分)12-3.实际上,在步骤B中CO的转化率只有三分之二。计算在管路⑥中CO、H2和CH3OH的分压(总压强为10.0MPa)。31\nnT=n(CO)+n(H2)+n(CH3OH)={5.55×103×1/3+(16.65×103-5.55×103×2/3×2)+5.55×103×2/3}mol=14.8×103mol(1分)p(i)=pT×ni/nT总p(CO)=10.0MPa×(5.55×103×1/3/14.8×103)=0.125MPa(1分)p(H2)=10.0MPa×(9.25×103/14.8×103)=0.625MPa(1分)p(CH3OH)=10.0MPa×(5.55×103×2/3/14.8×103)=0.250MPa(1分)12-4.当甲醇反应器足够大,反应达到平衡,管路⑥中的各气体的分压服从方程式中p0=0.100MPa,计算平衡常数Kp。Kp=0.250×(0.100)2/(0.125×0.6252)=5.12×10-2(2分)2007年全国高中学生化学竞赛(省级赛区)试题第1题(12分)通常,硅不与水反应,然而,弱碱性水溶液能使一定量的硅溶解,生成Si(OH)4。1-1已知反应分两步进行,试用化学方程式表示上述溶解过程。早在上世纪50年代就发现了CH5+的存在,人们曾提出该离子结构的多种假设,然而,直至1999年,才在低温下获得该离子的振动-转动光谱,并由此提出该离子的如下结构模型:氢原子围绕着碳原子快速转动;所有C-H键的键长相等。1-2该离子的结构能否用经典的共价键理论说明?简述理由。1-3该离子是()。A.质子酸B.路易斯酸C.自由基D.亲核试剂2003年5月报道,在石油中发现了一种新的烷烃分子,因其结构类似于金刚石,被称为“分子钻石”,若能合成,有可能用做合成纳米材料的理想模板。该分子的结构简图如下:1-4该分子的分子式为;1-5该分子有无对称中心?1-6该分子有几种不同级的碳原子?1-7该分子有无手性碳原子?1-8该分子有无手性?第2题(5分)羟胺和用同位素标记氮原子(N﹡)的亚硝酸在不同介质中发生反应,方程式如下:NH2OH+HN﹡O2→A+H2ONH2OH+HN﹡O2→B+H2OA、B脱水都能形成N2O,由A得到N﹡NO和NN﹡O,而由B只得到NN﹡O。请分别写出A和B的路易斯结构式。第3题(8分)X-射线衍射实验表明,某无水MgCl2晶体属三方晶系,呈层形结构,氯离子采取立方最密堆积(ccp),镁离子填满同层的八面体空隙;晶体沿垂直于氯离子密置层的投影图如下。该晶体的六方晶胞的参数:a=363.63pm,c=1766.63pm;p=2.53g·cm-3。31\n3-1以“”表示空层,A、B、C表示Cl-离子层,a、b、c表示Mg2+离子层,给出三方层型结构的堆积方式。3-2计算一个六方晶胞中“MgCl2”的单元数。3-3假定将该晶体中所有八面体空隙皆填满Mg2+离子,将是哪种晶体结构类型?第4题(7分)化合物A是一种热稳定性较差的无水的弱酸钠盐。用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表:样品中A的质量分数/%20507090样品的质量损失/%7.418.525.833.3利用上述信息,通过作图,推断化合物A的化学式,并给出计算过程。第5题(10分)甲苯与干燥氯气在光照下反应生成氯化苄,用下列方法分析粗产品的纯度:称取0.255g样品,与25mL4mol·L-1氢氧化钠水溶液在100mL圆底烧瓶中混合,加热回流1小时;冷至室温,加入50mL20%硝酸后,用25.00mL0.1000mol·L-1硝酸银水溶液处理,再用0.1000mol·L-1NH4SCN水溶液滴定剩余的硝酸银,以硫酸铁铵为指示剂,消耗了6.75mL。5-1写出分析过程的反应方程式。5-2计算样品中氯化苄的质量分数(%)。5-3通常,上述测定结果高于样品中氯化苄的实际含量,指出原因。5-4上述分析方法是否适用于氯苯的纯度分析?请说明理由。第6题(12分)在给定实验条件下,一元弱酸HA在苯(B)和水(W)的分配系数KD=[HA]B/[HA]W=1.00。已知水相和苯相中HA的分析浓度分别为3.05×10-3和3.96×10-3mol·L-1。在水中,HA按HA⇌H++A-解离,Ka=1.00×10-4;在苯中,HA发生二聚:2HA⇌(HA)2。6-1计算水相中各物种的浓度及pH。31\n6-2计算化合物HA在苯相中的二聚平衡常数。6-3已知HA中有苯环,1.00gHA含3.85×1021个分子,给出HA的化学名称。6-4解释HA在苯中发生二聚的原因,画出二聚体的结构。第7题(8分)KClO3热分解是实验室制取氧气的一种方法。KClO3在不同的条件下热分解结果如下:实验反应体系第一放热温度/℃第二放热温度/℃AKClO3400480BKClO3+Fe2O3360390CKClO3+MnO2350已知⑴K(s)+1/2Cl2(g)=KCl(s)△H(1)=-437kJ·mol-1⑵K(s)+1/2Cl2+3/2O2(g)=KClO3(s)△H(2)=-398kJ·mol-1⑶K(s)+1/2Cl2+2O2(g)=KClO4(s)△H(3)=-433kJ·mol-17-1根据以上数据,写出上述三个体系对应的分解过程的热化学方程式。7-2用写MnO2催化KClO3分解制得的氧气有轻微的刺激性气味,推测这种气体是什么,并提出确认这种气体的实验方法。第8题(4分)用下列路线合成化合物C:反应结束后,产物中仍含有未反应的A和B。8-1请给出从混合物中分离出C的操作步骤;简述操作步骤的理论依据。8-2生成C的反应属于哪类基本有机反应类型。第9题(10分)根据文献报道,醛基可和双氧水发生如下反应:为了合成一类新药,选择了下列合成路线:9-1请写出A的化学式,画出B、C、D和缩醛G的结构式。9-2由E生成F和F生成G的反应分别属于哪类基本有机反应类型。9-3请画出化合物G的所有光活异构体。31\n第10题(12分)尿素受热生成的主要产物与NaOH反应,得到化合物A(三钠盐)。A与氯气反应,得到化合物B,分子式C3N3O3Cl3。B是一种大规模生产的化工产品,全球年产达40万吨以上,我国年生产能力达5万吨以上。B在水中能持续不断地产生次氯酸和化合物C,因此广泛用于游泳池消毒等。10-1画出化合物A的阴离子的结构式。10-2画出化合物B的结构式并写出它与水反应的化学方程式。10-3化合物C有一个互变异构体,给出C及其互变异构体的结构式。10-4写出上述尿素受热发生反应的配平方程式。第11题(12分)石竹烯(Caryophyllene,C15H24)是一种含双键的天然产物,其中一个双键的构型是反式的,丁香花气味主要是由它引起的,可从下面的反应推断石竹烯及其相关化合物的结构。反应1:反应2:反应3:反应4:石竹烯异构体—异石竹烯在反应1和反应2中也分别得到产物A和B,而在经过反应3后却得到了产物C的异构体,此异构体在经过反应4后仍得到了产物D。11-1在不考虑反应生成手性中心的前提下,画出化合物A、C以及C的异构体的结构式;11-2画出石竹烯和异石竹烯的结构式;11-3指出石竹烯和异石竹烯的结构差别。答案及评分标准第1题(12分)1-1Si+4OH−=SiO44−+2H2(1分)SiO44−+4H2O=Si(OH)4+4OH−(1分)若写成Si+2OH−+H2O=SiO32−+2H2SiO32−+3H2O=Si(OH)4+2OH−,也得同样的分。但写成Si+4H2O=Si(OH)4+2H2不得分。写不写↓(沉淀)和↑(气体)不影响得分。1-2不能。(1分)31\n经典共价键理论认为原子之间通过共享电子对而成键。C为第二周期元素,只有4个价层轨道,最多形成4个共价键。(1分)理由部分:答“C原子无2d轨道,不能形成sp3d杂化轨道”,得1分;只答“C原子没有2d轨道”,得0.5分;只答“C原子有4个价电子”,得0.5分;答CH5+中有一个三中心二电子键,不得分(因按三中心二电子键模型,CH5+离子的C-H键不等长)。1-3A或质子酸(多选或错选均不得分。)(2分)1-4C26H30(分子式不全对不得分)(2分)1-5有(1分)1-63种(答错不得分)(1分)1-7有(1分)1-8无(1分)第2题(6分)(每式3分)对每一式,只写对原子之间的连接顺序,但未标对价电子分布,只得1分;未给出立体结构特征不扣分;未标出同位素符号不扣分,但B中将星号标错位置扣0.5分。第3题(10分)3-1···AcBCbABaCA···(5分)大写字母要体现出Cl-层作立方最密堆积的次序,镁离子与空层的交替排列必须正确,镁离子层与氯离子层之间的相对位置关系(大写字母与小写字母的相对关系)不要求。必须表示出层型结构的完整周期,即至少写出包含6个大写字母、3个小写字母、3个空层的排列。若只写对含4个大写字母的排列,如“···AcBCbA···”,得2.5分。3-2(3分)Z的表达式对,计算过程修约合理,结果正确(Z=3.00—3.02,指出单元数为整数3),得3分。Z的表达式对,但结果错,只得1分。3-3NaCl型或岩盐型(2分)第4题(7分)根据所给数据,作图如下:由图可见,样品的质量损失与其中A的质量分数呈线性关系,由直线外推至A的质量分数为100%,31\n即样品为纯A,可得其质量损失为37.0%。作图正确,外推得纯A质量损失为(37.0±0.5)%,得4分;作图正确,得出线性关系,用比例法求出合理结果,也得4分;仅作图正确,只得2分。样品是热稳定性较差的无水弱酸钠盐,在常见的弱酸盐中,首先考虑碳酸氢钠,其分解反应为:2NaHCO3=Na2CO3+H2O↑+CO2↑该反应质量损失分数为(44.0+18.0)/(2×84.0)=36.9%,与上述外推所得数据吻合。化合物A的化学式是NaHCO3。根据所给条件并通过计算质量损失,答对NaHCO3得3分。答出NaHCO3但未给出计算过程,只得1分。其他弱酸钠盐通过计算可排除,例如Na2CO3质量损失分数为41.5%,等等。第5题(10分)5-1(4分)C6H5CH2Cl+NaOH=C6H5CH2OH+NaClNaOH+HNO3=NaNO3+H2O(此式不计分)AgNO3+NaCl=AgCl↓+NaNO3NH4SCN+AgNO3=AgSCN↓+NH4NO3Fe3++SCN-=Fe(SCN)2+每式1分;写出正确的离子方程式也得满分;最后一个反应式写成Fe3++3SCN-=Fe(SCN)3也可。5-2(2分)样品中氯化苄的摩尔数等于AgNO3溶液中Ag+的摩尔数与滴定所消耗的NH4SCN的摩尔数的差值,因而,样品中氯化苄的质量分数为M(C6H5CH2Cl)×[0.1000×(25.00-6.75)]/255={126.6×[0.1000×(25.00-6.75)]/255}×100%=91%算式和结果各1分;若答案为90.6%,得1.5分(91%相当于三位有效数字,90.6%相当于四位有效数字)。5-3(2分)测定结果偏高的原因是在甲苯与Cl2反应生成氯化苄的过程中,可能生成少量的多氯代物C6H5CHCl2和C6H5CCl3,反应物Cl2及另一个产物HCl在氯化苄中也有一定的溶解,这些杂质在与NaOH反应中均可以产生氯离子,从而导致测定结果偏高。凡答出由以下情况导致测定结果偏高的均得满分:1)多氯代物、Cl2和HCl;2)多氯代物和Cl2;3)多氯代物和HCl;4)多氯代物。凡答出以上任何一种情况,但又提到甲苯的,只得1分。若只答Cl2和/或HCl的,只得1分。5-4(2分)不适用。(1分)氯苯中,Cl原子与苯环共轭,结合紧密,难以被OH−交换下来。(1分)氯苯与碱性水溶液的反应须在非常苛刻的条件下进行,而且氯苯的水解也是非定量的。第6题(12分)6-1(4分)HA在水中存在如下电离平衡:HA=H++A−Ka=1.00×10-4据题意,得如下3个关系式:[HA]+[A−]=3.05×10-3mol·L-1①[H+][A−]/[HA]=1.00×10-4②[H+]=[A−][H+]=5.05×10-4mol·L-1③三式联立,解得:[A−]=[H+]=5.05×10-4mol·L-1,[HA]=2.55×10-3mol·L-1,[OH-]=1.98×10-11mol·L-1,pH=−log[H+]=3.297=3.30计算过程合理得1.5分;每个物种的浓度0.5分;pH0.5分。6-2(4分)HA的二聚反应为:2HA=(HA)2平衡常数Kdim=[(HA)2]/[HA]2苯相中,HA的分析浓度为2[(HA)2]+[HA]B=3.96×10-3mol·L-1根据苯-水分配常数KD=[HA]B/[HA]W=1.00得[HA]B=[HA]W=2.55×10-3mol·L-1[(HA)2]=7.05×10-4mol·L-1Kdim=[(HA)2]/[HA]2=7.05×10-4/(2.55×10-3)2=1.08×102计算过程合理得2分;单体及二聚体浓度正确各得0.5分;平衡常数正确得1分(31\n带不带单位不影响得分)。6-3(2分)HA的摩尔质量为(1.00×6.02×1023)/(3.85×1021)=156(g/mol),根据所给信息,推断HA是氯代苯甲酸。156-77(C6H5)-45(羧基)=34,苯环上可能有氯,于是有156-76(C6H4)-45(羧基)=35,因此HA是氯代苯甲酸。推算合理和结论各1分。6-4(2分)在苯中,氯代苯甲酸相互作用形成分子间氢键;二聚体结构如下:原因与结构各1分。第7题(8分)7-1(6分)A第一次放热:4KClO3(s)=3KClO4(s)+KCl(s)ΔHθ=-144kJ/mol第二次放热:KClO4(s)=KCl(s)+2O2(g)ΔHθ=-4kJ/mol每个方程式1分。方程式写错,不得分;未标或标错物态,扣0.5分;未给出ΔHθ或算错,扣0.5分。第一次放热过程,在上述要求的方程式外,还写出2KClO3(s)=2KCl(s)+3O2(g),不扣分。B第一次放热、第二次放热反应的热化学方程式均与A相同。(给出此说明,得分同A)若写方程式,评分标准同A。C2KClO3(s)=2KCl(s)+3O2(g)ΔHθ=-78kJ/mol方程式2分。方程式写错,不得分;未标或标错物态,扣0.5分;未给出ΔHθ或算错,扣0.5分。7-2(2分)具有轻微刺激性气味的气体可能是Cl2。(1分)实验方案:(1)将气体通入HNO3酸化的AgNO3溶液,有白色沉淀生成;(0.5分)(2)使气体接触湿润的KI-淀粉试纸,试纸变蓝色。(0.5分)若答气体为O3和/或ClO2,得1分;给出合理的确认方案,得1分。第8题(4分)8-1(3分)操作步骤:第一步:将反应混合物倾入(冰)水中,搅拌均匀,分离水相和有机相;(0.5分)第二步:水相用乙酸乙酯等极性有机溶剂萃取2-3次后,取水相;(0.5分)第三步:浓缩水相,得到C的粗产品。(1分)理论依据:C是季铵盐离子性化合物,易溶于水,而A和B都是脂溶性化合物,不溶于水。(1分)未答出水相用有机溶剂萃取,不得第二步分;未答浓缩水相步骤,不得第三步分;未答出C是季铵盐离子性化合物或未答出A和B都是脂溶性化合物,扣0.5分。8-2(1分)A含叔胺官能团,B为仲卤代烷,生成C的反应是胺对卤代烷的亲核取代反应。(1分)只要答出取代反应即可得1分。第9题(10分)9-1(5分)AKMnO4或K2Cr2O7或其他合理的氧化剂;MnO2、PCC、PDC、Jones试剂等不行。A、B、C、D、和G每式1分。31\n化合物B只能是酸酐,画成其他结构均不得分;化合物C画成也得1分化合物D只能是二醇,画成其他结构均不得分;化合物G画成或只得0.5分9-2(2分)由E生成F的反应属于加成反应;由F生成G的反应属于缩合反应。(各1分)由E生成F的反应答为其他反应的不得分;由F生成G的反应答为“分子间消除反应”也得满分,答其他反应的不得分。9-3(3分)G的所有光活异构体(3分)应有三个结构式,其中前两个为内消旋体,结构相同,应写等号或只写一式;三个结构式每式1分;如果将结构写成4个,而没有在内消旋体之间写等号的,或认为此内消旋体是二个化合物的扣0.5分;如果用如下结构式画G的异构体,4个全对,得满分。每错1个扣1分,最多共扣3分。第10题(12分)10-1(2分)画成其他结构均不得分。10-2(5分)31\n画成其他结构均不得分。B(2分)化合物B与水反应的化学方程式:或C3N3O3Cl3+3H2O=C3N3O3H3+3HClO(3分)方程式未配平得1.5分;产物错不得分。10-3(2分)(2分,每个结构式1分)10-4(3分)或3CO(NH2)2=C3N3O3H3+3NH3方程式未配平只得1.5分;产物错不得分。第11题(9分)11-1(3分)A的结构式:(1分)A的结构,必须画出四元环并九元环的并环结构形式;未画出并环结构不得分;甲基位置错误不得分。C的结构式:(1分)C的结构,必须画出四元环并九元环的结构形式;未画出并环结构不得分;环内双键的构型画成顺式不得分,取代基位置错误不得分。C的异构体的结构式:(1分)C异构体的结构,必须画出四元环并九元环的结构形式;未画出并环结构不得分;环内双键的构型画成反式不得分;取代基位置错误不得分。11-2(4分)石竹烯的结构式:(2分)31\n石竹烯的结构式,必须画出四元环并九元环的结构形式;未画出并环结构不得分;结构中有二个双键,一个在环内,一个在环外;九元环内的双键的构型必须是反式的;双键位置正确得满分;双键位置错误不得分;甲基位置错误不得分。异石竹烯的结构式:(2分)异石竹烯的结构式,必须画出四元环并九元环的结构形式;未画出并环结构不得分;结构中有二个双键,一个在环内,一个在环外;九元环内的双键的构型必须是顺式的;双键位置正确得满分;双键位置错误不得分;甲基位置错误不得分。11-3(2分)环内双键构型不同,石竹烯九元环中的双键构型为反式的,异石竹烯九元环中的双键构型为顺式的。石竹烯和异石竹烯的结构差别:必须指出石竹烯九元环中的双键构型为反式的,异石竹烯九元环中的双键构型为顺式的;主要差别在于环内双键构型的顺反异构;只要指出双键构型的顺反异构就得满分,否则不得分。2008年全国高中学生化学竞赛(省级赛区)试题标准答案及评分细则2008年9月18日题号1234567891011总分满分14541051114971110100评分通则:1.凡要求计算的,没有计算过程,即使结果正确也不得分。2有效数字错误,扣0.5分,但每大题只扣1次。3单位不写或表达错误,扣0.5分,但每大题只扣1次。4只要求1个答案、而给出多个答案,其中有错误的,不得分。5方程式不配平不得分。6不包括在此标准答案的0.5分的题,可由评分组讨论决定是否给分。第1题(14分)1-1EDTA是乙二胺四乙酸的英文名称的缩写,市售试剂是其二水合二钠盐。(1)画出EDTA二钠盐水溶液中浓度最高的阴离子的结构简式。(2分)答或得2分,质子必须在氮原子上。(2)Ca(EDTA)2-溶液可用于静脉点滴以排除体内的铅。写出这个排铅反应的化学方程式(用Pb2+表示铅)。31\nPb2++Ca(EDTA)2-=Ca2++Pb(EDTA)2-(1分)(3)能否用EDTA二钠盐溶液代替Ca(EDTA)2-溶液排铅?为什么?不能。若直接用EDTA二钠盐溶液,EDTA阴离子不仅和Pb2+反应,也和体内的Ca2+结合造成钙的流失。(答案和原因各0.5分,共1分)1-1氨和三氧化硫反应得到一种晶体,熔点205oC,不含结晶水。晶体中的分子有一个三重旋转轴,有极性。画出这种分子的结构式,标出正负极。(2分)硫氧键画成双键或画成S→O,氮硫键画成N→S,均不影响得分。结构式1分,正负号1分。答H3NSO3、H3N-SO3等不得分。正确标出了正负号,如+H3NSO3-、+H3N-SO3-得1分。其他符合题设条件(有三重轴,有极性)的结构,未正确标出正负极,得1分,正确标出正负极,得2分。1-3Na2[Fe(CN)5(NO)]的磁矩为零,给出铁原子的氧化态。Na2[Fe(CN)5(NO)]是鉴定S2-的试剂,二者反应得到紫色溶液,写出鉴定反应的离子方程式。Fe(II)答II或+2也可(2分)[Fe(CN)5(NO)]2-+S2-=[Fe(CN)5(NOS)]4-配合物电荷错误不得分(1分)1-4CaSO4•2H2O微溶于水,但在HNO3(1molL-1)、HClO4(1molL-1)中可溶。写出能够解释CaSO4在酸中溶解的反应方程式。CaSO4+H+=Ca2++HSO4-(1分)写成2CaSO4+2HNO3=Ca(NO3)2+Ca(HSO4)2也得分。高氯酸同。答案若生成H2SO4不得分。1-5取质量相等的2份PbSO4(难溶物)粉末,分别加入HNO3(3molL-1)和HClO4(3molL-1),充分混合,PbSO4在HNO3能全溶,而在HClO4中不能全溶。简要解释PbSO4在HNO3中溶解的原因。Pb2+与NO3-形成络离子(配离子或配合物)。(1分)写方程式也可,如PbSO4+H++NO3-=HSO4-+Pb(NO3)+。若将络离子(配离子或配合物)写成Pb(NO3)2或Pb(NO3)3-也得分,但方程式须配平。1-6X和Y在周期表中相邻。CaCO3与X的单质高温反应,生成化合物B和一种气态氧化物;B与Y的单质反应生成化合物C和X的单质;B水解生成D;C水解生成E,E水解生成尿素。确定B、C、D、E、X和Y。B:CaC2C:CaCN2D:C2H2或Ca(OH)2E:NH2CN[C(NH)2也可]X:CY:N(各0.5分,共3分)第2题(5分)化合物X是产量大、应用广的二元化合物,大量用作漂白剂、饮水处理剂、消毒剂等。年产量达300万吨的氯酸钠是生产X的原料,92%用于生产X—在酸性水溶液中用盐酸、二氧化硫或草酸还原。此外,将亚氯酸钠固体装柱,通入用空气稀释的氯气氧化,也可生产X。X有极性和顺磁性,不形成二聚体,在碱性溶液里可发生歧化反应。2-1写出X的分子式和共轭π键()。ClO2(各1分,共2分)2-2分别写出上述用草酸还原和用氯气氧化生产X的反应方程式。2ClO3-+H2C2O4+2H+=2ClO2+2CO2+2H2O(1分)31\n或2NaClO3+H2C2O4+H2SO4=2ClO2+2CO2+Na2SO4+2H2O2NaClO2+Cl2=2ClO2+2NaCl(1分)NaClO2是固体,写成ClO2-,不得分。2-3写出上述X歧化反应的化学方程式。2ClO2+2NaOH=NaClO2+NaClO3+H2O(1分)或2ClO2+2OH-=ClO2-+ClO3-+H2O第3题(4分)甲醛是一种重要的化工产品,可利用甲醇脱氢制备,反应式如下:催化剂,700oCCH3OH(g)CH2O(g)+H2(g)=84.2kJmol-1(1)向体系中通入空气,通过以下反应提供反应(1)所需热量:H2(g)+½O2(g)H2O(g)=–241.8kJmol-1(2)要使反应温度维持在700˚C,计算进料中甲醇与空气的摩尔数之比。已知空气中氧气的体积分数为0.20。要使反应维持在一定温度持续进行,应保证反应(2)放出的热量恰好被反应(1)全部利用,则:甲醇与氧气的摩尔比为:n(CH3OH):n(O2)=(2´241.8)/84.2=5.74(2分)甲醇与空气的摩尔比为:n(CH3OH):n(空气)=5.74/5=1.1(2分)答成1.15或1.148得1.5分。答(写)成1:0.87也得2分。考虑到实际情况,将上式的等号写成小于或小于等于,得2分。算式合理,结果错误,只得1分。只有结果没有计算过程不得分。第4题(10分)(CN)2被称为拟卤素,它的阴离子CN-作为配体形成的配合物有重要用途。4-1HgCl2和Hg(CN)2反应可制得(CN)2,写出反应方程式。HgCl2+Hg(CN)2=Hg2Cl2+(CN)2(1分)4-2画出CN-、(CN)2的路易斯结构式。(各1分,共2分)短线画成电子对同样得分;不画孤对电子不得分。4-3写出(CN)2(g)在O2(g)中燃烧的反应方程式。(CN)2(g)+2O2(g)=2CO2(g)+N2(g)(1分)不标物态也可。4-4298K下,(CN)2(g)的标准摩尔燃烧热为-1095kJmol-1,C2H2(g)的标准摩尔燃烧热为-1300kJmol-1,C2H2(g)的标准摩尔生成焓为227kJmol-1,H2O(l)的标准摩尔生成焓为-286kJmol-1,计算(CN)2(g)的标准摩尔生成焓。(CN)2(g)+2O2(g)=2CO2(g)+N2(g)2ΔfHmy(CO2)-ΔfHmy[(CN)2]=-1095kJmol-12ΔfHmy(CO2)=-1095kJmol-1+ΔfHmy[(CN)2]C2H2(g)+2.5O2(g)=2CO2(g)+H2O(l)2ΔfHmy(CO2)+ΔfHmy(H2O)-ΔfHmy(C2H2)=-1300kJmol-12ΔfHmy(CO2)=-1300kJmol-1+286kJmol-1+227kJmol-1ΔfHmy[(CN)2]=1095kJmol-1-1300kJmol-1+286kJmol-1+227kJmol-1=308kJmol-1(2分)计算过程正确计算结果错误只得1分。没有计算过程不得分。31\nΔfHmy[(CN)2]=1095-1300+286+227=308(kJmol-1)也可以。但不加括号只得1.5分。4-5(CN)2在300~500oC形成具有一维双链结构的聚合物,画出该聚合物的结构。或(2分)画成也得2分。但画成只得1分。4-6电镀厂向含氰化物的电镀废液中加入漂白粉以消除有毒的CN-,写出化学方程式(漂白粉用ClO-表示)。2CN-+5ClO-+H2O=2HCO3-+N2+5Cl- (2分)产物中写成CO32-,只要配平,也得2分。第5题(5分)1963年在格陵兰Ika峡湾发现一种水合碳酸钙矿物ikaite。它形成于冷的海水中,温度达到8oC即分解为方解石和水。1994年的文献指出:该矿物晶体中的Ca2+离子被氧原子包围,其中2个氧原子来自同一个碳酸根离子,其余6个氧原子来自6个水分子。它的单斜晶胞的参数为:a=887pm,b=823pm,c=1102pm,β=110.2°,密度d=1.83gcm-3,Z=4。5-1通过计算得出这种晶体的化学式。ikaite晶胞体积:V=abcsinβ=(8.87´8.23´11.02´10-24cm3)´sin110.2°=7.55´10-22cm3(0.5分)设晶胞中含有n个水分子,晶胞的质量:m=4´(100+18n)/NA(g)(0.5分)晶体密度:d=m/V=4´(100+18n)/(6.02´1023´7.55´10-22)(gcm-3)=1.83gcm-3100+18n=208n=6(0.5分)该晶体的化学式为CaCO3×6H2O(0.5分)算出6个水分子,未写化学式,得1.5分。5-2研究了这种晶体在加压下受热膨胀体积增大的情形,并与冰及钙离子配位数也是8的二水合石膏晶体(gypsum)作了对比,结果如下图所示(纵坐标为相对体积):ikaiteicegypsum为什么选取冰和二水合石膏作对比?实验结果说明什么?Ikaite在冷水中形成,而且含有大量结晶水,分解温度又接近冰的熔点,可能与冰的结构有相似性,故选取冰作参比物;(0.5分)石膏是带结晶水的钙的含氧酸盐,而且钙的配位数也是8,可能与ikaite结构相似,故选取石膏作参比物。(0.5分)31\n实验结果说明ikaite的结构跟冰相似。(1分)实验结果,说明含水的摩尔分数越大膨胀越大,可以得0.5分。5-3这种晶体属于哪种类型的晶体?简述理由。分子晶体。(0.5分)答混合型晶体不得分。晶体分解温度接近冰的熔点,体积随温度的变化趋势也接近冰,可认为晶体中的化学微粒是CaCO3×6H2O,它们以分子间作用力(氢键和范德华力)构成晶体。(0.5分)第6题(11分)在900oC的空气中合成出一种含镧、钙和锰(摩尔比2:2:1)的复合氧化物,其中锰可能以+2、+3、+4或者混合价态存在。为确定该复合氧化物的化学式,进行如下分析:6-1准确移取25.00mL0.05301molL-1的草酸钠水溶液,放入锥形瓶中,加入25mL蒸馏水和5mL6molL-1的HNO3溶液,微热至60~70oC,用KMnO4溶液滴定,消耗27.75mL。写出滴定过程发生的反应的方程式;计算KMnO4溶液的浓度。2MnO4-+5C2O42-+16H+=2Mn2++10CO2+8H2O(1分)KMnO4溶液浓度:(2/5)´0.05301´25.00/27.75=0.01910(molL-1)(1分)反应方程式反应物C2O42-写H2C2O4,只要配平,也得1分。下同。6-2准确称取0.4460g复合氧化物样品,放入锥形瓶中,加25.00mL上述草酸钠溶液和30mL6molL-1的HNO3溶液,在60~70oC下充分摇动,约半小时后得到无色透明溶液。用上述KMnO4溶液滴定,消耗10.02mL。根据实验结果推算复合氧化物中锰的价态,给出该复合氧化物的化学式,写出样品溶解过程的反应方程式。已知La的原子量为138.9。根据:化合物中金属离子摩尔比为La:Ca:Mn=2:2:1,镧和钙的氧化态分别为+3和+2,锰的氧化态为+2~+4,初步判断复合氧化物的化学式为La2Ca2MnO6+x,其中x=0~1。(1分)滴定情况:加入C2O42-总量:25.00mL´0.05301molL-1=1.3253mmol(0.5分)样品溶解后,滴定消耗高锰酸钾:10.02mL´0.01910molL-1=0.1914mmol(0.5分)样品溶解后剩余C2O42-量:0.1914mmol´5/2=0.4785mmol(0.5分)样品溶解过程所消耗的C2O42-量:1.3253mmol-0.4785mmol=0.8468mmol(0.5分)若将以上过程合并,推论合理,结果正确,也得2分。在溶样过程中,C2O42-变为CO2给出电子:2´0.8468mmol=1.694mmol(0.5分)有两种求解x的方法:(1)方程法:复合氧化物(La2Ca2MnO6+x)样品的物质的量为:0.4460g/[(508.9+16.0x)gmol-1](0.5分)La2Ca2MnO6+x中,锰的价态为:[2´(6+x)-2´3-2´2]=(2+2x)(1分)溶样过程中锰的价态变化为:(2+2x-2)=2x(0.5分)锰得电子数与C2O42-给电子数相等:2x´0.4460g/[(508.9+16.0x)gmol-1]=2´0.8468´10-3mol(1分)x=1.012»1(0.5分)如果将以上步骤合并,推导合理,结果正确,也得3.5分;如果将以上步骤合并,推导合理但结果错误,得2分;推导错误,即便结果吻合,也不得分。(2)尝试法因为溶样过程消耗了相当量的C2O42-,可见锰的价态肯定不会是+2价。若设锰的价态为+3价,相应氧化物的化学式为La2Ca2MnO6.5,此化学式式量为516.9gmol-1,称取样品的物质的量为:31\n0.4460g/(516.9gmol-1)=8.628´10-4mol(0.5分)在溶样过程中锰的价态变化为1.689´10-3mol/(8.628´10-4mol)=1.96(0.5分)锰在复合氧化物中的价态为:2+1.96=3.96(0.5分)3.96与3差别很大,+3价假设不成立;(0.5分)而结果提示Mn更接近于+4价。(0.5分)若设Mn为+4价,相应氧化物的化学式为La2Ca2MnO7,此化学式式量为524.9gmol-1。锰在复合氧化物中的价态为:2+2´0.8468´10-3/(0.4460/524.9)=3.99»4(0.5分)假设与结果吻合,可见在复合氧化物中,Mn为+4价。(0.5分)如果将以上步骤合并,推导合理,结果正确,也得3.5分;如果将以上步骤合并,推导合理但结果错误,得2分;推导错误,即便结果吻合,也不得分。该复合氧化物的化学式为La2Ca2MnO7(1分)溶样过程的反应方程式为:La2Ca2MnO7+C2O42-+14H+=2La3++2Ca2++Mn2++2CO2+7H2O(1分)未经计算得出La2Ca2MnO7,方程式正确,只得方程式的1分。第7题(14分)AX4四面体(A为中心原子,如硅、锗;X为配位原子,如氧、硫)在无机化合物中很常见。四面体T1按下图所示方式相连可形成一系列“超四面体”(T2、T3···):T1T3T27-1上图中T1、T2和T3的化学式分别为AX4、A4X10和A10X20,推出超四面体T4的化学式。T4超四面体的化学式为A20X35(1分)7-2分别指出超四面体T3、T4中各有几种环境不同的X原子,每种X原子各连接几个A原子?在上述两种超四面体中每种X原子的数目各是多少?T3超四面体中,有3种不同环境的X原子。(1分)其中4个X原子在顶点上,所连接A原子数为1;(0.5分)12个X原子在超四面体的边上,所连接A原子数为2;(0.5分)4个原子在超四面体的面上,所连接A原子数为3。(1分)(共3分)T4超四面体中有5种不同环境的X原子。(2分)其中4个X原子在顶点上,所连接A原子数为1;(0.5分)12个X原子在超四面体的边上但不在边的中心,所连接A原子数为2;(0.5分)31\n6个X原子在超四面体的边的中心,所连接A原子数为2;(0.5分)12个原子在超四面体的面上,所连接A原子数为3;(0.5分)1个在超四面体的中心,所连接A原子数为4。(1分)(共5分)7-3若分别以T1、T2、T3、T4为结构单元共顶点相连(顶点X原子只连接两个A原子),形成无限三维结构,分别写出所得三维骨架的化学式。化学式分别为AX2,A4X8,A10X18,A20X33。(每式0.5分,共2分)答分别为AX2,AX2,A5X9,A20X33也可。7-4欲使上述T3超四面体连接所得三维骨架的化学式所带电荷分别为+4、0和-4,A选Zn2+、In3+或Ge4+,X取S2-,给出带三种不同电荷的骨架的化学式(各给出一种,结构单元中的离子数成简单整数比)。A10X184+只能是Ge10S184+;(1分)A10X18可以是Zn2Ge8S18,In2ZnGe7S18,In4Ge6S18;(1分)只要答出其中一种,得1分;A10X184-可以是Zn4Ge6S184-,In8Ge2S184-,In6ZnGe3S184-,In4Zn2Ge4S184-,In2Zn3Ge5S184-;(1分)只要答出其中一种,得1分。第8题(9分)由烷基镁热分解制得镁的氢化物。实验测定,该氢化物中氢的质量分数为7.6%,氢的密度为0.101gcm-3,镁和氢的核间距为194.8pm。已知氢原子的共价半径为37pm,Mg2+的离子半径为72pm。8-1写出该氢化物中氢的存在形式,并简述理由。H-(1分)镁-氢间距离为194.8pm,Mg2+离子半径为72pm,则氢的半径为194.8pm-72pm=123pm。此值远大于氢原子的共价半径,这说明H原子以H-离子的形式存在。(1分)8-2将上述氢化物与金属镍在一定条件下用球磨机研磨,可制得化学式为Mg2NiH4的化合物。X-射线衍射分析表明,该化合物的立方晶胞的面心和顶点均被镍原子占据,所有镁原子的配位数都相等。推断镁原子在Mg2NiH4晶胞中的位置(写出推理过程)。Mg原子与Ni原子数之比为2:1,故每个晶胞中含8个镁原子。所有镁原子的配位数相等,它们只能填入由镍原子形成的四面体空隙。(3分)镁原子的位置用下列坐标参数表示也得3分:1/4,1/4,1/4;1/4,1/4,3/4;3/4,3/4,1/4;3/4,3/4,3/4;1/4,3/4,1/4;1/4,3/4,3/4;3/4,1/4,1/4;3/4,1/4,3/4。坐标错一组,扣0.5分,不得负分。其他答案不得分。8-3实验测定,上述Mg2NiH4晶体的晶胞参数为646.5pm,计算该晶体中镁和镍的核间距。已知镁和镍的原子半径分别为159.9pm和124.6pm。镁镍间的距离为(2分)算式及答案皆正确(包括单位)得2分;算式对但结果错;只得1分;结果中数对但单位错,得1.5分。用原子半径相加计算镁-镍间的距离,不得分。8-4若以材料中氢的密度与液态氢密度之比定义储氢材料的储氢能力,计算Mg2NiH4的储氢能力(31\n假定氢可全部放出;液氢的密度为0.0708gcm-3)。储氢能力=晶体的密度×氢的质量分数÷液氢密度(2分)=1.40=1.4算法及结果皆正确得2分;算法(式)正确但结果错得1分;无过程不得分。只有结果但无算式,不得分。氢的原子量取1不取1.008,算出结果1.39,只得1.5分。第9题(7分)化合物A、B和C互为同分异构体。它们的元素分析数据为:碳92.3%,氢7.7%。1molA在氧气中充分燃烧产生179.2L二氧化碳(标准状况)。A是芳香化合物,分子中所有的原子共平面;B是具有两个支链的链状化合物,分子中只有两种不同化学环境的氢原子,偶极矩等于零;C是烷烃,分子中碳原子的化学环境完全相同。9-1写出A、B和C的分子式。C8H8(1分)其他答案不得分。9-2画出A、B和C的结构简式。A的结构简式:或(2分)写成或键线式也得分;苯环画成也可,其他答案不得分。B的结构简式:(2分)写成键线式也得分;其他答案不得分。C的结构简式:(2分)31\n写成,或写成键线式,其他答案不得分。第10题(11分)化合物A、B、C和D互为同分异构体,分子量为136,分子中只含碳、氢、氧,其中氧的含量为23.5%。实验表明:化合物A、B、C和D均是一取代芳香化合物,其中A、C和D的芳环侧链上只含一个官能团。4个化合物在碱性条件下可以进行如下反应:10-1写出A、B、C和D的分子式。C8H8O2(1分)10-2画出A、B、C和D的结构简式。A的结构简式:或(1分)若写成C6H5COOCH3也得分。B的结构简式:或(1分)若写成C6H5CH2OCHO也得分。C的结构简式:或(1分)若写成C6H5OCOCH3也得分。D的结构简式:或(1分)若写成C6H5CH2COOH也得分。10-3A和D分别与NaOH溶液发生了哪类反应?A与NaOH溶液发生了酯的碱性水解反应。(0.5分)答碱性水解反应、酯的水解反应或水解反应、皂化、取代反应也得0.5分。D与NaOH溶液发生了酸碱中和反应。(0.5分)答酸碱反应或中和反应也得0.5分;其他答案不得分。10-4写出H分子中官能团的名称。31\n醛基和羧基。各0.5分(共1分)10-5现有如下溶液:HCl、HNO3、NH3•H2O、NaOH、NaHCO3、饱和Br2水、FeCl3和NH4Cl。从中选择合适试剂,设计一种实验方案,鉴别E、G和I。由题目给出的信息可推出:E是苯甲酸,G是苯甲醇,I是苯酚。根据所给试剂,可采用如下方案鉴定。方案1:取3个试管,各加2mL水,分别将少许E、G、I加入试管中,再各加1-2滴FeCl3溶液,呈现蓝紫色的试管中的化合物为苯酚I。(2分)另取2个试管,各加适量NaOH溶液,分别将E和G加入试管中,充分振荡后,不溶于NaOH溶液的化合物为苯甲醇G,溶于NaOH溶液的化合物为苯甲酸E。(2分)方案2:取3个试管,各加2mL水,分别将少许E、G、I加入试管中,再各加几滴溴水,产生白色沉淀的试管中的化合物为苯酚I;(2分)另取2个试管,各加适量NaOH溶液,分别将E和G加入试管中,充分振荡后,不溶于NaOH溶液的为苯甲醇G。溶于NaOH溶液的为苯甲酸E。(2分)方案3:取3个试管,各加2mL水,分别将少许E、G、I加入试管中,再各加1-2滴FeCl3溶液,呈现蓝紫色的试管中的化合物为苯酚I。(2分)另取2个试管,各加适量NaHCO3溶液,分别将E和G加到试管中。加热,放出气体的试管中的化合物为苯甲酸E。(2分)方案4;取3个试管,各加2mL水,分别将少许E、G、I加入试管中,再各加几滴溴水,产生白色沉淀的试管中的化合物为苯酚I;(2分)另取2个试管,各加适量NaHCO3溶液,分别将E和G加入试管中。加热,放出气体的试管中的化合物为苯甲酸E。(2分)方案5:取3个试管,各加适量NaOH溶液,分别将E、G和I加到试管中,充分振荡后,不溶于NaOH溶液的化合物为苯甲醇G,溶于NaOH溶液的化合物为苯甲酸E或苯酚I。(2分)另取2个试管,各加适量NaHCO3溶液,分别将E、I加入试管中。加热,放出气体的试管中的化合物为苯甲酸E。(2分)答出以上5种方案中的任何一种均给分。其他合理方法也得分,但必须使用上列试剂。第11题(10分)1941年从猫薄荷植物中分离出来的荆芥内酯可用作安眠药、抗痉挛药、退热药等。通过荆芥内酯的氢化反应可以得到二氢荆芥内酯,后者是有效的驱虫剂。为研究二氢荆芥内酯的合成和性质,进行如下反应:31\n写出A、B、C、D和E的结构简式(不考虑立体异构体)。ABCDE每个结构简式2分(共10分)D画成下面的结构简式得1分。E答如下结构也可:31