- 119.50 KB
- 2022-07-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
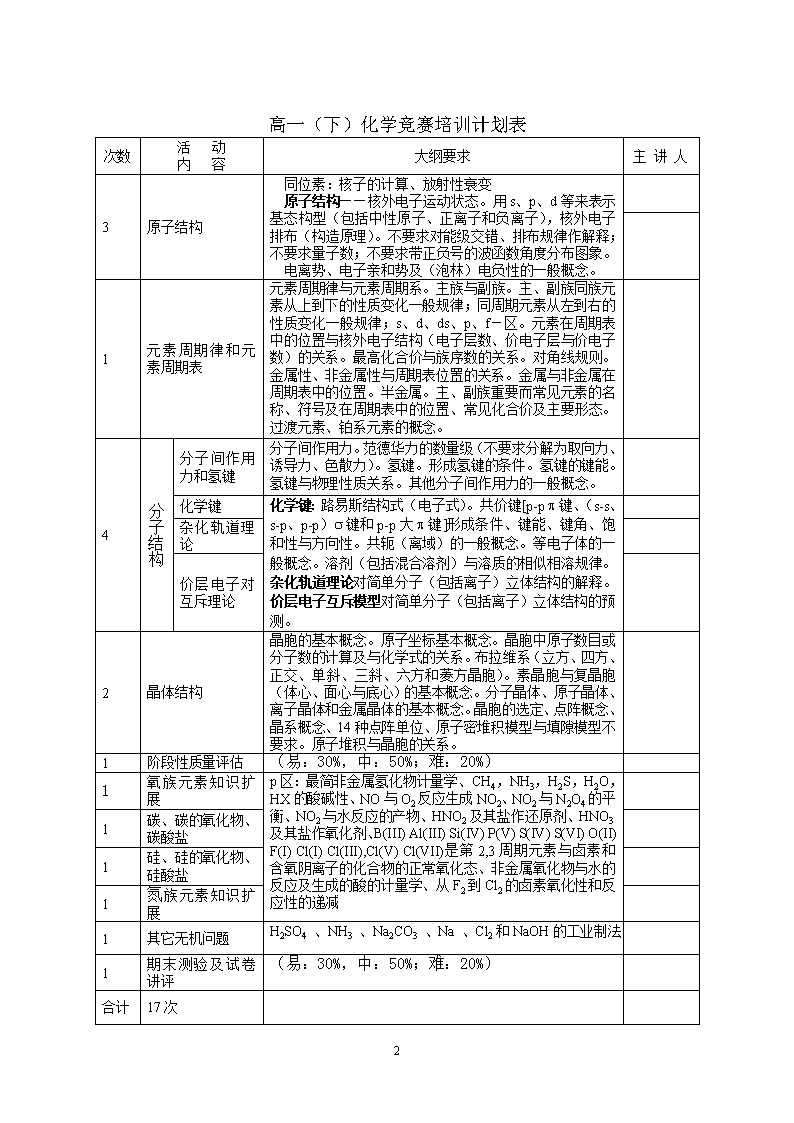
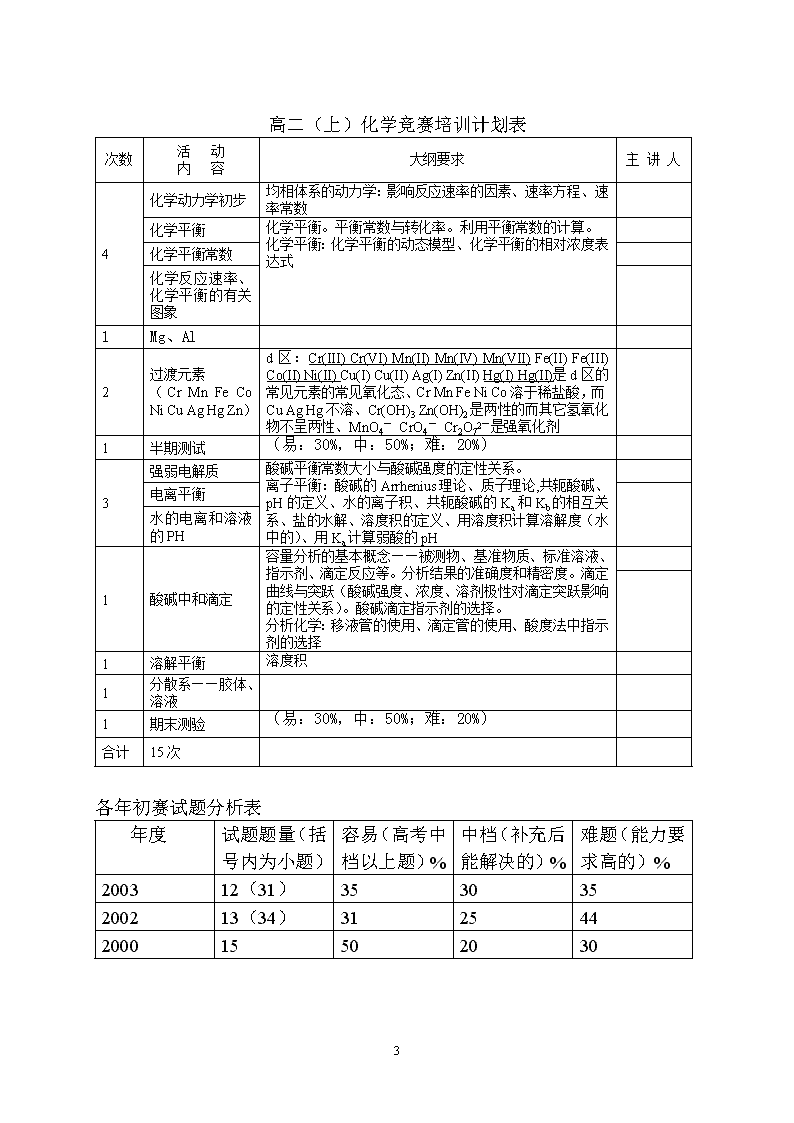
关于高中化学竞赛(初赛)辅导的建议邛崃一中董伟教学建议:先易后难、先慢后快、灵活安排,严格按大纲要求控制深度和广度,注意猜谜题的训练高一(上)化学竞赛培训计划表次数活动内容大纲要求主讲人1选拔考试以初中知识命题(易:30%,中:50%;难:20%)3氧化还原反应的有关规律氧化还原的基本概念和反应的书写和配平。氧化还原反应过程中的有关计算氧化还原反应方程式的的配平2书写离子方程式应注意的问题离子方程式的正确书写和配平。Ag+,Ba2+,Cl-,SO42-的鉴定、Al3+,NO2-,NO3-,Bi3+的鉴定、K,Ca,Sr的焰色法离子反应知识扩展1化学反应中的能量变化了解化学反应与能量之间的关系,掌握反应热、中和热等。1碱金属元素知识拓展s区:Ⅰ,Ⅱ族金属与水反应的产物及产物的碱度、金属与卤素反应的产物、重元素的反应性更强3气体(理想气体、H2、稀有气体)理想气体标准状态。理想气体状态方程。气体密度。气体相对分子质量测定。气体溶解度。相的体系:理想气体方程、分压的定义溶液配制和计算(物质的量浓度和质量分数的有关计算)溶液配制(浓度的不同精确度要求对仪器的选择)。定量仪器(天平、量筒、移液管、滴定管、容量瓶等)的精度与测量数据有效数字。运算结果的有效数字。化学中的的计量(原子量、分子量、物质的量、有效数字)有效数字的概念。在化学计算和化学实验中正确使用有效数字。定量仪器(天平、量筒、移液管、滴定管、容量瓶等)的精度与测量数据有效数字。运算结果的有效数字。1卤素知识拓展HX的酸碱性F(-I)Cl(-I)Cl(III),Cl(V)Cl(VII)是卤素和含氧阴离子的化合物的正常氧化态、与水的反应及生成的酸的计量学、从F2到Cl2的卤素氧化性和反应性的递减2解题方法:化学计算的基本技巧——差量法、关系式法、守恒法、十字交叉法1期末测验(易:30%,中:50%;难:20%)合计15次5\n高一(下)化学竞赛培训计划表次数活动内容大纲要求主讲人3原子结构同位素:核子的计算、放射性衰变原子结构——核外电子运动状态。用s、p、d等来表示基态构型(包括中性原子、正离子和负离子),核外电子排布(构造原理)。不要求对能级交错、排布规律作解释;不要求量子数;不要求带正负号的波函数角度分布图象。电离势、电子亲和势及(泡林)电负性的一般概念。1元素周期律和元素周期表元素周期律与元素周期系。主族与副族。主、副族同族元素从上到下的性质变化一般规律;同周期元素从左到右的性质变化一般规律;s、d、ds、p、f-区。元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的关系。最高化合价与族序数的关系。对角线规则。金属性、非金属性与周期表位置的关系。金属与非金属在周期表中的位置。半金属。主、副族重要而常见元素的名称、符号及在周期表中的位置、常见化合价及主要形态。过渡元素、铂系元素的概念。4分子结构分子间作用力和氢键分子间作用力。范德华力的数量级(不要求分解为取向力、诱导力、色散力)。氢键。形成氢键的条件。氢键的键能。氢键与物理性质关系。其他分子间作用力的一般概念。化学键化学键:路易斯结构式(电子式)。共价键[p-pp键、(s-s、s-p、p-p)s键和p-p大p键]形成条件、键能、键角、饱和性与方向性。共轭(离域)的一般概念。等电子体的一般概念。溶剂(包括混合溶剂)与溶质的相似相溶规律。杂化轨道理论对简单分子(包括离子)立体结构的解释。价层电子互斥模型对简单分子(包括离子)立体结构的预测。杂化轨道理论价层电子对互斥理论2晶体结构晶胞的基本概念。原子坐标基本概念。晶胞中原子数目或分子数的计算及与化学式的关系。布拉维系(立方、四方、正交、单斜、三斜、六方和菱方晶胞)。素晶胞与复晶胞(体心、面心与底心)的基本概念。分子晶体、原子晶体、离子晶体和金属晶体的基本概念。晶胞的选定、点阵概念、晶系概念、14种点阵单位、原子密堆积模型与填隙模型不要求。原子堆积与晶胞的关系。1阶段性质量评估(易:30%,中:50%;难:20%)1氧族元素知识扩展p区:最简非金属氢化物计量学、CH4,NH3,H2S,H2O,HX的酸碱性、NO与O2反应生成NO2、NO2与N2O4的平衡、NO2与水反应的产物、HNO2及其盐作还原剂、HNO3及其盐作氧化剂、B(III)Al(III)Si(IV)P(V)S(IV)S(VI)O(II)F(I)Cl(I)Cl(III),Cl(V)Cl(VII)是第2,3周期元素与卤素和含氧阴离子的化合物的正常氧化态、非金属氧化物与水的反应及生成的酸的计量学、从F2到Cl2的卤素氧化性和反应性的递减1碳、碳的氧化物、碳酸盐1硅、硅的氧化物、硅酸盐1氮族元素知识扩展1其它无机问题H2SO4、NH3、Na2CO3、Na、Cl2和NaOH的工业制法1期末测验及试卷讲评(易:30%,中:50%;难:20%)合计17次5\n高二(上)化学竞赛培训计划表次数活动内容大纲要求主讲人4化学动力学初步均相体系的动力学:影响反应速率的因素、速率方程、速率常数化学平衡化学平衡。平衡常数与转化率。利用平衡常数的计算。化学平衡:化学平衡的动态模型、化学平衡的相对浓度表达式化学平衡常数化学反应速率、化学平衡的有关图象1Mg、Al2过渡元素(CrMnFeCoNiCuAgHgZn)d区:Cr(III)Cr(VI)Mn(II)Mn(IV)Mn(VII)Fe(II)Fe(III)Co(II)Ni(II)Cu(I)Cu(II)Ag(I)Zn(II)Hg(I)Hg(II)是d区的常见元素的常见氧化态、CrMnFeNiCo溶于稀盐酸,而CuAgHg不溶、Cr(OH)3Zn(OH)2是两性的而其它氢氧化物不呈两性、MnO4-CrO4-Cr2O72-是强氧化剂1半期测试(易:30%,中:50%;难:20%)3强弱电解质酸碱平衡常数大小与酸碱强度的定性关系。离子平衡:酸碱的Arrhenius理论、质子理论,共轭酸碱、pH的定义、水的离子积、共轭酸碱的Ka和Kb的相互关系、盐的水解、溶度积的定义、用溶度积计算溶解度(水中的)、用Ka计算弱酸的pH电离平衡水的电离和溶液的PH1酸碱中和滴定容量分析的基本概念——被测物、基准物质、标准溶液、指示剂、滴定反应等。分析结果的准确度和精密度。滴定曲线与突跃(酸碱强度、浓度、溶剂极性对滴定突跃影响的定性关系)。酸碱滴定指示剂的选择。分析化学:移液管的使用、滴定管的使用、酸度法中指示剂的选择1溶解平衡溶度积1分散系——胶体、溶液1期末测验(易:30%,中:50%;难:20%)合计15次各年初赛试题分析表年度试题题量(括号内为小题)容易(高考中档以上题)%中档(补充后能解决的)%难题(能力要求高的)%200312(31)353035200213(34)3125442000155020305\n高二(下)化学竞赛培训计划表次数活动内容大纲要求主讲人3电化学初步原电池:电极符号与电极反应、原电池符号、原电池反应。标准电极电势的基本概念及用来判断反应的方向以及氧化剂与还原剂的强弱。电解池的电极符号与电极反应。电解与电镀的基本概念。常见化学电源。pH、络合剂、沉淀剂的影响的定性说明(不要求Nernst方程、氧化还原平衡常数及有关计算)。氧化还原滴定:高锰酸钾、重铬酸钾、硫代硫酸钠为标准溶液的滴定基本反应与分析结果计算。9有机化学基础有机化合物的分类1、烷:丁烷的异构体、命名(IUPAC)、物理性质的趋势、取代(例如与Cl2)产物、环烷的命名2、烯:平面结构、E/Z(cis/trans)异构、与Br2,HBr的加成产物3、炔:线性结构4、芳香烃:苯的化学式、电子的离域、共振的稳定化作用5、醇与酚:氢键──醇与醚对比、烯烃的氢化、甘油的化学式6、羰基化合物:命名、制备(醇的氧化)、反应(醛的氧化)7、羧酸:与醇反应产物(酯)、草酸(名称与化学式)8、含氮化合物:胺类是碱9、大分子:肥皂的制造;聚合反应的产物(乙烯的)10、氨基酸与肽:氨基酸的离子性结构、肽的结合11、蛋白质:蛋白质的一级结构有机化合物的命名立体化学基础各类有机化合物的结构和性质1有机推导解法1阶段测验(易:30%,中:50%;难:20%) 2 配合物配合物与配离子的基本概念。重要而常见的配离子的中心离子(原子)和重要而常见的配位体(水、羟基、卤离子、拟卤离子、氨分子、酸根离子等)、螯合物。重要而常见的配合剂及其重要而常见的配合反应。配合反应与酸碱反应、沉淀反应、氧化还原反应的联系(定性说明)。配合物空间结构和异构现象基本概念。配合物的杂化轨道基本概念。EDTA为标准溶液的滴定基本反应与分析结果计算。4竞赛题模拟训练(易:30%,中:40%;难:30%)合计19次以下为初赛后实验辅导1化学实验基本操作1实验设计1大学实验培训——基本操作1大学实验培训——中和滴定1大学实验培训——氧化还原滴定5\n欢迎各位老师和同学提出宝贵意见。———2004-4-205