- 1.19 MB
- 2022-07-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
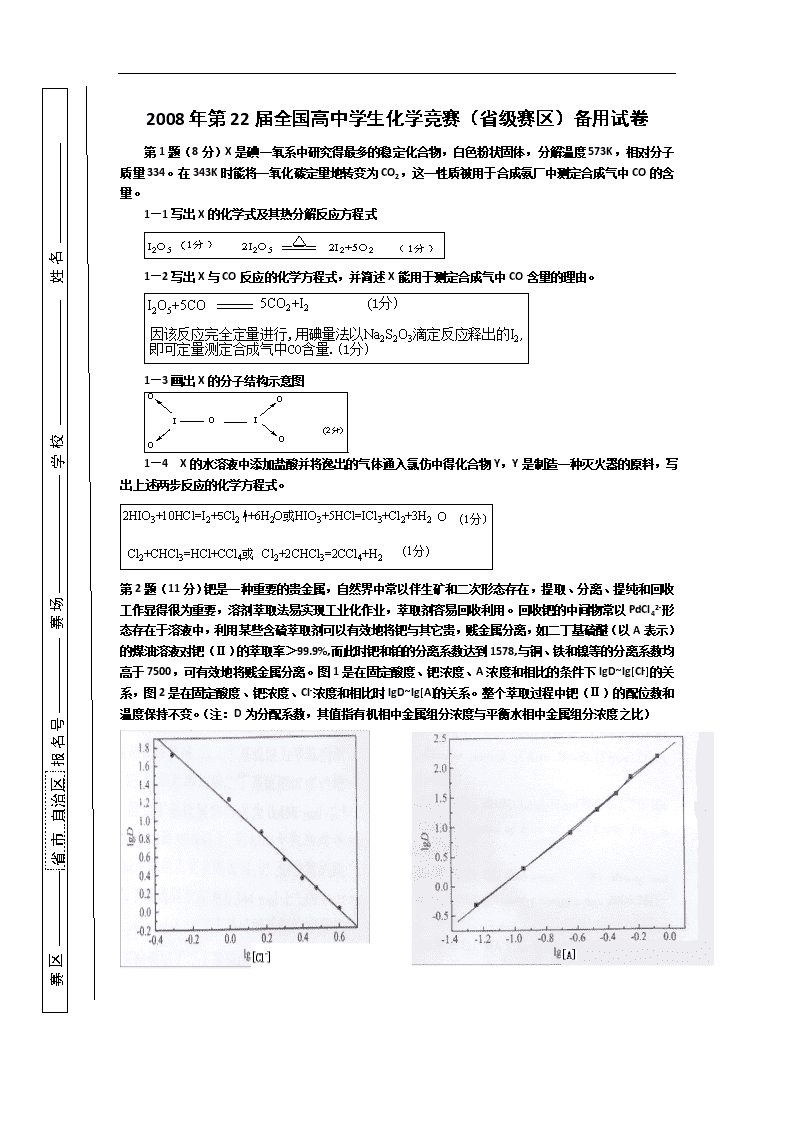
2008年第22届全国高中学生化学竞赛(省级赛区)备用试卷第1题(8分)X是碘一氧系中研究得最多的稳定化合物,白色粉状固体,分解温度573K,相对分子质量334。在343K时能将一氧化碳定量地转变为CO2,这一性质被用于合成氨厂中测定合成气中CO的含量。1—1写出X的化学式及其热分解反应方程式1—2写出X与CO反应的化学方程式,并简述X能用于测定合成气中CO含量的理由。1—3画出X的分子结构示意图1—4X的水溶液中添加盐酸并将逸出的气体通入氯仿中得化合物Y,Y是制造一种灭火器的原料,写出上述两步反应的化学方程式。第2题(11分)钯是一种重要的贵金属,自然界中常以伴生矿和二次形态存在,提取、分离、提纯和回收工作显得很为重要,溶剂萃取法易实现工业化作业,萃取剂容易回收利用。回收钯的中间物常以PdCl42-形态存在于溶液中,利用某些含硫萃取剂可以有效地将钯与其它贵,贱金属分离,如二丁基硫醚(以A表示)的煤油溶液对钯(Ⅱ)的萃取率>99.9%,而此时钯和铂的分离系数达到1578,与铜、铁和镍等的分离系数均高于7500,可有效地将贱金属分离。图1是在固定酸度、钯浓度、A浓度和相比的条件下lgD~lg[Cl-]的关系,图2是在固定酸度、钯浓度、Cl-浓度和相比时lgD~lg[A]的关系。整个萃取过程中钯(Ⅱ)的配位数和温度保持不变。(注:D为分配系数,其值指有机相中金属组分浓度与平衡水相中金属组分浓度之比)\n2—1推断萃取配合物的化学组成(列出推断过程)及写出萃取钯的化学反应方程式。设萃取剂A萃取钯(Ⅱ)的化学反应方程式为:(2分)按分配比定义,则整理后得(1分)在恒定温度下lgKex为常数。根据图1和图2可求出直线斜率分别为-1.9和2.1,取整数为-2和2,故x=2,n=2(2分)(1分)2—2写出萃取配合物的结构式及其异构体。每个结构式(1分)2—3简述A能高效萃取钯的原因。根据SHAB法则,Pd(Ⅱ)属软酸,S原子属软碱,匹配性好,形成的配合物很稳定。(1分)其次,萃合物为中性配合物,根据相似相溶原理,有利于萃取反应进行。(1分)2—4萃取过程属什么反应类型。配体取代反应(1分)第3题(11分)3—1PCl3和NH3在CHCl3中于195K时生成A物质,A不稳定在稍高温度下即分解为一种不溶于液氨、氯仿等溶剂中的黄色无定形物质B,B中含磷68.89%。写出生成A的化学反应方程式和A分解为B的反应方程式,画出B的路易斯结构式。3—2POCl3和NH3作用生成一种易溶于水的晶体C,它在NaOH溶液中水解浓缩得化合物D,D于483K时置于真空条件下发生缩合反应生成E,数天后将E在水中重结晶得到含十个结晶水的盐类F,F和十水焦磷酸钠是等电子体。(1)写出POCl3和NH3作用生成C的反应方程式。\n(2)写出C在NaOH溶液中水解生成D的反应方程式。(3)写出D转变为E的反应方程式,画出E的阴离子结构简式。3—3过氧化氢作用于冷的饱和的硫代硫酸钠溶液,冷却后得一种含硫为40.37%的固体,写出化学反应方程式及其阴离子结构。(2分)第4题(10分)锂电池广泛用于手机、数码相机及便携式电脑中。锂电池的负极通常由金属锂构成,正极由二氯亚砜和碳材料构成。此种锂电池在放电时有气体产生。4-1写出锂电池放电时的负极反应、正极反应及总反应。负极:(1分)正极:(1分)总反应:(2分)4-2从下面所给电对中选择合适的电对,利用其标准电极电势计算电池反应的标准电动势。(2分)4-3常温下,若电池反应系数为整数时的平衡常数为1.0×103Pa,求所产生气体的平衡分压。(2分)4-4该反应的熵是增加还是减少?反应是否自发进行?该反应的熵增加(1分)。反应自发进行(1分)。第5题(12分)锌铝合金的主要成分有Zn、Al、Cu、Si和Fe等元素。称取该合金样品1.1255g,用HCl和H2O2溶解、煮沸除去过量H2O2后过滤,滤液定容于250mL容量瓶中。按下列步骤测定各组分含量:5-1用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液,用6.45mL\n0.01122mol×L-1Na2S2O3溶液滴定至终点。写出碘量瓶中发生的化学反应方程式;溶液的pH太低或过高对分析结果有何影响?该滴定反应可用什么指示剂指示终点;计算合金中Cu的质量分数;2Cu2++4I-=2CuI+I2(1分)I2+2S2O32-=2I-+S4O62-(1分)pH太低,I-易被空气氧化,使结果偏高;(1分)pH过高,Cu2+易水解,I2易岐化,使结果偏低。(1分)可用淀粉溶液为指示剂。(1分)(1分)(1分)5-2另取25.00mL滤液于250mL锥形瓶中,加入过量的EDTA溶液,煮沸稍冷后加入适量六次甲基四胺调pH=5~6,再过量5mL,用Zn2+标准溶液滴至指示剂刚好变色,然后加入过量NH4F煮沸,再用0.03245mol×L-1Zn2+标准溶液22.50mL滴至终点。计算合金中Al的质量分数;说明加入过量NH4F的作用;解释为何前后两次用Zn2+标准溶液滴定。若三次平行测定Al的质量分数分别为0.1758、0.1748和0.1752mL,计算结果的相对平均偏差。(2分)加入过量NH4F是为了把与Al配位的EDTA置换出来:AlY-+6F-=AlF63-+Y4-(1分)第一次Zn2+标准溶液滴定是为除去多余的EDTA;第二次Zn2+标准溶液滴定被NH4F置换出来的EDTA;根据第二次n(Zn2+)®n(EDTA)®n(Al)®w(Al)(1分)‰(1分)第6题(12分)LiMO2(M为过渡金属)晶体是良好的导电材料,属六方晶系。其中Li在晶胞的顶点,三个M原子在六棱柱的三个不相邻的三角形的中线上并位于1/2的高度上,O原子也在这条中线上但高度分别为1/4和3/4。6-1试画出LiMO2的一个晶胞。(4分)6-2写出Li,M及O原子的分数坐标。Li(0,0,0)M()O()O()(各1分,共4分)6-3这个晶胞中O原子占据的是什么空隙?占据率是多少?两个四面体空隙(1分),占据分数为100%(1分)\n6-3这个晶胞中O原子占据的是什么空隙?占据率是多少?Li+在MO2-组成的平面层间运动,形成二维导体。(2分)第7题(8分)CaWO4是一种无机发光材料,属四方晶系,晶胞参数为a=525pm,c=1135pm,相当与由二个小立方体组成。上下两底面的8个顶点是WO42-,上面小立方体的3个面心是WO42-,下面小立方体的3个面心是WO42-,Ca2+填在上下二个小立方体的其余面心位置上,4个侧棱中点为Ca2+。7-1试画出CaWO4的一个晶胞。晶胞中有几个结构基元,结构基元是什么?晶胞中有4个结构基元(1分);结构基元是CaWO4(1分)。(3分)7-2推测其发光机理。WO42-为变形的扁平状变形四面体,为发光中心(3分)。第8题(6分)化合物A,B,C都具有分子式C5H8,它们都能使溴的四氯化碳溶液褪色。A与硝酸银氨溶液作用可生成沉淀,B,C不能,当用热的高锰酸钾溶液氧化时,化合物A得到丁酸和二氧化碳,化合物B得到乙酸和丙酸,化合物C得到戊二酸。试写出A,B,C的结构式。8.A:,B:,C:第9题(10分)滴滴涕(DDT)是20世纪60年代前广为应用的一种杀虫剂,它是由三氯乙醛和氯苯通过如下反应制备得到: DDT因其稳定性、脂溶性、药效普适性等特点,而大量生产,普遍使用,以致最终造成环境污染。从70年代初起,美国、瑞士等国相继禁止生产DDT。我国政府1985年明令全部禁止使用DDT。为了杀灭对人类有害的昆虫,而又避免或减少污染环境和破坏生态平衡,化学工作者进行了不懈的努力,研制出多种新型杀虫剂,以代替DDT等农药。例如化合物A(如下)就是其中的一种。 请完成下列各题:9-1氯苯是一种重要的化工原料,由苯和氯气生产氯苯的反应是( )A.化合反应 B.分解反应C.取代反应 D.加成反应9-2下列关于DDT的说法不正确的是 ( )A.DDT也能杀死有益的生物 B.DDT极易溶于水C.DDT是烃的衍生物 D.DDT不易被生物分解9-3化合物A含有的官能团有 。9-4南极企鹅和北极土著居民的体内也曾发现微量的DDT,造成这种情况的主要原因是__________。实验又证实,当初美国加利福尼亚州受污染的达莱湖里大鱼体内一类组织中,DDT的浓度竟高达7500ppm,可毒死食鱼鸟。这类组织是 。 9-5为避免或减少污染环境和破坏生态平衡,对化学新农药必备的生物化学特性,应作何规定? 。9-1C(1分)9-2B(1分)9-3双键、羟基、醛基(3分)9-4生物富集、食物链传递、DDT性质较稳定,脂肪(3分)9-5高效、低毒、低残留(2分)\n第10题(12分)写出下列反应机理10-110-210-1(共6分)10-2(共6分)