- 237.00 KB
- 2022-07-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
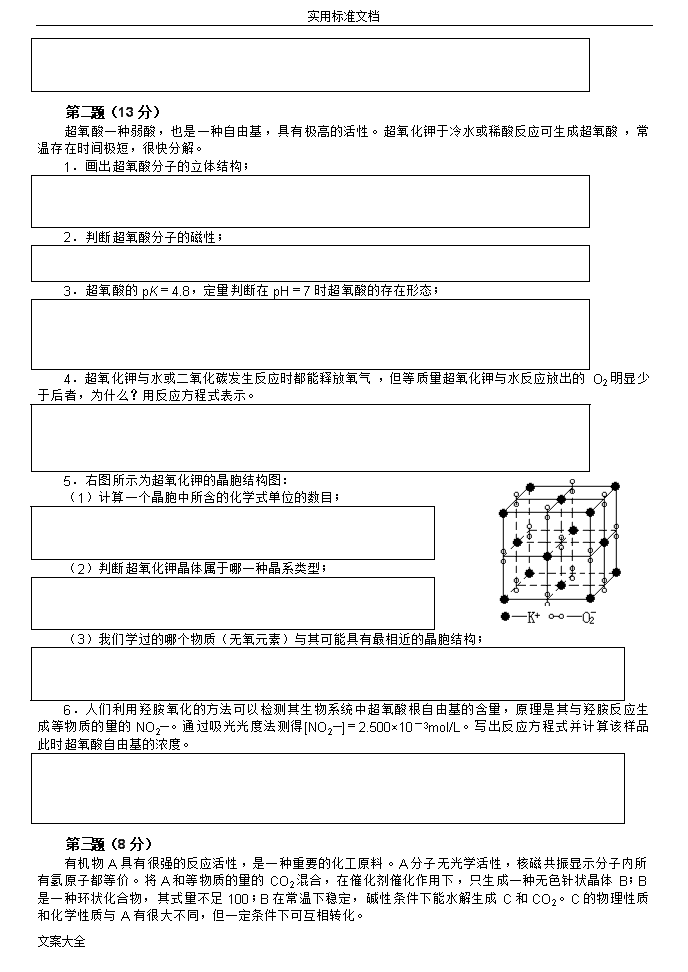
实用标准文档全国高中生化学竞赛初赛模拟试题(05)(时间:3小时满分:100分)H1.008相对原子质量He4.003Li6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr[223]Ra[226]Ac-LrRfDbSgBhHsMtDsRg第第题(12分)1.Kr→Rb+e(1分)2.(1)混合熵效应(1分)(2)Ba(l)+2RbCl(l)=BaCl2(l)+2Rb(g),Rb的沸点比Ba的低,易从平衡体系中挥发出来(1分)3.Na+KK++Na-(1.5分)4.Li+离子为最小的碱金属阳离子,与水分子的吸引力最大。(1分)5.Na+吸水性比K+强得多(1分)6.Li2C2+2H2O=2LiOH+HC≡CH↑(2.5分)7.2Li+H22LiH(1分)2CO+LiH=HCOOLi+C(2分)题(12分)下面是一组与碱金属有关的试题:1.85Rb是铷的一种稳定核素,而85Kr是氪的一种放射性核素,由85Kr→85Rb的半衰期为11年,写出核反应方程式。2.碱金属因性质不同,制法也不尽相同。(1)Li、Na常用电解法制备,所有电解质通常为混合熔盐而非纯物质。盐m.p.混合盐熔融温度LiClNaCl614803LiCl︰KCl=1︰1NaCl︰CaCl2=2︰3400~500580解释上表数据所反应出来的规律(2)K、Rb常用化学还原法制备,如Rb可用RbCl和Ba高温反应制得,说明制备原理。3.Na不溶于CH3OCH2CH2OCH3,但Na-K合金(Na︰K=1︰1)却易溶于其中,用适当的化学语言解释原因。4.试解释为什么许多锂的无水盐类比其它碱金属盐更容易潮解?5.为什么不能用NaClO3、NaNO3代替KClO3、KNO3作炸药?6.某活泼金属与一黑色粉末化合得A0.9875g,A遇水生成白色糊状沉淀和583.6mL可燃性气体B,已知参加反应A和生成B的物质的量相等。写出A→B反应方程式。7.Li遇一无色气体得盐岩型晶体D,D与CO1︰2反应生成一种盐和单质碳,写出反应方程式。文案大全\n实用标准文档第第题(13分)1.(1分)2.顺磁性(1分)3.c(O2-)/c(HO2)=10-4.8/10-7=102.2=158(1.5分)4.2KO2+2H2O=2KOH+H2O2+O24KO2+2CO2=2K2CO3+3O2(各1.5分)5.(1)4(1分)(2)四方(1分)(3)CaC2(1.5分)6.NH2OH+2O2—+H+=NO2—+H2O2+H2O(2分)5.000×10—3mol/L(1分)题(13分)超氧酸一种弱酸,也是一种自由基,具有极高的活性。超氧化钾于冷水或稀酸反应可生成超氧酸,常温存在时间极短,很快分解。1.画出超氧酸分子的立体结构;2.判断超氧酸分子的磁性;3.超氧酸的pK=4.8,定量判断在pH=7时超氧酸的存在形态;4.超氧化钾与水或二氧化碳发生反应时都能释放氧气,但等质量超氧化钾与水反应放出的O2明显少于后者,为什么?用反应方程式表示。5.右图所示为超氧化钾的晶胞结构图:(1)计算一个晶胞中所含的化学式单位的数目;(2)判断超氧化钾晶体属于哪一种晶系类型;(3)我们学过的哪个物质(无氧元素)与其可能具有最相近的晶胞结构;6.人们利用羟胺氧化的方法可以检测其生物系统中超氧酸根自由基的含量,原理是其与羟胺反应生成等物质的量的NO2—。通过吸光光度法测得[NO2—]=2.500×10-3mol/L。写出反应方程式并计算该样品此时超氧酸自由基的浓度。第第题(8分)1.A:B:C:HOCH2CH2OH(各1分)2.(1分)3.乙二醇的羟基易分子间或与水分子形成氢键(1分)4.+2CH3OH→CH3OCOOCH3+HOCH2CH2OH+2CH3COOH→CH3COOCH2CH2OOCCH3+CO2+H2O+2NH3→H2NCONH2+HOCH2CH2OH(各1分)题(8分)有机物A具有很强的反应活性,是一种重要的化工原料。A分子无光学活性,核磁共振显示分子内所有氢原子都等价。将A和等物质的量的CO2混合,在催化剂催化作用下,只生成一种无色针状晶体B;B是一种环状化合物,其式量不足100;B在常温下稳定,碱性条件下能水解生成C和CO2。C的物理性质和化学性质与A有很大不同,但一定条件下可互相转化。文案大全\n实用标准文档1.写出A、B、C的结构简式;A:B:C:2.写出A的同系物中具有光学活性且式量最小的物质的结构简式;3.为什么C在溶沸点和溶解性等物理性质上与A有很大差异;4.B除与水能反应之外,还能与醇、酚、酸、胺等物质反应,写出B与甲醇、乙酸、氨气反应的化学方程式。第第题(12分)1.RuO4的氧化性强;OsO4的稳定性强。(各0.5分)主要是因为Os的原子半径大,能很充裕的容纳下4个氧原子(0.5分)2.OsO4熔沸点高(0.5分)原因是Ru和Os是同族的氧化物,分子的相对质量大,范德华力大,熔沸点高(0.5分)3.(1)A:H2[RuO2Cl4](1分)(2)Cl2+2HCl+RuO4→H2[RuO2Cl4]+O2↑(1分)(3)(1分)前者更稳定,因为结构更对称(1分)4.(1)2CsCl+4HCl+RuO4→Cs2[RuO2Cl4]+Cl2↑+2H2O(1分);(2)B更稳定,溶解度更小(0.5分);因为Cs+半径远远大于Na+半径,而RuO2Cl42-阴离子半径大,Cs+与之更匹配,因而更稳定和溶解性更小(1分)5.(1)D:Cs2[OsO2(OCH3)4](1.5分)(2)OsO4+2CsOH+5CH3OH→Cs2[OsO2(OCH3)4]+4H2O+HCHO(1.5分)题(12分)Ru和Os同一族,RuO4和OsO4具有相似的性质,如都易溶于CCl4,都是有毒的氧化剂。试根据题意回答下列问题:1.试比较RuO4和OsO4的稳定性和氧化性强弱。为什么?2.比较RuO4和OsO4熔沸点的高低。为什么?3.将盐酸和Cl2作用于RuO4,可以得到一种二元酸A,A的酸根离子是一种变形八面体的配离子。已知A中Ru的氧化数为+6。(1)试写出A的分子式(2)写出生成A的化学反应方程式。(3)写出配离子的结构式,并判断哪一种结构最稳定?说明理由。4.向RuO4的盐酸溶液中加入CsCl能制得红紫色晶体B。B的阴离子与A的阴离子相同。若加入NaCl,其他条件完全相同,可以生成化合物C。(1)写出生成B的化学反应方程式。文案大全\n实用标准文档(2)B和C哪一个更稳定,溶解度更小?为什么?5.将OsO4加到甲醇中,再加入CsOH,可以将OsO4还原成含Os(VI)的盐D。D的酸根为变形八面体,有两种化学环境的氧原子,其个数比为2︰1,同时生成与D等物质的量的甲醛。已知D中不含有O—H键。(1)确定D的化学式(2)写出化学反应方程式。第第题(6分)1.(1分)2.SiO2+C+2Cl2=SiCl4+2CO(1.5分)(3.5分)CH2=CHCH3CH2=CHCH2BrCH2=CHCH2MgBr产物题(6分)四烯丙基硅烷具有多个末端双键,反应活性强,其Si—C键稳定,是近年来对纳米结构树枝状聚合物的合成和应用研究中的重要的合成前驱体之一。1.写出四烯丙基硅烷的结构;2.以丙烯为有机原料、SiO2为主要无机原料,合成四烯丙基硅烷,写出反应流程图。第第题(8分)1.3SiF4+4CH3OH=2H2SiF6+Si(OCH3)4(2分)2.M=ρNAV/Z=l.66×6.02×1023×(926.3×10-10)2×(1789.8×10-10)/4≈384(1.5分){[(NH2)2CO]2H}2SiF6(2分)3.氢键(1分)4.H2SiF6易分解释放出HF,HF有较强的腐蚀性,剧毒,药效较短;而与尿素结合,较稳定,不易分解放出HF,药效更长,酸性减弱,防腐蚀性能更好。(1.5分)题(8分)把SiF4气体通入甲醇中得到两种产物A和B,其中A具有与硫酸相当的酸性;A与尿素化合得到晶体C,C是一种新型农药。分析C晶体得到如下数据:a=b=926.3pm、c=1789.8pm、α=β=γ=90°、Z=4、ρ=1.66g/cm3。1.写出SiF4与甲醇反应的化学方程式;2.计算C的摩尔质量,并确定其化学式;3.A能与尿素化合,是由于产生了什么作用力;4.A、C作为农药具有相似的药性,但C比A的药效和防腐蚀性更为优越,为什么?文案大全\n实用标准文档第第题(10分)1.NH2OH(1分)羟氨(1分)NH4NO2+NH3+2SO2+3H2O=(NH4)2SO4+[NH3OH]HSO4(1分)2.CH3NHOH(3分)羰基吸电子,且O、C、N间形成了离域π键,使得O—H键中的电子向π键体系中偏移,则H+易于电离出来。(1分)3.经式:(1分,对映体0.5分)面式:(1分,对映体0.5分)题(10分)将NH4NO2溶于适量氨水中,通入SO2将NO2-还原,得到摩尔比为1︰1的两种产物,其中一种为(NH4)2SO4,另一种为1︰1型的离子化合物A。将A与乙酸乙酯混合,发生缩合反应,产生一种名为Hydroxamicacid的一元酸B,用0.2mol/L的NaOH标准溶液滴定,每克B耗去66.6mLNaOH(aq)。B可与Fe3+在弱酸性环境中形成紫红或深红色配合物C,此反应可用于检验酯或酰胺。1.写出A物质用碱处理后的含氮产物化学式和名称,写出合成A的化学方程式。2.画出Hydroxamicacid的结构简式,并说明其为什么有酸性。3.画出C的结构式,若有异构体则并画出。第第题(8分)1.Cu2S+2MnO4-+8H+=2Cu2++SO42-+2Mn2++4H2O5FeS+9MnO4-+32H+=5Fe3++5SO42-+9Mn2++16H2O5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O3Cu2S+10NO3-+16H+=6Cu2++3SO42-+10NO+8H2OFeS+3NO3-+4H+=Fe3++SO42-+3NO+2H2O2Cu2++4I-=2CuI↓+I22Fe3++2I-=2Fe3++I2I2+2S2O32-=S4O62-+2I-(各0.5分)2.2n(Cu2S)+9/5n(FeS)=0.7500×0.02480-1.0000×0.01800/5(1分)2n(Cu2S)+n(FeS)=0.5000×0.02200(1分)n(Cu2S)=0.003moln(FeS)=0.005mol(1分)m(Cu2S)=0.4775gm(FeS)=0.4397mol(1分)题(8分)现有FeS和Cu2S的混合物样品,取质量相等的2份试样:①在24.80mL0.7500mol/L的KMnO4/H+溶液中缓慢加入试样,完全反应后(无气体和沉淀),过量的KMnO4溶液用1.0000mol/L的FeSO4溶液进行滴定,消耗FeSO4溶液18.00mL。②取另一份试样,加入NaNO3固体和稀硫酸溶液,完全反应后(无沉淀)除去NO3-,所得溶液中加入足量KI固体,然后用0.5000mol/L的Na2S2O3溶液滴定,消耗Na2S2O3溶液22.00mL。1.写出所有反应的离子方程式;2.计算每份试样中FeS和Cu2S的质量;第第题(10分)1.Ph2C(OH)C≡CH(1.5分)1,1-二苯基丙炔醇(0.5分)2.(各2分)3.A形成属加成反应B形成属取代反应(各0.5分)4.B:sp3C:sp3d(各0.5分)5.6(1分)3(1分)题(10分)据报道,某些Z-式非碳环醇类有机锡化合物是一类有抗癌活性物质。芳香族醇类有机物A的化学式为C15H12O,无光学活性,与[Cu(NH3)2]+反应生成棕红色沉淀;N2保护下将A与等摩尔三苯基氢化锡(Ph3SnH)的乙醚溶液在过氧化苯甲酸的催化下于室温搅拌30h,蒸去溶剂后用无水乙醇重结晶3次得Z-式化合物B纯品。将ICl的四氯化碳溶液滴入等摩尔B的四氯化碳溶液中继续反应2.5h,蒸去溶剂后残留物用环己烷的四氯化碳混合溶剂重结晶3次得产物C。C中含Cl而不含I,且Cl元素的百分含量约为7%。已知B、C中Sn的杂化类型是不同的,B是链状分子而C是环状分子,但由B转变为C时Z式构型不变。请回答:1.写出A的结构简式并命名2.写出B、C的立体结构简式;A:B:文案大全\n实用标准文档3.指出形成B和C的反应类型。4.指出B和C中Sn的杂化类型。5.C有多少种满足条件的位置异构体,其中有对映体的有几个。第第题(13分)1.A:(3分)B:(1分)2.有芳香性,较稳定(1分)3.(1分)4.(1)C:D:E:F:G:H:(各1分)(2)3-苯甲基-2,4,6-庚三醇(1分)题(13分)有机物A的化学式为C7H8O2,所有C、O原子共平面,且分子呈现镜面对称;核磁共振显示A分子有2种类型的H,2个O的存在环境也完全不同;A分子内有羰基和双键,但无典型羰基和双键的反应。A与强酸水溶液加热得BC7H10O3,B与Tollen、Fehling试剂不反应;核磁共振显示B分子也只有2种类型的H;B分子内没有碳碳双键,但有羰基的典型反应。1.写出A、B的结构简式;A:B:2.A无典型羰基和双键的反应,解释之;3.A能与盐酸成盐,画出盐的结构简式;4.A的合成路线如下:CD(无顺反异构体)E(有顺反异构体)F(有对映体)G(有对映体)HA(最后一步脱去苄基)(1)写出C~H各物质的结构简式;C:D:E:F:G:H:(2)命名F。文案大全\n实用标准文档参考答案(0804)文案大全\n\n\n